cGAS-STING信号通路在先天性免疫中的作用研究进展
于思慧,单朝萌,文雪霞,张 莹
(沈阳农业大学 动物科学与医学学院/东北畜禽疫病研究教育部重点实验室,辽宁沈阳 110161)
先天性免疫是动物机体抵抗病原微生物感染的第一道防线,同时也是激活适应性免疫的必要条件,对动物机体抵御外界微生物感染至关重要。当外界病原微生物入侵动物机体时,先天性免疫细胞通过其表面的模式识别受体(pattern recognition receptors,PRRs)识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs),引发信号级联反应,最终促进Ⅰ型干扰素和促炎细胞因子表达上调,启动细胞自主防御机制。
cGAS-STING信号通路是先天性免疫的重要组成部分。该信号通路包括环磷酸鸟苷-腺苷合成酶(cyclic GMP-AMP synthase,cGAS)和干扰素基因刺激蛋白(stimulator of interferon genes,STING)两个主要因素。病原入侵宿主细胞时会释放各种病原相关分子模式,病毒和细菌的双链DNA是非常重要的PAMPs,它们可激活cGAS,使其构象发生变化,进而催化合成环鸟嘌呤核苷酸腺嘌呤核苷酸(2′,3′-cyclic GMP-AMP,cGAMP)。cGAMP行使第二信使功能,结合并激活STING,活化的STING可招募并活化细胞内TANK连接激酶1(TANK binding kinase-1,TBK1)。而TBK1可磷酸化干扰素调节因子3(interferon regulatory factor 3,IRF3),使其活化形成二聚体并易位至细胞核,从而激活I型干扰素基因的转录。此外,cGAS-STING信号通路也可通过核因子κB(nuclear factor kappa-B,NF-κB)诱导炎性细胞因子产生。论文对cGAS-STING信号通路激活先天性免疫的分子机制及病毒通过该信号通路调控机体先天性免疫策略的研究进展进行综述,以期为研究cGAS-STING信号通路及其与病毒间的相互作用提供参考。
1 cGAS-STING信号通路介导先天性免疫
1.1 cGAS的激活
宿主细胞的PRRs识别细胞不同部位的PAMPs,是触发先天性免疫反应的第一步。cGAS作为一种模式识别受体,主要识别胞质DNA。外源病原微生物DNA是激活cGAS的主要诱因。除此之外,cGAS也可以识别各种类型的内源性DNA,包括细胞核DNA和线粒体来源的胞质DNA[1]。cGAS通常存在于细胞质中,也定位于细胞膜和细胞核。但在细胞核中,cGAS暴露于染色体DNA时,如何区分染色体DNA和与感染相关的DNA,阻止其识别自身DNA,或使其驻留在核中却保持失活的机制尚不清楚。
cGAS含有核苷酸转移酶结构域和2个DNA结合结构域[2]。没有DNA存在时,cGAS处于失活状态。当与DNA结合后,cGAS形成二聚体,并与两个双链DNA分子形成2∶2复合物(图1),暴露出2个酶活性位点[2,3]。DNA结合并激活cGAS与其长度密切相关,DNA的长度越长,其激活cGAS的效力越强[4-6]。理论上,16 bp~18 bp的DNA足以激活cGAS。但是,在体外诱导cGAS催化活性时发现,小于20 bp的DNA与cGAS催化结构域的结合较弱。只有在cGAS浓度很高的情况下,小于20 bp的DNA才能有效诱导cGAS的催化活性[2,7],较短的双链DNA在低cGAS浓度时无法有效激活cGAS的原因可能是 cGAS浓度较低时不会形成二聚体。有意思的是,结合并激活不同物种cGAS活性的DNA长度存在差异。相较于人源cGAS,短的双链DNA更易激活鼠源cGAS的催化活性[8]。研究表明,即使人源cGAS浓度很高,长度小于40 bp的DNA也无法激活人源cGAS的酶活性[4-5]。
cGAS被激活后催化生成2′,3′-cGAMP,该过程涉及在同一催化位点进行两个不同的化学反应。第一步,cGAS以三磷酸腺苷(adenosine triphosphate,ATP)和三磷酸鸟苷 (guanosine triphosphate,GTP)为底物,将ATP转移到GTP的2′OH上,生成线性异二核苷酸磷酸酯pppG(2′-5′)pA。第二步,cGAS以线性pppG(2′-5′)pA为底物,将GTP部分分子转移到腺苷磷酸核苷的3′OH上[1]。cGAMP是第一个在多细胞生物中发现的环二核苷酸,在胞质DNA识别过程中发挥第二信使的功能,可以结合并激活STING[9]。
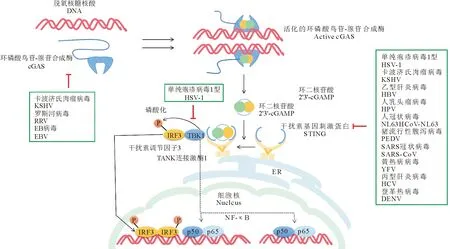
环状GMP-AMP合酶(cGAS)识别DNA配体并被其激活形成二聚体,活化的cGAS产生环状二核苷酸2′,3′-环状GMP-AMP(2′,3′-cGAMP)。cGAMP结合干扰素基因刺激物(STING),使其激活TBK1磷酸化IRF3。IRF3磷酸化后形成二聚体易位至细胞核激活Ⅰ型干扰素基因的转录。cGAS-STING信号转导也通过NF-κB(虚线)诱导促炎细胞因子基因的表达。方框中为本文介绍到的经由该通路关键蛋白调控先天性免疫的病毒。Cyclic GMP-AMP synthase (cGAS)recognizes the DNA and then is activated to form dimers.The activated cGAS produces the cyclic dinucleotide 2′,3′-cyclic GMP-AMP (2′,3′-cGAMP),which binds to the stimulator of interferon genes (STING)to activate TBK1 to phosphorylate IRF3.After phosphorylation,IRF3 forms a dimer and translocates to the nucleus to activate the transcription of type I interferon genes.cGAS-STING signal transduction also induces the expression of pro-inflammatory cytokine genes through NF-κB (dotted line).These viruses that mentioned in this article are shown in box regulate innate immunity through key proteins in this pathway introduced.图1 cGAS-STING信号通路及通过该通路关键蛋白调控先天性免疫的病毒Fig.1 cGAS-STING signaling pathway and viruses that regulate innate immunity through key proteins in this pathway
1.2 STING的激活
STING是一个多结构域的跨膜蛋白,主要定位于内质网膜,部分定位于线粒体和线粒体相关膜上[10]。其中,N端4个跨膜结构域主要负责将其锚定于膜结构上,C端的球状结构域包括二聚化结构域(dimerization domain,DD)和C端尾结构域(C-terminal tail,CTT)面向细胞质。结构域DD高度保守,对STING迁移至核周区域、活化下游信号通路非常重要;结构域CTT则主要负责招募、活化TBK1和IRF3[11]。STING以二聚体形式结合在内质网膜上,两个STING分子的跨膜结构域发生交换,并通过螺旋与朝向细胞质的C端结构域连接。STING二聚体的DD结构域形成一环状二核苷酸的V形配体结合袋[12]。
cGAMP和STING的DD结构域结合后,STING二聚体构象发生变化,其DD结构域相对于跨膜部分顺时针旋转180°,这种构象变化促进STING分子并排进行侧向寡聚化。研究发现,人源STING的寡聚化由连接跨膜结构域和DD结构域螺旋中148位半胱氨酸促进,表明STING活化几乎不可逆[1]。STING的寡聚化决定STING在细胞内亚定位的改变[13-14]。结合cGAMP后,STING发生寡聚化的同时,其在细胞内的亚定位也从内质网转运至高尔基体,后又至细胞核周围,并形成大的点状结构。布雷非德菌素A能够抑制STING的转移,进而抑制下游信号通路的激活,这说明STING的易位对于其信号通路的激活非常必要[15]。STING易位在信号转导中的重要性意味着STING的跨膜结构域在调节其活性中也发挥重要作用。
1.3 IRF3的激活
从内质网转移至核外周小体后,STING发生磷酸化修饰[15]。STING蛋白CTT结构域包含一高度保守的TBK1结合基序[16-17],通过该基序STING可与TBK1结合。IRF3结合基序(pLxIS基序)紧邻TBK1基序,与IRF3激活密切相关[18-19]。研究表明,稳态条件下,定位于内质网上的非活化STING二聚体上已结合了大量的TBK1[17]。但是,该状态下存在空间位阻,阻止TBK1发生反式磷酸化,故这些TBK1未被激活[1]。
当STING和cGAMP结合发生寡聚化时,其CTT结构域上结合的“顺式”TBK1分子与相邻二聚体的“反式”TBK1分子紧邻,“反式”TBK1分子的环可接近“顺式”分子激酶结构域的催化中心,使得TBK1可以反式磷酸化并激活紧密相邻的TBK1分子。活化的TBK1催化STING磷酸化,使其CTT结构域上pLxIS基序(p代表亲水性氨基酸,L代表亮氨酸,x代表任意氨基酸,I代表异亮氨酸,S代表丝氨酸)的丝氨酸残基磷酸化,pLxIS基序即成为IRF3的结合位点[19]。研究表明,TBK1仅能磷酸化相邻STING二聚体的CTT结构域,而对与其结合STING二聚体的CTT结构域则无此作用。STING被磷酸化后,通过pLxIS基序与IRF3结合,由于pLxIS基序紧靠具有催化活性的TBK1分子,IRF3可被紧靠的TBK1磷酸化[13,16]。随后,IRF3发生二聚化后进入细胞核,与共同活化因子CBP/p300(CREB binding protein/adenoviral E1A binding protein of 300 ku)结合发挥转录活性,最终激活I型干扰素基因的转录。
1.4 STING通路激活NF-κB
目前,STING介导的cGAS-STING通路激活NF-κB的机制尚不明确。一方面,研究表明TBK1在NF-κB活化的上游起作用[20-21]。另一方面,也有研究表明该功能不需要STING的CTT结构域[15,22],说明激活NF-κB不需要TBK1发挥作用。激活不含CTT结构域的STING,仍会激活NF-κB。因此,STING活化NF-κB可能受到寡聚化STING的DD结构域的调控[15,22]。
2 病毒通过cGAS-STING信号通路调控先天性免疫
cGAS-STING信号通路由两个重要因素构成,即cGAS和STING。病毒激活信号通路后,通过不同作用靶点影响信号通路发挥作用。目前的研究发现,许多病毒可靶向STING蛋白调控该信号通路诱导的先天性免疫反应。也有研究发现,一些病毒可通过该信号通路上蛋白分子cGAS、TBK1调控先天性免疫。
2.1 病毒靶向cGAS调控先天性免疫
cGAS是细胞质内DNA感受器,许多DNA病毒,包括疱疹病毒、腺病毒、乳头瘤病毒等均可以调控cGAS-STING信号通路,但通过靶向作用于cGAS蛋白影响信号通路激活的病毒较少。人类疱疹病毒8型(Human herpes virus 8,HHV-8),即卡波济氏肉瘤病毒(Kaposi's sarcoma-associated herpesvirus,KSHV)为一种严重威胁人类健康的疱疹病毒。该病毒编码的ORF52蛋白可通过与被感染宿主细胞的cGAS结合,直接抑制cGAS的酶活性[23]。ORF52蛋白也可与cGAS竞争性结合DNA底物[24]。cGAS活性受到抑制,cGAS-STING信号通路无法启动,其下游STING-IRF3的功能不能发挥,先天性免疫受到抑制,导致机体清除病毒的能力减弱。其他疱疹病毒,如罗斯河病毒(Ross river virus,RRV)、EB病毒(Epstein-Barr virus,EBV)的ORF52蛋白同源物也具有类似作用[23]。
2.2 病毒靶向STING调控先天性免疫
许多病毒可通过和STING互相作用,导致下游信号转导受阻,从而逃避机体先天性免疫,但不同病毒和STING相互作用机制不尽相同。下面分别从DNA病毒和RNA病毒两方面阐述其具体机制。
疱疹病毒是一类具有囊膜的DNA病毒,已有研究发现,疱疹病毒编码的多种蛋白均可拮抗cGAS-STING通路的激活,从而逃避宿主先天性免疫。单纯疱疹病毒1型(Herpes simplex virus-1,HSV-1)是疱疹病毒的代表种,也是已报道的第一种在体内外均可激活STING的DNA病毒,在试验系统中被广泛用作cGAS-STING通路的激活剂。敲除STING的小鼠感染HSV-1后,机体I型干扰素产生受到抑制,最终导致死亡[25]。除ORF52蛋白靶向cGAS外,KSHV编码的另一蛋白,干扰素调节因子1也可与STING相互作用,阻止STING与TBK1结合,进而抑制STING磷酸化[26]。乙型肝炎病毒(Hepatitis B virus,HBV)聚合酶是唯一抑制STING介导的β干扰素(interferon-β,IFN-β)启动子激活的HBV编码蛋白。HBV聚合酶的逆转录酶或RNase H结构域可抑制STING信号转导[27]。人乳头瘤病毒(Human papillomavirus,HPV)是一种普遍存在的DNA病毒。HPV编码的E7蛋白可与STING结合,从而有效抑制DNA激活的抗病毒反应,且研究发现,E7蛋白与成视网膜母细胞瘤蛋白(retinoblastoma,Rb)结合的LXCXE基序(L代表亮氨酸,X代表任意氨基酸,C代表半胱氨酸,E代表谷氨酸)对于拮抗cGAS-STING通路的激活也是必需的。缺失E7蛋白的HPV毒株感染可诱导宿主产生大量的I型干扰素[28]。与HPV的E7蛋白类似,腺病毒编码的E1A蛋白也可通过其LXCXE基序拮抗STING功能,抑制DNA病毒诱导的抗病毒反应[28]。
冠状病毒是自然界广泛存在的一大类RNA病毒。研究发现,人冠状病毒NL63(Human coronavirus NL63,HCoV-NL63)Nsp3蛋白膜定位的木瓜样蛋白酶结构域2(papain like protease 2-transmembrane domain,PLP2-TM)与STING共定位并相互作用[29]。PLP2-TM可阻止STING二聚体的形成以及STING-TBK1相互作用,且可减弱STING的K63泛素化修饰。猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)编码的Nsp3蛋白PLP2结构域也已报道可与STING相互作用并抑制STING的K63泛素化修饰。但是,两种病毒Nsp3发挥抑制作用的机制稍有差异,HCoV-NL63的Nsp3蛋白不一定需要PLP2-TM的去泛素化酶(deubiquitinase,DUB)活性,而对于PEDV而言,DUB活性则是必需的[30]。SARS冠状病毒(Severe acute respiratory syndrome coronavirus,SARS-CoV)编码的木瓜蛋白酶样蛋白酶(papain like protease,PLpro)也可抑制STING活化。与HCoV-NL63相似,SARS-CoV的PLpro也负调控STING二聚体形成和K63泛素化修饰,提示此功能可能为冠状病毒科木瓜蛋白酶样蛋白酶结构域的保守功能[29,31]。与冠状病毒类似,黄病毒科病毒也是一类有囊膜的单正链RNA病毒。已有研究证明,黄病毒科病毒的NS4B蛋白可通过STING蛋白调控先天性免疫。黄热病病毒(Yellow fever virus,YFV)的非结构蛋白NS4B可与STING共定位并相互作用,进而阻止STING和视黄酸(维甲酸)诱导基因蛋白I(retinoic acid-inducible gene-I,RIG-I)依赖的信号传导[32]。丙型肝炎病毒(Hepatitis C virus,HCV)NS4B蛋白与STING相互作用,阻止STING和TBK1结合[33]。NS4B也与内质网中的STING共定位从而减弱STING-TBK1的相互作用。此外,同疱疹病毒一样,黄病毒也进化出不同的机制来阻断STING激活。登革病毒(Dengue virus,DENV)编码的NS2B/3蛋白可作用于人源STING蛋白第93位至第96位氨基酸(LRRG)对其进行裂解和降解。鼠源STING蛋白无该氨基酸序列,故NS2B/3蛋白不能裂解鼠源STING蛋白,继而也不可阻断cGAS-STING信号通路诱导的IFN-β的产生[34]。
2.3 病毒靶向TBK1调控先天性免疫
细胞内多条诱导先天性免疫的信号通路需要TBK1蛋白的参与。本文主要阐释病毒通过cGAS-STING信号通路靶向TBK1调控先天性免疫应答的机制。HSV-1的皮层蛋白UL46是HSV-1拮抗宿主抗病毒免疫应答的重要蛋白。研究发现,UL46在外源表达和病毒感染时均不能影响STING的表达,而是直接与STING下游TBK1相互作用,抑制TBK1的活化,削弱TBK1与IRF3的相互作用,阻碍TBK1对IRF3的激活,从而阻断干扰素的产生[35]。
3 展望
cGAS-STING信号通路的发现和研究使人们对细胞感应、识别外源DNA从而诱导产生相应分子抑制外源微生物感染的机制有了更为全面和深入的理解和认识。虽然,关于该方面的研究不断取得重要进展,但是仍有很多科学问题有待进一步阐释。诸如,cGAS-STING信号通路不仅可识别病毒DNA,还可识别自身DNA。但是,目前尚不清楚cGAS在细胞核中如何区分染色体DNA和与感染相关的DNA,进而阻止对自身DNA的识别。病毒在感染宿主过程中,不断进化出各种策略拮抗宿主的先天性免疫反应。深入研究不同病毒逃逸机体先天性免疫机制,一方面有利于解析病毒的致病机理,从而开发有效的疫苗和药物;另一方面有助于全面透彻理解宿主的先天性免疫反应。

