一种新型可降解食道支架的生物力学研究
【作者】颜文涛,郁红漪,丁彪,郑忠伟,严航,林生力,周平红
1 上海市医疗器械检验研究院,上海市,201318
2 上海医立泰生物科技有限公司,上海市,200131
3 复旦大学附属中山医院 内镜中心,上海市,200032
0 引言
食道狭窄(esophageal stricture)是食道疾病的常见表征,多见于食管癌、内镜扩张术后、食道穿孔、瘘管、胃酸反流和化学药剂腐蚀等[1-4]。食道支架(esophageal stent,ES)是植入于人体食道起径向支撑作用,疏通梗阻并预防二次狭窄的医疗器械[5]。根据加工材料的不同,食道支架可分为金属支架、塑料支架、可降解支架等[6]。随着金属支架的普及,其术后缺陷也逐渐明确,包括:①永久滞留体内造成食道舒缩功能受损;②与食道摩擦引发炎症、食道黏膜增生;③刺激再狭窄等一系列问题[6-8]。由于金属食道支架长期植入人体以及径向支撑力过大的问题,近年多使用生物可降解材料如聚乳酸材料来代替[9-11]。与金属材料相比,左旋聚乳酸(poly L-lactic acid,PLLA)支架丝径更粗,有着更大接触面积和特有的降解性能,避免了对食道内壁的二次创伤和过度支撑。但目前对于可降解食道支架的相关研究多为体外降解性能和临床随访的研究[12-16],在HIRDES等[17]关于不同类型食道支架径向支撑力体外评价的研究中,PLLA材料的食道支架径向支撑力为4~5 N,约为镍钛合金材料的6%~31%,同时PLLA材料在8周后发生降解断裂,避免了持续过度支撑引起的食道增生。因此,本研究对一种新型可降解食道支架进行体外试验,与文献数据对比验证支架的径向支撑力有效性和降解后安全性,采用有限元分析方法进一步研究了支架在不同径向挤压工况条件下的应力应变特征,体外试验与有限元分析结果为临床使用可降解食道支架治疗食道狭窄提供了理论依据。
1 材料与方法
1.1 几何参数
针对临床上对食道不同周期内径向支撑性能的需求,本研究使用上海医立泰生物科技有限公司研发的可降解食道支架。该支架为PLLA材料交叠编织而成,几何构型如图1所示,详细参数如表1所示。
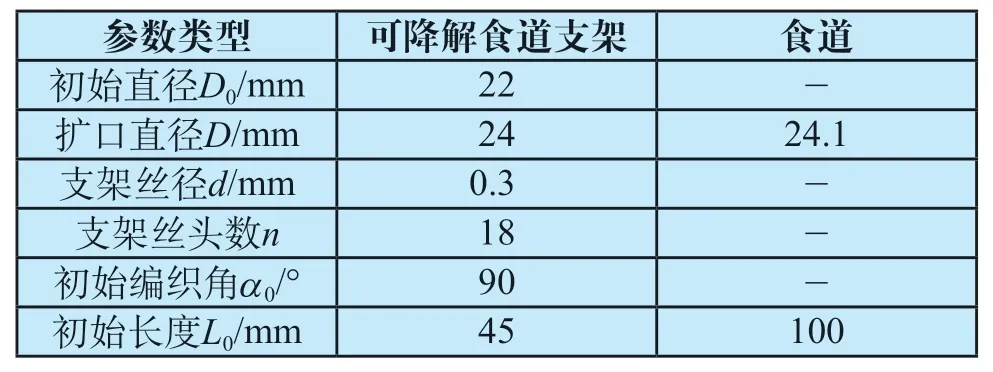
表1 可降解食道支架的几何尺寸和模型参数Tab.1 Geometrical dimensions and model parameters of the degradable esophageal stent
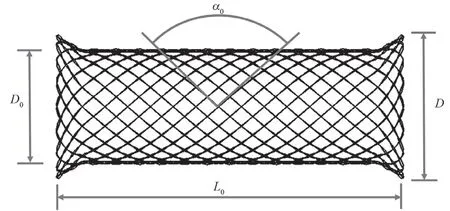
图1 生物可降解食道支架几何构型Fig.1 Geometric structure of biodegradable esophageal stent
1.2 模型建立
可降解食道支架的几何模型根据设计参数,使用AutoCAD(autodesk computer aided design,Autodesk,USA)进行三维建模,将模型导入UG(Unigraphics NX,Siemens PLM Software,USA)中提取支架丝的中心轴线。生成的中心轴线模型导入ABAQUS(Dassault Systems SIMULIA,Providence,RI,USA)中,支架丝直径为0.3 mm,支架丝之间为螺旋交叉型,左右旋线相互交叠编织,通过Beam31梁单元模拟编织支架丝线[18],PLLA材料参数设置为弹性模量4.6 GPa,泊松比0.38,密度1250 kg/m3[19]。
根据支架尺寸将压握管直径设置为24.1 mm,使用S4R壳单元进行模拟,既保证了对支架结构和力学行为的近似程度,又避免了采用大量实体单元造成的高计算成本[20]。
1.3 边界条件
食道对支架的压缩通过设置基于柱坐标系的位移边界条件模拟,包括加载和卸载两个过程,从初始的24 mm直径匀速压缩至12 mm后回弹。对食道模型设置位移边界条件以限制旋转和轴向运动[21-22]。食道管内表面和支架外节点形成的节点集定义为无摩擦的表面接触,设置食道支架自身的自接触。局部挤压和平行板挤压的模拟与径向挤压相似,三者挤压的模拟示意,如图2所示。
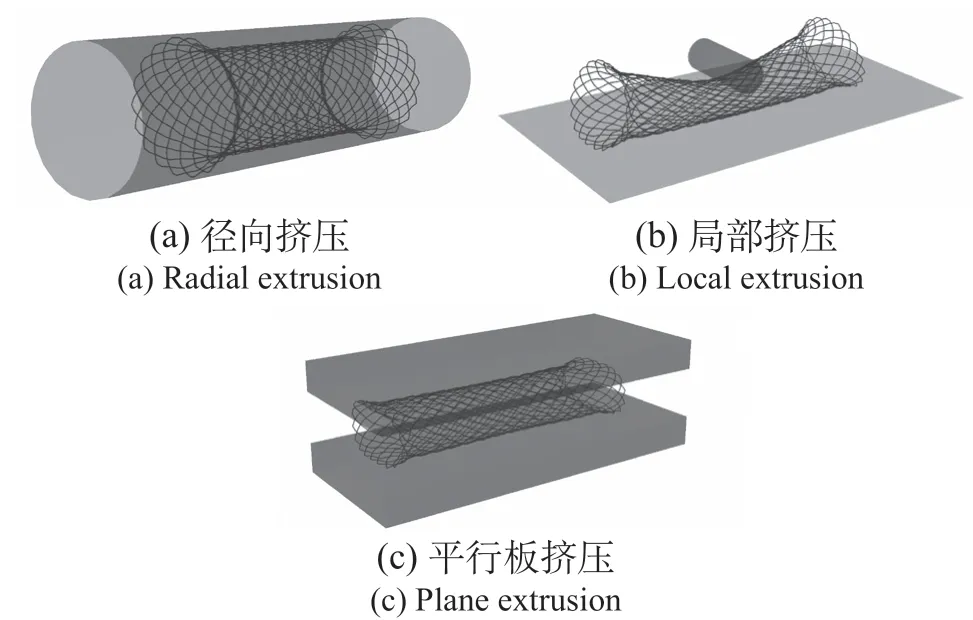
图2 支架挤压模拟 Fig.2 Extrusion simulation of stent
1.4 体外试验
有限元分析结果与真实状况存在一定的误差,因此需要通过体外试验与有限元分析结果对比验证模型准确性。本研究选用Blockwise TTR2径向支撑力测试仪进行径向挤压测试,将体外试验结果与有限元分析获得的支反力结果进行对比,验证可降解食道支架有限元模型的可靠性。
将支架浸入(37±1)oC 的人工胃液(pH=1.5)中。分别采集3个月和6个月时期可降解支架,将样品用纯化水冲洗干净,室温晾干,测试径向支撑力。
2 结果
2.1 有限元模型验证
使用径向支撑力测试仪对支架进行循环试验,测试结果与支架压握、扩张的有限元模拟结果进行对比,结果如图3所示,有限元结果与试验结果表现出一致的标准自扩张支架径向力曲线。从压缩曲线中分析得出,压缩过程中支架径向力在贴合期增长较为平缓,该阶段是两端扩口受压至初始直径的过程,压缩2 mm时支架径向力为0.86 N,随着支架与压握管内壁完全接触,支架径向力进入快速增长期,压缩5 mm时径向力为8.50 N,增长过程中编织角逐渐趋向于180°,当编织结构变化趋于稳定,径向力进入稳定增长期后,压缩过程中的径向支撑力最大值为11.22 N。卸载过程中支架对食道壁施加的最小持续扩张力定义为慢性外展力,在回弹至15 mm、17 mm和22 mm时慢性外展力分别为4.52 N、2.58 N和0.64 N。支架径向力性能与Ella-BD可降解食道支架回弹至15 mm时径向力(约为4 N)相近,验证了支架径向力的有效性[17]。
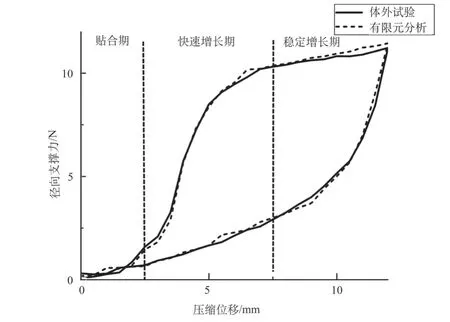
图3 径向支撑力测试结果Fig.3 Test results of radial force
2.2 径向挤压应力应变分析
可降解食道支架在径向挤压过程中,支架应力应变及食管壁应力分布,如图4所示。从图4(a)中可见应变呈对称式分布,主要位置是支架两端与食管壁接触部位,最大应变为1.98%,接近PLLA材料的断裂应变[23]。支架中端部分应变较不明显。在压缩过程中,支架未产生塑性变形,在卸载后能自主回弹。支架压缩过程中应力如图4(b)所示,结果显示最大压缩程度下von Mises应力峰值为65.25 MPa,接近PLLA材料拉伸强度极限[24]。
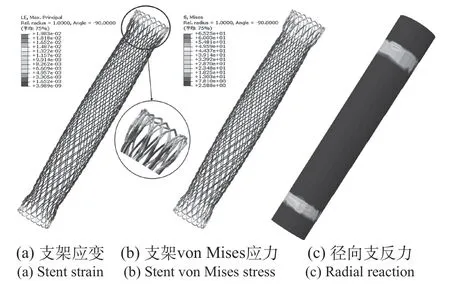
图4 径向挤压应力应变Fig.4 Radial extrusion stress and strain
支架移位是食道支架常见的失效形式之一,编织丝头部闭环设计能够增大端部支反力,进而增大支架与管壁间摩擦力。而支架的扩口可以增大接触应力和抗移位性能,在MOZAFARI等[25]的研究中,扩口直径和摩擦系数均与抗移位力成正相关。因此,可以通过分析食道表面的接触力分布验证支架构型的抗移位性能,模拟结果如图4(c)所示。压握管端口部分有明显的接触力,说明了该支架扩口设计的有效性。
2.3 局部挤压应力应变分析
局部挤压模拟的是食道单侧狭窄对支架的挤压作用,其测试的是支架局部抵抗挤压载荷的能力。可降解食道支架在局部挤压过程中支架应变如图5(a)所示,两端端口与食管壁接触区域支架应变较为明显,最大应变为0.49%。支架von Mises应力分布如图5(b)所示,挤压区域为应力最高区域,同时支架两端受挤压区域和支架中段下表面也存在较大应力分布。
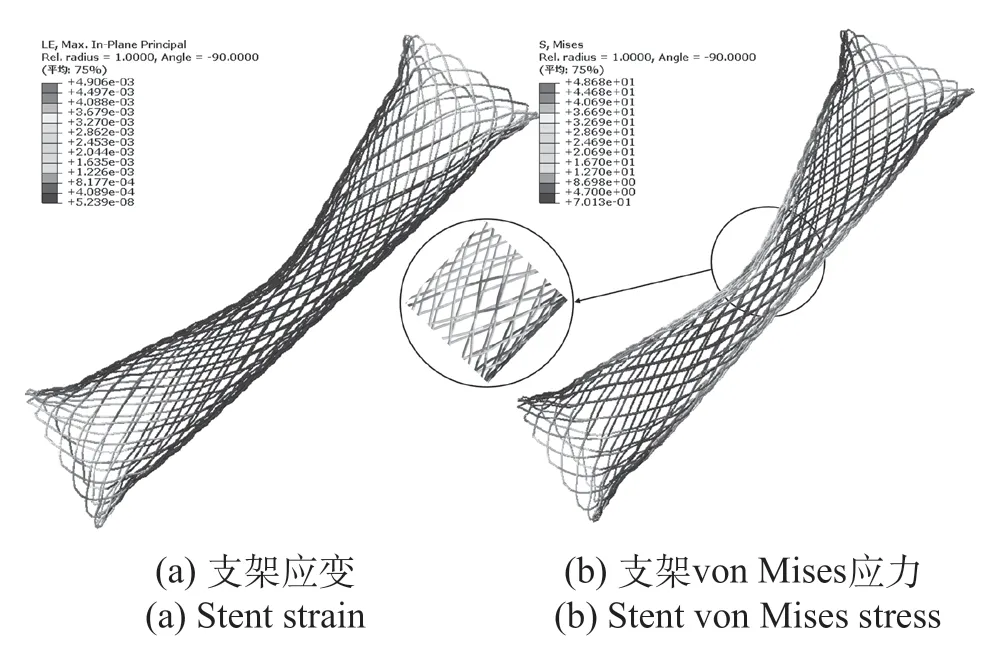
图5 局部挤压应力应变Fig.5 Local extrusion stress and strain
在局部挤压过程中,食道支架的von Mises应力随挤压程度的增大而增大,其应力数值,如表2所示。随着挤压程度的升高,支架最大应力从4.22 MPa升高至48.68 MPa,回弹过程中支架应力从22.89 MPa降低至3.81 MPa。局部挤压区域有较高的应力集中,卸载后支架挤压部位的回弹力较挤压时有所降低。
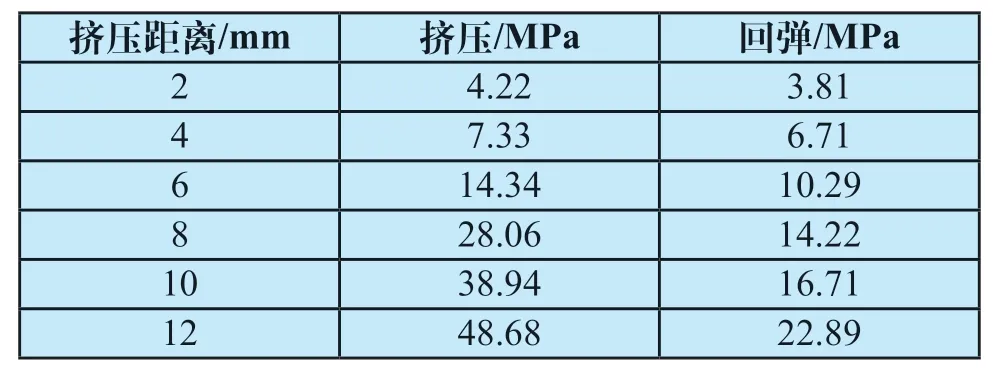
表2 可降解食道支架局部挤压von Mises应力Tab.2 Local extrusion von Mises stress of degradable esophageal stent
2.4 平行板挤压应力应变分析
平行板挤压模拟的是食道双侧狭窄对支架的载荷,其测试的是支架抵抗沿整体长度均匀分布载荷的能力。平行板挤压过程中支架应变应力特征,如图6所示。支架两端端口形变高于支架中段,支架整体形变呈双曲线构型,支架两端端口的最大应变为1.13%。支架表面应力分布与局部挤压类似,主要分布于挤压区域和支架两端区域。
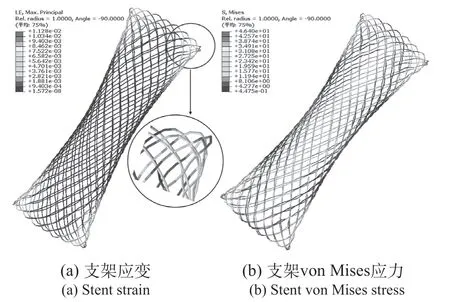
图6 平行板挤压应力应变Fig.6 Plane extrusion stress and strain
支架挤压应力数值,如表3所示。随着挤压程度的升高,支架最大应力从2.03 MPa升高至46.40 MPa,回弹过程中支架应力从45.98 MPa降低至1.81 MPa。平行板挤压的挤压应力略低于局部挤压时的等效应力,整体分布较为均匀,应力集中区域较小。
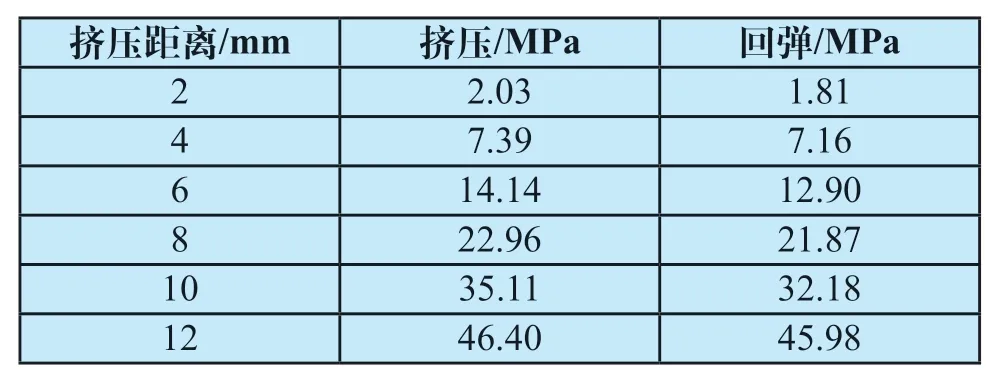
表3 可降解食道支架平行板挤压von Mises应力Tab.3 von Mises stress of plane extrusion of degradable esophageal stent
2.5 降解后支架径向力分析
图7为不同降解周期下支架径向挤压性能的测试曲线。降解三个月的支架径向支撑力最大值为10.93 N,较未降解支架保持了97%的支撑性能,在压缩5 mm时支架径向力为7.54 N。降解六个月的支架在压缩5 mm条件下径向力达到峰值5.72 N,较未降解支架保持了51%的支撑性能。支架径向力随着进一步压缩呈下降趋势,说明降解后支架结构变化不再继续保持高径向力增长水平,与图8不同降解时期支架实物图相对应,验证了降解的有效性。
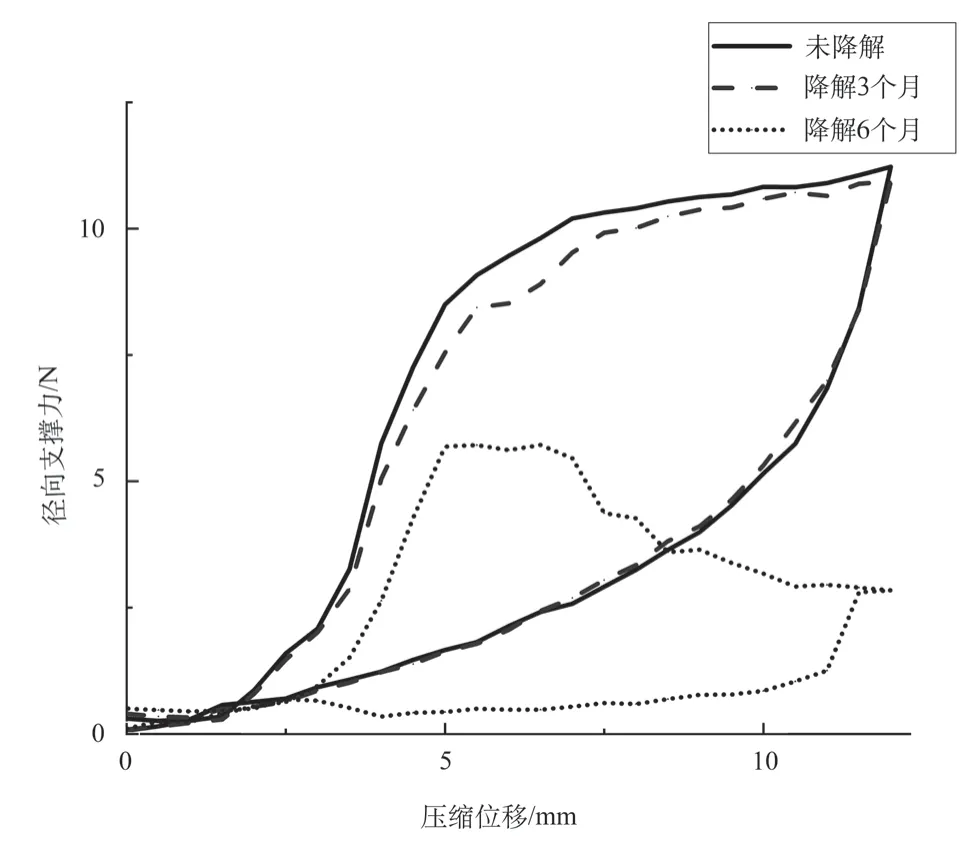
图7 不同降解时期支架径向支撑力Fig.7 Radial force of the stent in different degradation phases

图8 不同降解时期支架Fig.8 Stent in different degradation phases
3 结论
本研究基于体外径向支撑力试验和有限元分析相结合的方法,研究了一种新型可降解食道支架的径向力性能和应力应变特征,试验测得支架径向支撑力性能与同类型上市产品相近,交叠式的编织结构提升了支架的径向支撑力[26],支架两端喇叭口构型增大了接触面积和摩擦系数,降低了支架在食道内的移位可能,同时在降解六个月后支架径向力降低49%,避免了持续支撑而引起的食道内膜增生,对良性食道狭窄的术后恢复有较好的治疗效果。
径向挤压的体外试验数据显示,我们研究的食道可降解支架在压缩12 mm时最大径向力为11.22 N,回弹至15 mm、17 mm和22 mm时慢性外展力分别为4.52 N、2.58 N和0.64 N,与同类型上市产品的径向支撑力性能相近[17]。用有限元模型模拟相同的加载工况,提取结果中的支反力数据与体外试验进行对比,其变化趋势一致,验证了有限元模型的有效性。在径向均布载荷、局部载荷和整体轴向载荷的有限元模拟中,支架的应力和应变特征均处于聚乳酸材料的材料属性限度内,表明支架在食道内断裂风险较低。径向挤压工况下,支架最大主应力为65.25 MPa,最大应变为1.98%,主要集中于支架喇叭口处,同时端口与压握管接触区域的支反力集中明显,与增大抗移位能力的设计预期相符合。局部挤压工况下,支架最大应力为48.68 MPa,最大应变为0.49%,主要集中于挤压区域和两侧端口处,由于挤压区域较小,回弹时期的应力也降低较快。平行板挤压工况下,支架最大应力为46.40 MPa,最大应变为1.13%,与局部挤压相比,平行板挤压在回弹期应力降低较慢,端口受压形变大于支架中端,在实际使用中表现为与食道壁接触面积和支反力的上升,进而有一定的抗移位作用。在三种工况的有限元模拟中,支架端口连接处均有应力峰值的出现,因此在实际的生产加工中,尤其需要注意连接点处的处理,避免出现支架编织丝头端的断裂。降解后支架的径向力性能变化明显,降解三个月后的食道支架径向支撑力保留原先的97%,降解六个月后的食道支架PLLA材料发生降解断裂,符合预期的设计目的,最大径向支撑力保留原先的51%,降低了食道内壁持续性受压而发生内膜增生的可能,对患者的术后恢复有较好的过渡作用。
本研究还存在一定的不足之处,如分析中建立的食道模型为理想模型,未结合实际不规则的食道形状及环境温度条件进行建模,在不同降解时期材料的内部结构和材料性能的改变未能进行模拟,在后续的研究中,将针对此类问题,进行进一步的研究与分析。

