基于高通量测序的3种淫羊藿叶片内生细菌群落结构研究
李巧玲, 任明波, 曹 然, 安 杰, 杨小玉, 章文伟, 李品明
(重庆市药物种植研究所 重庆市道地药材规范化生产工程技术研究中心, 重庆 南川 408435)
植物内生菌是一类生长在植物体内而不引起任何症状的微生物类群。研究表明,内生菌有多种重要的生物学作用,如促生[1]、固氮[2]及诱导抗性[3]等。此外,有些内生菌甚至能够产生与宿主相同或相似的生物活性物质,如合成生长素、酶、生物碱等,已被广泛应用于食品、生物燃料、生物农药等一些产品的制造中[4]。近年来,植物内生菌作为一种广泛存在的微生物资源,引起了学者们的极大关注。张鹏等[5]研究发现,假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)为七叶一枝花根内生细菌的优势菌属,促生实验发现假单胞菌属菌株SCR21024对小麦幼苗有较强的促生作用。曾波等[6]对两种天南星内生细菌进行了分离,成功筛选到两株软腐病拮抗菌。邵金华等[7]采用组织块法从博落回的根、茎、叶中共分离出10株内生细菌,其中3株内生细菌可产生物碱,这是首次从博落回植株中分离得到的有效菌株,为后续博落回内生菌资源的开发奠定了理论基础。目前有关植物内生菌的报道涉及马铃薯[8]、辣椒[9]、番茄[10]等30多种农作物和20多种杂草,在人参[11]、重楼[12]、三七[13]等多种中药材中也发现了植物内生菌。因此,对特色药用植物内生菌进行深入研究,挖掘功能菌株,开发生物农药、肥料及生物活性化合物,对特色产业的发展具有重要的现实意义。淫羊藿属(EpimediumL.)隶属于被子植物门小檗科(Berberidaceae),该属植物种类繁多,全世界分布约41个种。淫羊藿是我国重要的草本植物,在中药、功能性药品和园林观赏等领域都具有重要用途[14]。中药淫羊藿和巫山淫羊藿均来自该属植物,两者都具有补肾阳、强筋骨、祛风湿的功效,用于肾阳虚衰、阳痿遗精、筋骨痿软、风湿痹痛、麻木拘挛等症状[15]。重庆地处西南,淫羊藿野生资源丰富,故研究其内生菌,对淫羊藿产业发展有重要的理论和现实意义。目前,对于淫羊藿内生细菌群落多样性的研究还处于空白状态,本研究选用三种淫羊藿为实验材料,通过构建16S rDNA克隆文库对淫羊藿叶片内生细菌的群落结构及多样性进行差异分析,旨在明确淫羊藿叶片中的优势及特有内生细菌,为淫羊藿品质的提升及有益内生细菌的综合开发及利用提供参考。
1 材料与方法
1.1 材料
1.1.1 供试材料 样品采自重庆市药物种植研究所淫羊藿林下栽培基地(107°12′14.04″E,29°7′58.46″N),海拔584 m的砂壤土栽培的淫羊藿。于2020年3月22日(晴天)上午,分别采集淫羊藿展叶盛期的粗毛淫羊藿(EpimediumacuminatumFranch.)新叶(AY)以及老叶(AO)、箭叶淫羊藿(EpimediumsagittatumMaxim.)新叶(BY)和老叶(BO)以及巫山淫羊藿(EpimediumwushanenseYing)新叶(CY)和老叶(CO)各3株两年生新鲜无病虫害的当年生新叶和去年生老叶,每个处理重复3次,样品采集后置于无菌自封袋中,迅速带回实验室于12 h内进行表面消毒处理。
1.1.2 培养基 LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,加双蒸水至1 000 mL, 用5 mol/L NaOH调pH至7.2,121 ℃灭菌30 min。
1.1.3 试剂与仪器 Plant DNA Isolation Reagent植物DNA提取试剂盒(上海宝生物工程有限公司);胶回收试剂盒(赛默飞世尔科技公司有限公司);无水乙醇、0.1%升汞,(重庆鼎国生物技术有限责任公司)。立式蒸汽高压灭菌锅(YXQ-100A,上海博讯实业有限公司);高速离心机(KH20R-II,湖南凯达科学仪器有限公司);数显恒温水浴锅(S-CH-6A,上海舍岩仪器有限公司);电泳仪(BG-Power300,成都比朗仪器有限公司);超微量蛋白核酸分析仪(BioDrop DUO+,杭州恒流科技有限公司);PCR仪(T100,美国Bio-Rad伯乐上海凌仪生物科技有限公司)。
1.2 方法
1.2.1 样品处理 三种淫羊藿叶片表面用蒸馏水清洗干净,滤纸吸干表面水分。用75%乙醇浸泡样品40 s,然后0.1%升汞表面消毒15 min,最后用无菌水反复冲洗5~8次,用无菌滤纸吸干表面水分。移液枪吸取最后一次冲洗的无菌水200 μL,涂布LB培养基作为空白对照,重复3次,观察是否有菌落产生,作为评判样本表面是否消毒彻底的指标[16]。
1.2.2 DNA提取、PCR扩增及测序 表面消毒后的淫羊藿叶片采用Plant DNA Isolation Reagent提取总DNA。0.8%琼脂糖凝胶电泳和超微量核酸分光光度计检测DNA浓度和纯度,并将样品稀释至1 ng/μL。以稀释后的基因组DNA为模板,采用细菌通用引物338F:5′-ACTCCTACGGGAGGCAGCA-3′和引物806R:5′-GGACTACHVGGGTWTCTAAT-3′扩增细菌16S rDNA V3+V4区域。PCR扩增产物经2%琼脂糖凝胶电泳检测后,使用Thermo Scientific公司的胶回收试剂盒对目标片段进行回收。回收产物稀释至20 pmol/L后上机测序,委托北京奥维森基因科技有限公司完成后续高通量测序。
1.2.3 序列处理与分析 高通量测得的原始序列经过双端拼接、过滤、去除嵌合体、去除宿主线粒体和叶绿体序列,得到优化序列;然后将优化序列在97%的相似度水平下进行聚类,获得OTUs(operational taxonomic units),并根据OTU的序列组成得到其物种分类。基于OTU分析结果,通过α多样性分析、β多样性分析及差异优势菌群等分析,评估3种淫羊藿内生细菌的群落结构和多样性差异,揭示3种淫羊藿内生细菌的群落组成。采用Excel 2016和SPSS 20.0软件进行数据方差分析及多样性指数分析。
2 结果与分析
2.1 测序结果及OTU丰度
从表1看出,6组样品测序共获得1 056 219条原始序列,原始序列经拼接、过滤后共产生1 017 098条有效序列,每个样品至少产生169 517条有效序列。对有效序列在97%的相似度水平下进行聚类、获得每个时期样品的OTU数,6组样品共产生4 848个OTU,其中,CO的OTU最多,为512个,AY的OTU最少,为158个。从图1看出,6组样本共有的OTU数目为94个,AO、AY、BO、BY、CO、CY特有的OTU数目分别为29、16、42、56、341和45个,其余OTU为样本两两共有。其中,CO样本中特有的OTU数目最多,预示着巫山淫羊藿老叶中存在较多的特有微生物种类。

表1 各样品内生细菌的高通量测序数据及OTU量
2.2 优势内生细菌群落组成分析
不同淫羊藿叶片内生细菌在门水平上排名前十的群落组成如图2所示,6组样品中的优势菌群主要包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)及芽单胞菌门(Gemmatimonadetes),占总细菌数的98%以上,但各菌群在在每组样品中所占的比例稍有差异。其中,变形菌门相对丰度最高,占6个样品中的比例分别为81.89%、87.50%、67.61%、57.12%、60.87%和71.68%;其次为厚壁菌门,所占比例分别为5.69%、6.99%、18.98%、34.52%、10.85%和22.26%;放线菌门相对丰度依次为9.24%、3.52%、7.29%、4.98%、7.61%及3.44%,而其他菌类相对丰度较低,如软壁菌门(Tenericutes)、纤维杆菌门(Fibrobacteres)、衣原体门(Chlamydiae)、疣微菌门(Verrucomicrobia)等。不同种淫羊藿叶片内生细菌的群落组成及相对丰度有一定的差异,其中,CO样品物种组成最为丰富,在门水平上的物种种类最多;变形菌门在粗毛淫羊藿样品中占优势,在箭叶淫羊藿和巫山淫羊藿中则明显占劣势;厚壁菌门则在箭叶淫羊藿和巫山淫羊藿的新叶样品中占绝对优势。结果表明,不同淫羊藿叶片内生细菌群落组成各不相同,变形菌门、厚壁菌门和放线菌门为三大优势菌群,三者丰度之和达73%以上,而其他细菌类群为非优势菌群。

图1 不同区组内生细菌OTUs韦恩图Fig.1 OTUs Venn diagram of endophytic bacteria in different compartments

图2 门水平淫羊藿样品内生细菌的群落结构及分布Fig.2 Structure and distribution of microbial community at phylum level of different samples
由图3可以看出,6组淫羊藿叶片内生细菌在属水平上丰度较高的菌主要有甲基杆菌属(Methylobacterium)、鞘氨醇单孢菌属(Sphingomonas)、放线孢菌属(Actinomycetospora)、Kroppenstedtia属、泛菌属(Pantoea)及乳杆菌属(Lactobacillus)等。各样品的优势菌属(相对丰度>5%)存在一定差异,如在粗毛淫羊藿样品中甲基杆菌属、鞘氨醇单孢菌属相对丰度较其余样品高(相对丰度不足2%),而Kroppenstedtia属在箭叶淫羊藿样品中的相对丰度较高,乳杆菌属、魏斯式菌属(Weissella)、马赛菌属(Massilia)和泛菌属的相对丰度则在巫山淫羊藿样品中的丰度较高。
由图4可以看出,3种淫羊藿老叶和新叶优势内生细菌(相对丰度>5%)在属水平上相对丰度差异较大,如在粗毛淫羊藿叶片中,甲基杆菌属和Kroppenstedtia属在老叶中的相对丰度较高,而乳杆菌属、魏斯式菌属和泛菌属在新叶中相对丰度较高;箭叶淫羊藿,甲基杆菌属、鞘氨醇单孢菌属和马赛菌属在老叶中的相对丰度较高,而Kroppenstedtia属和泛菌属相对丰度显著低于新叶;在巫山淫羊藿样品中,甲基杆菌属、鞘氨醇单孢菌属、Kroppenstedtia属和马赛菌属在老叶中的相对丰度较高,而乳杆菌属、魏斯式菌属和泛菌属在新叶中相对丰度较高,这些结果达到高度一致,这些菌的存在是否与其生长或物质合成有关,还需要做进一步的验证。

图3 属水平淫羊藿样品内生细菌的群落结构及分布Fig.3 Structure and distribution of microbial community at genus level of different samples

图4 3种淫羊藿老叶和新叶优势内生细菌分析Fig.4 Analysis of dominant endophytic bacteria in the old and new leaves of three Epimediums
2.3 3种淫羊藿叶片优势内生细菌的差异分析
以3种淫羊藿叶片内生细菌类群为对象,使用LEfSe分析不同淫羊藿叶片内生细菌群落中主要差异物种(LDA Score预设值3.0,高于3.0视为有显著差异)(图5)。图5中LDA Score的绝对值代表了差异物种的影响大小,LDA值越大,代表菌群差异性越大。分析结果表明,不同种淫羊藿内生细菌在新老叶片中均存在有统计学差异的物种,甲基杆菌科(Methylobacteriaceae)、甲基杆菌属(Methylobacterium)、鞘氨醇单孢菌属等细菌群落在AO样品中相对丰度较高;α-变形菌纲(Alphaproteobacteria)和甲型变形菌纲(Alphaproteobacteria)在AY样品中相对丰度较高;嗜冷杆菌属(Psychrobacter)和Marinilabiaceae科等在BO样品中存在丰富;而γ-变形菌纲(Gammaproteobacteria)、假单胞菌目(Pseudomonadales)、莫拉菌科(Moraxellaceae)和梭菌纲(Clostridia)等在BY样品中相对丰度较高;在CO样品中的物种最为丰富,其中包括黄单胞菌目(Xanthomonadales)、气单胞菌属(Aeromonas)和气单胞菌科(Aeromonadaceae)等细菌类群。
2.4 优势内生细菌的功能分析
对3种淫羊藿叶片优势内生细菌的功能进行统计(表2)。3种淫羊藿内生细菌的优势益生菌群落结构略有差异,主要集中在变形菌门、厚壁菌门和放线菌门所属的13个属中,其功能主要体现在促进土壤有机物的分解、固氮解磷促生长、合成多种次级代谢产物、诱导作物对病原微生物的抗性等方面。这些淫羊藿内生细菌的功能信息,将为淫羊藿的高效栽培及有效成分的生物合成提供参考依据。

表2 3种淫羊藿叶片优势内生菌群功能分析

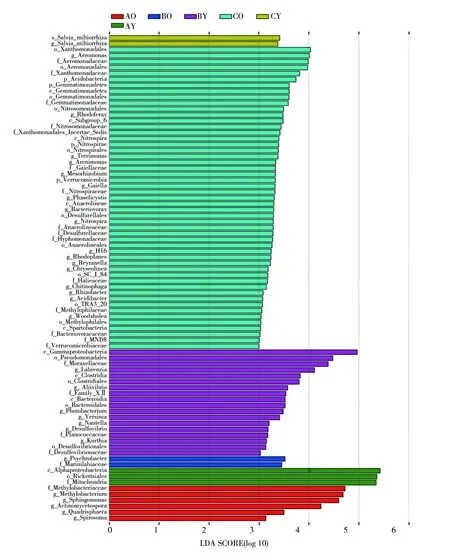
图5 淫羊藿叶片内生细菌LEfSe分析Fig.5 LEfSe analysis of endophytic bacteria in leaves of Epimedium
2.5 多样性分析
2.5.1 α多样性分析 稀释曲线可以用来比较测序数据量不同的样本中物种的丰度,也可以用来说明样本的测序数据量是否合理。采用对序列进行随机抽样的方法,以抽到的序列数与其所能代表OTU的数目构建稀释曲线(rarefaction curve),当曲线趋向平坦时,说明测序数据量合理。各样品在相似度为97%水平下的稀释曲线见图6,由图6可知,每组样品稀释曲线逐渐趋于平缓,表明样品序列充分、取样合理,可以用于后续数据分析。α多样性反映样品内物种丰度(richness)及物种多样性(diversity),本研究使用Mothur(version v.1.30)软件,对样品α多样性指数进行了评估。Chao1指数为物种丰度指数,用以估计群落中的OTU数目。observed_species指实际观测到OTU的个数。Simpson、PD_whole_tree和Shannon指数为物种多样性指数,其中PD_whole_tree和Shannon指数的数值越大,说明群落多样性越高,而Simpson指数越小,物种多样性越高。从3种淫羊藿叶片样品α多样性指数分析结果(表2)可以看出,CO样本中的OTU数、observed_species、PD_whole_tree、Shannon及chao1指数值均最高,显著高于其他样品,同时simpson指数值最小,说明巫山淫羊藿老叶中内生细菌群落的物种多样性和丰度均显著高于其他样品。

图6 相似度为97%水平下各样品的稀释曲线Fig.6 Rarefaction curves of each sample at cutoff level of 97%

表3 3种淫羊藿叶片内生细菌多样性指数分析
2.5.2 β多样性分析 使用QIIME软件进行β多样性分析,比较了3种淫羊藿老叶和新叶内生细菌群落物种多样性相似度。主坐标PCoA分析(图7a)和非度量多维标定法(NMDS)分析(图7b)结果表明,CO样品在坐标图上的距离最远,均分布于同一象限内,其他样品分布于其他坐标轴内,未完全分开,说明这些样品相似性较高,细菌群落结构较为相似。

图7 3种淫羊藿叶片内生细菌的PCoA分析(a)和NMDS分析(b)Fig.7 PCoA analysis (a) and NMDS analysis (b) of endophytic bacteria in leaves of Epimedium
用非加权配对平均法(UPGMA)对样品进行属水平聚类,判断3种淫羊藿叶片内生细菌群落组成相似性。样品属水平的聚类树如图8。总体分为两类,AO、AY、BO、BY和CY样品聚为一类,CO样品单独聚为另一类,说明巫山淫羊藿在老叶时期的内生细菌群落组成与其他两种淫羊藿差异较大。
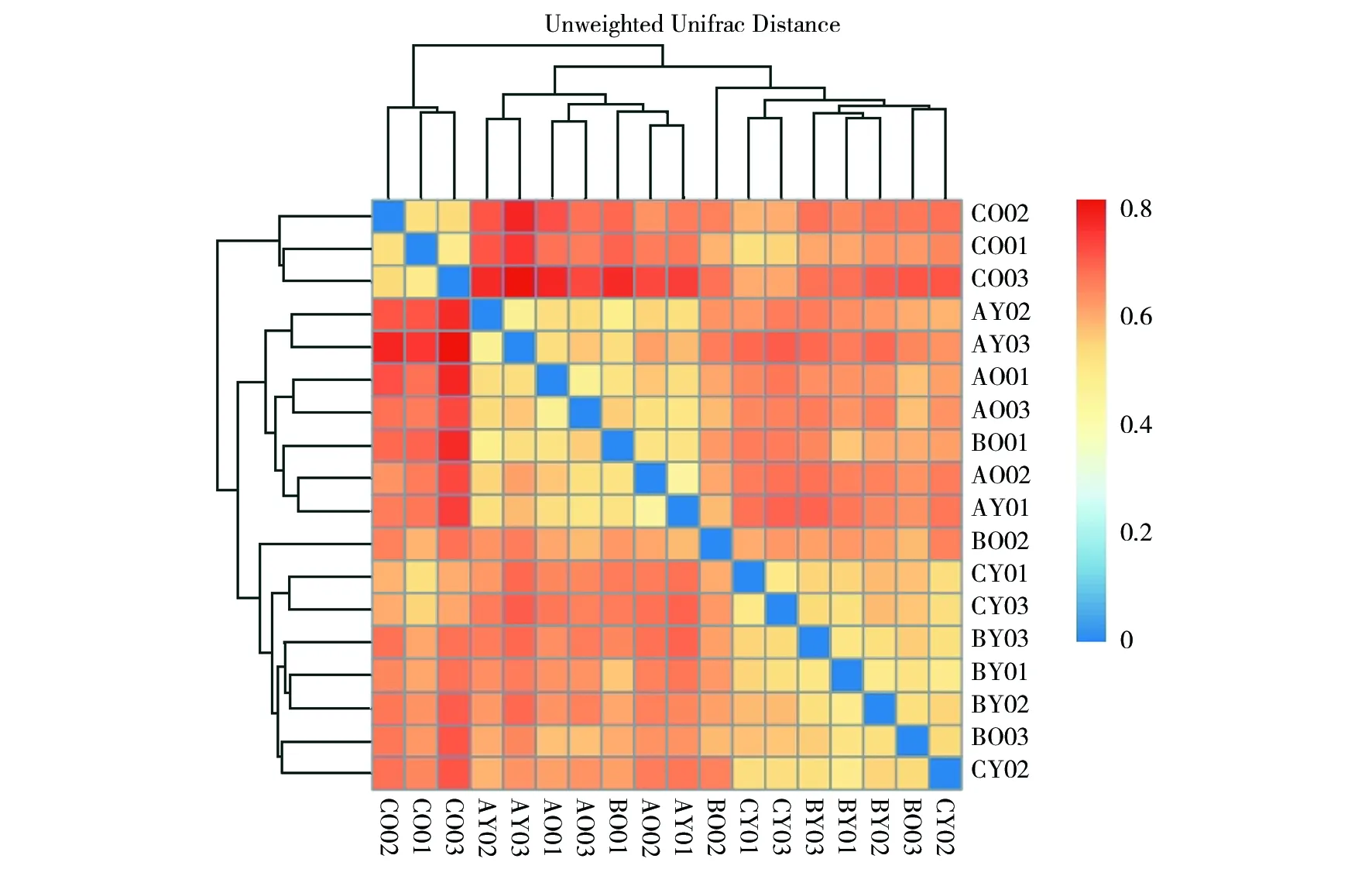
图8 淫羊藿叶片内生细菌属水平的UPGMA聚类分析Fig.8 UPGMA cluster analysis of endophytic bacteria in leaves of Epimedium
3 讨 论
内生菌对药用植物的生长发育、药材道地性、药效物质的形成和积累等都具有重要影响[30-31],因此,深入研究药用植物内生菌的种群结构以及生物学功能具有重要意义。本研究采用高通量测序技术,首次分析了粗毛淫羊藿、箭叶淫羊藿及巫山淫羊藿3种淫羊藿叶片内生细菌群落结构和组成。群落组成结果显示,3种淫羊藿叶片内生优势菌群主要包括变形菌门、厚壁菌门和放线菌门,优势菌属主要有甲基杆菌属、鞘氨醇单孢菌属、放线孢菌属、Kroppenstedtia属、泛菌属及乳杆菌属等。前人研究表明,变形菌、放线菌及鞘氨醇单孢菌属等细菌有助于药用植物产量及有效物质含量的提高,在促生长、防病害等方面发挥着重要作用[32],因此,淫羊藿中丰富的内生细菌可为功能菌株的挖掘奠定良好的前期基础。植物内生细菌是一类定殖在植物内部的细菌,其种类组成和结构变化会受到植物种类、生长状况和外界环境的影响[33]。刘元等[34]比较分析了怀山药和菜山药根茎内生细菌谱的差异,发现怀山药内生菌多样性要大于菜山药,且菌落组成比菜山药均匀。孙占斌等[35]研究发现,黄瓜初花期内生菌含量是结瓜期的5倍,两时期内生菌的种类表现出很强的差异。在本研究中各样品的优势菌属(相对丰度>5%)存在一定差异,如在粗毛淫羊藿样品中甲基杆菌属、鞘氨醇单孢菌属相对丰度较其余样品高(相对丰度不足2%),而Kroppenstedtia属在箭叶淫羊藿样品中的相对丰度较高,乳杆菌属、魏斯式菌属、马赛菌属和泛菌属的相对丰度则在巫山淫羊藿样品中的相对丰度较高;同时,3种淫羊藿新叶和老叶内生细菌群落组成也存在差异,甲基杆菌属、鞘氨醇单孢菌属、Kroppenstedtia属和马赛菌属在老叶中的相对丰度较高,而乳杆菌属、魏斯式菌属和泛菌属在新叶中相对丰度较高,这些结果与前人研究相吻合。
内生菌与宿主在长期协同进化的过程中形成了互惠共生的关系,宿主可以为内生菌的生长提供营养物质,而内生菌则通过合成次生代谢产物帮助宿主抵御不良环境,促进作物生长[36]。本研究对3种淫羊藿叶片优势内生菌的功能进行分析,发现这些微生物能够促进土壤有机物分解,合成多种次级代谢产物,诱导作物对病原微生物的抗性等,如鞘氨醇单孢菌属可以促进有机物的分解,合成某些有机化合物,抑制病原菌生长;马赛菌属能够合成多种次级代谢产物和酶,而且具有溶磷、降解菲和耐受重金属等多种功能;根瘤菌属在土壤中具有较强的固氮能力,促进植物对氮源的吸收和利用,说明3种淫羊藿叶片中有丰富的益生菌,这些内生菌可能参与代谢叶片内的各种营养物质,为植株的生长发育提供必要的营养和激素等。
本研究首次采用高通量测序技术分析,明确了3种淫羊藿叶片内生细菌的群落多样性及其组成,为今后淫羊藿内生细菌的分离、功能菌株的挖掘及病虫害防控提供了参考。但是,本研究仅对同一产地、单一部位的内生细菌群落组成进行了分析,缺少野生种源、不同产地及不同组织内生菌的比较分析,同时缺少对其内生真菌多样性的分析,有待今后进一步研究。

