胃镜下胃食管阀瓣分级与基于里昂共识的胃食管反流病证据等级及反流新参数的相关性
郭子皓,武彦红,冯 跃,陈 婧,郭宝娜,李 莉,姜佳丽,王天佑,展玉涛,张 川
首都医科大学附属北京同仁医院消化内科,北京 100730
胃食管反流病(gastroesophageal reflux disease,GERD)是常见的消化系统疾病。为提高GERD的诊断及治疗水平,在《胃食管反流病波尔图共识》的基础上,结合近年GERD诊疗的研究进展,2018年在《Gut》杂志发布了《胃食管反流病里昂共识》(以下简称“里昂共识”)[1-2]。在里昂共识中,根据胃镜、食管pH/pH-阻抗监测及食管高分辨测压(high-resolution manometry,HRM)等结果,将GERD的证据分为病理性反流的确定性证据、支持性证据、辅助性证据及排除性证据,同时纳入了平均夜间基线阻抗(mean nocturnal baseline impedance,MNBI)、反流后吞咽诱发的蠕动波指数(post-reflux swallow-induced peristaltic wave index,PSPWI)等新参数[2]。
GERD的主要原因之一是抗反流屏障功能障碍,而食管胃交界处(esophagogastric junction,EGJ)的结构和功能在抗反流屏障的构建中起关键性作用[3]。胃食管阀瓣(gastroesophageal flap valve,GEFV)是EGJ的重要组成部分,为位于胃底侧的阀瓣样肌性黏膜皱襞,在胃镜下倒镜观察时可对其进行分级。既往研究表明,GEFV分级与酸反流及HRM中的EGJ形态呈正相关[4]。然而目前对GEFV分级与基于里昂共识的GERD证据等级、反流新参数MNBI和PSPWI相关性的研究较少,本文拟对此进行研究。
1 资料与方法
1.1 研究对象纳入2015年8月至2020年6月就诊于首都医科大学附属北京同仁医院消化内科,有胃食管反流症状(反酸和/或烧心),并行胃镜、HRM和24 h食管pH-阻抗监测的成年患者。排除标准:(1)食管、胃及胸腔手术史;(2)合并消化道肿瘤、食管胃静脉曲张、消化性溃疡等消化系统疾病,或为感染性食管炎、嗜酸性食管炎;(3)原发性或继发性严重食管运动障碍(如贲门失弛缓症、硬皮病等);(4)孕妇、严重心肺疾病、凝血功能异常等不能耐受检查。该研究得到北京同仁医院医学伦理委员会的批准(批号:trxhzcfa01)。
1.2 方法
1.2.1 胃镜:所有患者均进行胃镜检查。反流性食管炎严重程度采用洛杉矶分级标准[5]。GEFV根据Hill分级分为Ⅰ~Ⅳ分级,Ⅰ级:倒镜见明显的黏膜皱襞包裹镜身;Ⅱ级:组织皱襞包裹镜身,但可随呼吸运动开放和关闭;Ⅲ级:组织皱襞不明显,无法包裹镜身;Ⅳ级:存在食管裂孔疝,黏膜皱襞无法包裹镜身,从下方可以看见食管鳞状上皮[6]。
1.2.2 24 h食管pH-阻抗监测:所有患者检查前提前至少1周停服促动力药、质子泵抑制剂、H2受体阻滞剂等药物。通过HRM确定食管下括约肌位置,将pH-阻抗监测导管由鼻腔插入固定至食管下括约肌上缘5 cm位置,采用Ohmega阻抗-pH监测仪(荷兰MMS公司)进行检查,嘱患者保持日常生活习惯并记录患者日记,24 h后拔除监测导管并分析记录的数据。记录:(1)总反流次数,直立、仰卧以及pH<4酸暴露时间(acid exposure time,AET)百分比[AET4(%)]。(2)症状指数(symptom index,SI)和症状相关概率(symptom association probability,SAP)。SI≥50%和/或SAP≥95%,则认为症状与胃食管反流有关。(3)MNBI:在夜间卧位期间(1am、2am、3am)分别选取10 min阻抗平稳的部分(注意避开吞咽或反流事件),测量远端4个通道阻抗并取平均值,并取3个时段的平均值。(4)PSPWI:反流后吞咽诱发的蠕动波定义为反流时间发生后30 s内继发的蠕动波,表现为从近端到远端阻抗依次降低大于50%,然后至少50%返回基线。PSPWI是通过将反流后吞咽诱发蠕动波(post-reflux swallow-induced peristaltic wave, PSPW)的数量除以总反流事件的数量来手动计算获得的。所有数据最初均由软件识别,然后由两位作者(郭子皓和武彦红)进行验证和计算[1]。
1.2.3 分组:依据里昂共识将有胃食管反流症状的患者分为4组:(1)确定性GERD证据组:胃镜下LA-C级或D级的糜烂性食管炎,或长段Barrett黏膜或合并食管狭窄,或AET4(%)>6%;(2)支持性GERD证据组:胃镜下LA-A级或LA-B级的糜烂性食管炎,或AET4(%)为4%~6%,或反流次数为40~80次/24 h;(3)排除性GERD证据组:无糜烂性食管炎,AET4(%)<4%且反流次数<40次/24 h;(4)辅助性GERD证据组:未包括在以上各组,具有以下表现者:反流症状关联阳性或反流次数>80次/24 h,或MNBI降低,或PSPWI降低,或合并食管裂孔疝,或合并食管动力不足[2]。
GEFV正常组包括GEFV Ⅰ级及Ⅱ级,GEFV异常组包括GEFV Ⅲ级及Ⅳ级[6]。
2 结果
2.1 一般资料最终纳入符合标准的421例有典型胃食管反流症状的患者进行回顾性分析。其中确定性GERD证据组123例,支持性GERD证据组158例,辅助性GERD证据组84例,排除性GERD证据组56例。四组患者的年龄组间比较,差异无统计学意义(P>0.05),确定性GERD证据组的男性比例和体质量指数(body mass index,BMI)最高(P<0.05)(见表1)。
2.2 基于里昂共识分组中患者GEFV分型的比较GEFV异常组占所有患者的29.5%,在确定性GERD证据组比例最高(49.6%),在排除性GERD证据组比例最低(3.6%)(见表1)。
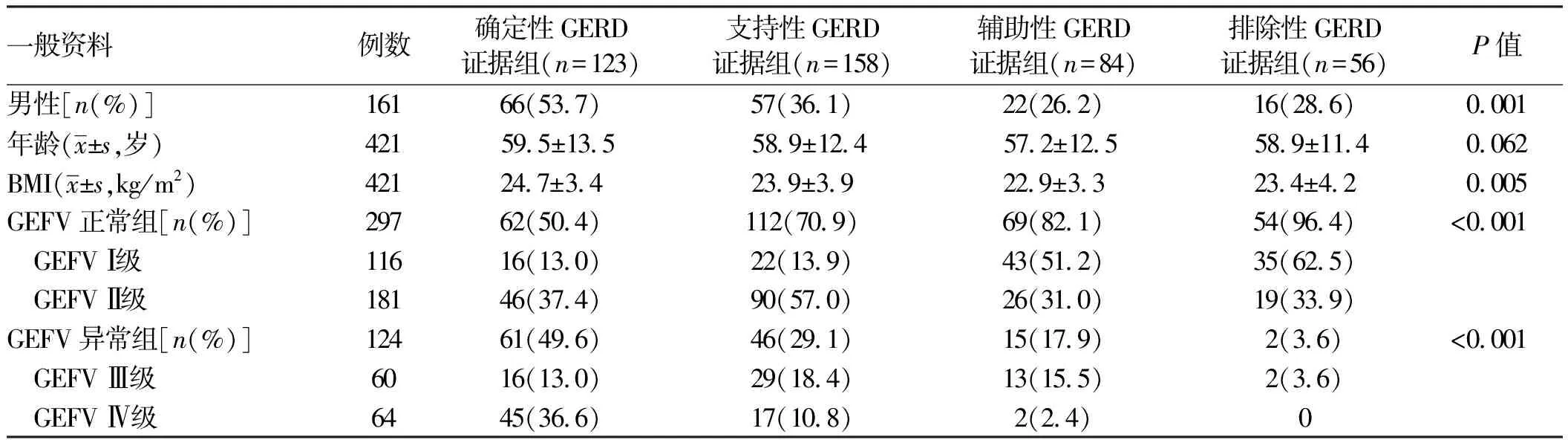
表1 421例有典型胃食管反流症状患者基于里昂共识分组的一般资料Tab 1 Demographic and clinical characteristics of 421 patients with typical gastroesophageal reflux symptoms according to Lyon Consensus
2.3 不同GEFV分级患者的一般资料、胃镜和24 h食管pH-阻抗监测结果比较不同GEFV分级间年龄、BMI比较,差异无统计学意义(P>0.05)。如表2所示,随着GEFV分级逐渐升高(Ⅰ~Ⅳ级),男性比例、糜烂性食管炎比例、AET4(%)、DeMeester评分和总反流次数逐渐增多(P<0.05),而MNBI和PSPWI逐渐降低(P<0.05)。GEFV正常组与GEFV异常组相比,年龄及BMI比较,差异无统计学意义(P>0.05),男性比例、糜烂性食管炎比例、AET4(%)、总反流次数明显减少(P<0.05),MNBI和PSPWI明显升高(P<0.05)。
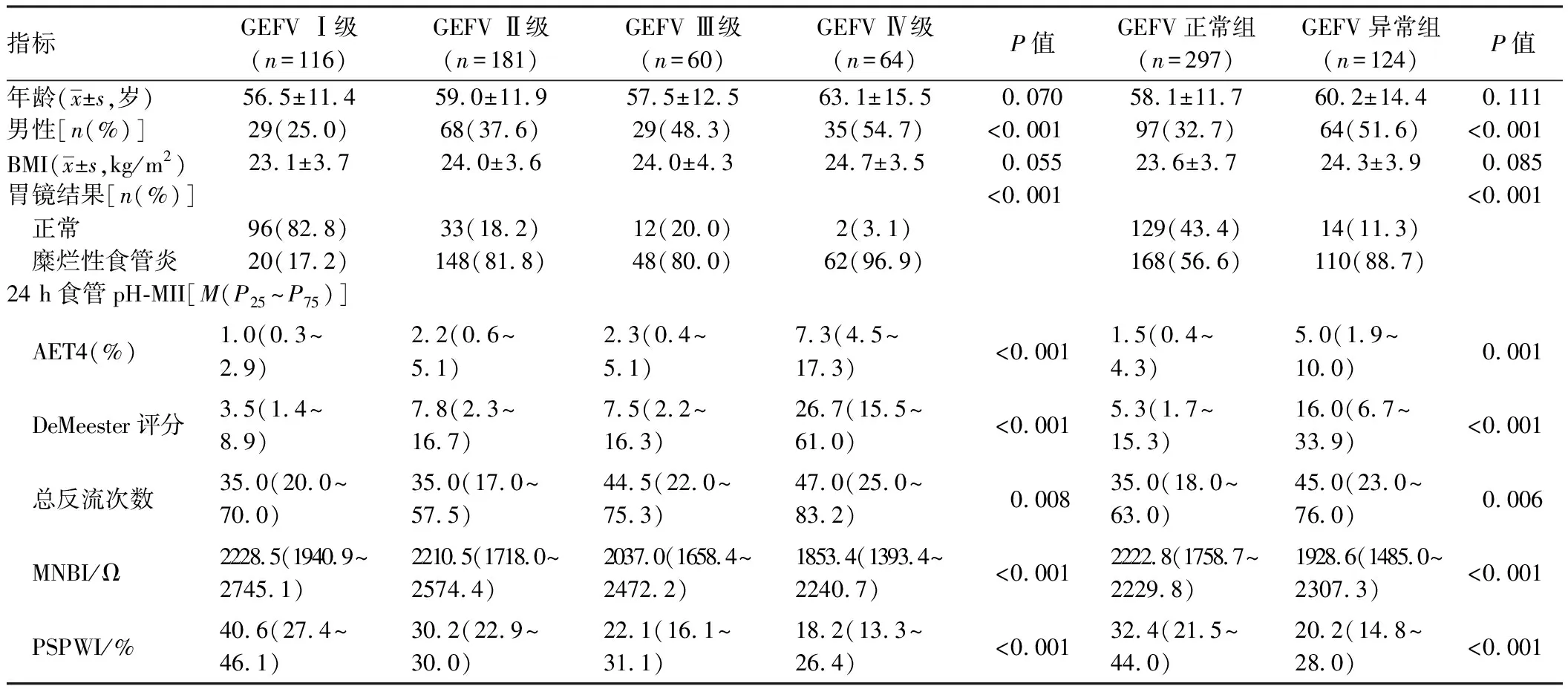
表2 不同GEFV分级的421例有典型胃食管反流症状患者的一般情况及24 h食管pH-阻抗监测参数比较Tab 2 Demographic and 24 h pH-MII data of 421 patients with typical gastroesophageal reflux symptoms according to GEFV grades
2.4 GEFV分级与一般资料、24 h食管pH-阻抗监测参数的相关性研究Spearman相关分析的结果显示,MNBI(r=-0.224,P<0.001)和PSPWI(r=-0.132,P=0.007)与GEFV分级呈显著负相关。男性(r=0.210,P<0.001)、BMI(r=0.120,P=0.014)、AET4(%)(r=0.357,P<0.001)、DeMeester评分(r=0.370,P<0.001)和总反流次数(r=0.357,P<0.001)与GEFV分级呈显著正相关。
3 讨论
GERD是一种有高度异质性的消化内科常见病,临床表现多样,可表现为反酸、烧心等典型的食管内症状,也可表现为慢性咳嗽、咽部不适、声嘶等食管外症状,同时发病机制复杂,对质子泵抑制剂的治疗反应也存在明显的异质性。因此,GERD的诊断及分型需要结合症状、质子泵抑制剂经验性治疗反应、胃镜、食管pH/pH-阻抗监测、HRM等多项手段。在2002年波尔图共识的基础上,结合近年发表的关于食管反流监测及HRM新进展,2018年发布了里昂共识,着重更新了GERD的诊断方法及诊断标准[1-2]。该共识中指出,病史、反流相关问卷和对质子泵抑制剂经验性治疗反应虽然对GERD具有一定的提示意义,但不足以确诊GERD。该共识将GERD的诊断分为了4组证据等级,更加规范化及个体化,对病理性反流的确定性证据定义严格,仅将重度食管炎(LA-C级或LA-D级)或长节段的Barrett食管或食管狭窄,或反流监测提示AET4(%)>6%的患者定义为具有病理性反流的确定性证据,可积极进行GERD相关的药物、内镜及手术治疗。同时增加了GERD的排除性证据,当AET4(%)<4%及反流次数<40次/24 h时,可排除GERD的诊断。处于两者之间的为GERD的支持性及辅助性证据,辅助性证据越多,越倾向于GERD的诊断[2,7]。
GEFV是抗反流屏障重要构成部分,评估方法简易,且不同内镜医师间对其分级的评估一致性高[6]。Lin等[8]研究显示,在有GERD症状的患者中,异常GEFV占27.3%,而反流性食管炎患者中占42.7%。Quach等[9]研究表明,异常GEFV在非糜烂性GERD患者中占43.6%,在内镜下LA-A级患者中占56.8%,在内镜下LA-B/C级患者中占80.0%。Osman等[10]纳入11项研究进行荟萃分析,结果显示,GEFV异常(GEFV Ⅲ~Ⅳ级)组比GEFV正常组具有更高的有胃食管反流症状的风险(相对危险度=1.88,95%CI:1.57~2.24),同时有胃食管反流症状的人群中,GEFV异常组具有更高的糜烂性食管炎风险(相对危险度=2.17,95%CI:1.40~3.36)。此外,还有研究显示,GEFV异常是对质子泵抑制剂反应欠佳的独立因素[11]。然而,GEFV分级与基于里昂共识的GERD证据等级关系的研究尚少。本研究显示,异常GEFV占所有具有胃食管反流症状患者的29.5%,在确定性GERD证据组比例最高(49.6%),在排除性GERD证据组比例最低(3.6%)。鉴于异常GEFV在排除性GERD证据组比例低,具有典型胃食管反流症状但无明显糜烂性食管炎的患者,如果在胃镜检查中发现GEFV异常,则可能提示GERD的诊断,有助于在不具备进行食管pH-阻抗监测条件的机构中辅助GERD的诊断。
本研究结果显示,男性、BMI与GEFV分级显著正相关。人口学资料与GEFV的关系存在争议,有研究表明,性别、年龄、BMI、吸烟、饮酒与GEFV分级不相关[12]。也有研究表明,高龄、男性和较高的BMI是异常GEFV的重要危险因素[13-14]。年龄增长可能导致膈肌、韧带等松弛,男性和BMI升高是肥胖的危险因素,可能引起腹压升高,进而继发GEFV异常。本研究与前人研究结果一致,提示AET4(%)、DeMeester评分和总反流次数与GEFV分级显著正相关[4,14-15]。Kim等[15]发现GEFV异常组的糜烂性食管炎发生率及反流负荷均明显高于GEFV正常组。Xie等[4]的研究也提示,GEFV异常和反流密切相关,同时GEFV Ⅳ级的患者中HRM中EGJ分型为Ⅲ型的比例明显增加,提示GEFV有助于预测EGJ分型,为抗反流屏障的重要组成部分。
在里昂共识中明确了食管pH-阻抗监测新参数MNBI和PSPWI在GERD诊断中应用。MNBI反映了食管黏膜的完整性,与反流及黏膜损伤所致的细胞间紧密连接和间隙的改变相关。由于频繁的吞咽和反流会影响阻抗基线的测量,因而MNBI的测量需在夜间睡眠时进行。有研究表明,MNBI从正常对照和功能性烧心、食管高敏感、非糜烂性GERD到糜烂性食管炎逐渐降低[16-18]。健康人发生反流事件后,可以诱发食管蠕动,吞咽唾液来中和酸化的食管黏膜,表现为反流事件后30 s内自近端至远端阻抗值的降低,称为PSPW。PSPWI为PSPW占总反流事件数量的百分比,反映了食管经反流事件刺激后出现继发蠕动的概率,与食管收缩储备能力有相关性,可用于评估食管的廓清能力,GERD患者的PSPWI低于功能性烧心患者及健康对照[19]。目前GEFV与MNBI、PSPWI关系的研究尚少,本研究提示GEFV异常组的MNBI和PSPWI均低于GEFV正常组,并且MNBI和PSPW指数与GEFV等级呈负相关。其原因可能是GEFV异常反映了抗反流屏障受损,继发更重的反流负担,从而导致食管黏膜损伤及食管收缩储备收缩,导致更低的MNBI和PSPWI。
综上所述,基于里昂共识的确定性GERD证据的患者中GEFV异常比例明显增加,GEFV异常提示糜烂性食管炎发生率升高、更重的反流负荷、MNBI及PSPWI降低。基于胃镜下评估GEFV分级的简便性,我们建议将其常规纳入有GERD症状或可疑GERD的患者的胃镜检查报告中。

