虫草花多糖抑制CCl4诱导的小鼠肝纤维化的作用与机制
刘广庆,王丹丹,余茂耘,段亚君,杨潇潇
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230601; 2.安徽省教育厅重大疾病代谢及营养调控重点实验室,安徽 合肥 230601; 3.皖西学院 生物与制药工程学院,安徽 六安 237012)
肝纤维化(liver fibrosis)是由病毒性肝炎、胆汁淤积、非酒精性脂肪肝炎等慢性肝脏疾病过程中细胞外基质(extracellular matrix,ECM)的过度积累导致的,晚期的肝纤维化会导致肝硬化、肝衰竭、门静脉高压等疾病[1]。肝纤维化病理机制复杂,针对单一靶点研发的药物在临床上很难发挥作用,目前尚无疗效明确的化学药物或生物药物可供临床应用[2]。中药能通过多靶点治疗肝纤维化,因此近年来已成为防治肝纤维化研究的热点[3]。
核因子κB(nuclear factor kappa-B,NF-κB)是细胞中应对损伤和感染的免疫和炎症反应的主要调节因子。研究表明,NF-κB的激活与肝纤维化相关[4]。促进NF-κB活化的因素有很多,包括肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素1(interleukin 1,IL-1)、损伤DNA的化学物质及辐射等[5]。NF-κB被活化后异位至细胞核内,诱导包含TNF-α在内的炎症因子、趋化因子和细胞粘附因子基因的表达[6-7],因此,TNF-α与NF-κB之间的相互促进关系形成恶性循环,加重炎症反应,进而加重肝纤维化。
过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)的激活能够抑制相关促炎因子的表达,从而抑制炎症[8-9],起到改善肝纤维化的作用。此外,活化的肝星状细胞(hepatic stellate cells,HSCs)是分泌基质蛋白的成纤维细胞的主要来源,是肝纤维化的主要驱动力[10-11]。研究表明,激活PPARγ能够抑制HSCs的活化,从而改善肝纤维化[11-12]。
B细胞淋巴瘤-2(B-cell lymphoma-2,BCL-2)蛋白家族广泛分布于从酵母到哺乳动物等生物体内,根据其在细胞凋亡调控中起的作用不同,BCL-2蛋白家族成员分为抗凋亡蛋白(包括BCL-2、BCL-xL、A1、MCL-1等)和促凋亡蛋白(包括BAX、BAD、BIK、BID等)[13]。2类蛋白的相互作用决定细胞的存活或凋亡。BCL-2/BAX信号通路通过调控细胞凋亡在纤维化进程中起着重要的作用。
蛹虫草(Cordycepsmilitaris(Lex.Fr) Link)又称北虫草、北冬虫夏草,与冬虫夏草不同,蛹虫草以蚕蛹为寄主寄生培养,而单纯以人工培养基培养的蛹虫草称为虫草花[14]。与蛹虫草与冬虫夏草相比,虫草花价格低廉,且多糖含量更高[14-15]。研究表明,蛹虫草多糖具有增强免疫力[16]、抗氧化[16]、降血糖[17]、抗病毒[18]等生物活性,而关于虫草花多糖的报道较少。本文以CCl4诱导小鼠发生肝纤维化为模型,同时给予虫草花多糖喂食,以探究虫草花多糖对肝纤维化的作用及机制。
1 实验材料
1.1 实验动物
6~8周龄SPF级雄性C57BL/6J小鼠24只,购于安徽医科大学实验动物中心,许可证号为scxk(皖)2017-001。
1.2 主要药物与试剂
虫草花干货(云南易门益生绿色食品公司);COL1A2、α-SMA、TGF-β1、BCL-2、BAX、HSP90、TNF-α、PPARγ单克隆抗体(Proteintech),货号依次为14695-1-AP、55135-1-AP、21898-1-AP、26593-1-AP、50599-2-Ig、13171-1-AP、60291-1-AP、16643-1-AP;NF-κB单克隆抗体(Abclonal),货号为A16271;CCl4(沪试),AR,货号为10006480;丙氨酸氨基转移酶(ALT)检测试剂盒(美康生物),货号为H001;天门冬氨酸氨基转移酶(AST)检测试剂盒(美康生物),货号为H002;天狼星红染液(Solarbio),货号为G1471。
2 实验方法
2.1 虫草花多糖的制备
将虫草花干货粉碎,过8目筛,得虫草花粉末。按照虫草花粉末100 g、蒸馏水2 L的料液比,85 ℃水浴浸提2 h,重复操作1次。合并2次滤液,60 ℃旋转蒸发至200 mL,加入800 mL无水乙醇,4 ℃醇沉过夜。去除上清液,沉淀溶于500 mL蒸馏水,旋转蒸发至100 mL,Sevag法(V(正丁醇)∶V(三氯甲烷)=4∶1)除蛋白,重复操作至有机相、水相间无白色蛋白沉淀为止。取上清液,加入500 mL 蒸馏水,旋转蒸发至100 mL,将有机试剂完全去除。所得溶液转入透析袋(截留分子量为3.5 kDa)中,自来水透析48 h,蒸馏水透析24 h,所得溶液旋转蒸发至100 mL,冷冻干燥得虫草花多糖粉末,在4 ℃下保存待用。采用苯酚硫酸法测定多糖的质量分数为95.61%。
2.2 小鼠分组及给药处理
小鼠随机分为对照组、模型组、虫草花多糖组,每组8只。虫草花多糖组小鼠按400 mg/kg剂量,每天灌胃虫草花多糖水溶液200 μL,对照组、模型组小鼠每天灌胃同等体积蒸馏水;模型组小鼠参照文献[19]的方法,自虫草花多糖灌胃的第3天起,按1 mL/kg的剂量,腹腔注射CCl4溶液(V(CCl4)∶V(橄榄油)=1∶3),每周2次,持续注射4周;对照组小鼠腹腔注射同等体积橄榄油。小鼠最后一次注射CCl4后48 h处死所有小鼠,收集小鼠血清及肝脏样本。
2.3 肝组织病理学检验
取小鼠肝脏左外叶的1/2固定于4%多聚甲醛中,4 ℃固定24 h,经脱水机脱水、石蜡包埋后切成厚度5 μm的切片,切片按照常规步骤进行苏木素伊红(H&E)染色和天狼星红染色。使用ImageJ软件统计天狼星红染色胶原纤维阳性面积。
2.4 血清生化指标测定
使用全自动生化分析仪测定小鼠血清中ALT、AST含量。
2.5 蛋白免疫印迹(Western Blot)实验
取30 mg小鼠肝脏组织于500 μL lysis buffer中,组织匀浆机匀浆,BCA法测定蛋白浓度,按蛋白定量60 μg每孔上样,SDS-聚丙烯酰胺凝胶电泳,湿法转膜,5%脱脂奶粉室温封闭1 h,参照说明书按比例稀释一抗,4 ℃摇床孵育过夜,TBST洗膜3次,每次8 min。室温摇床孵育二抗1 h,TBST洗膜3次,每次8 min。滴加ECL显影液,化学发光成像仪显影。使用Photoshop软件计算灰度值,以HSP90作为内参蛋白,以目的蛋白的灰度值与相应内参蛋白的灰度值的比值作为该蛋白的相对表达量。
2.6 统计学方法
3 结果与分析
3.1 虫草花多糖对小鼠体质量的影响
肝纤维化会使小鼠体质量减轻[20],各组小鼠体质量变化见表1所列。
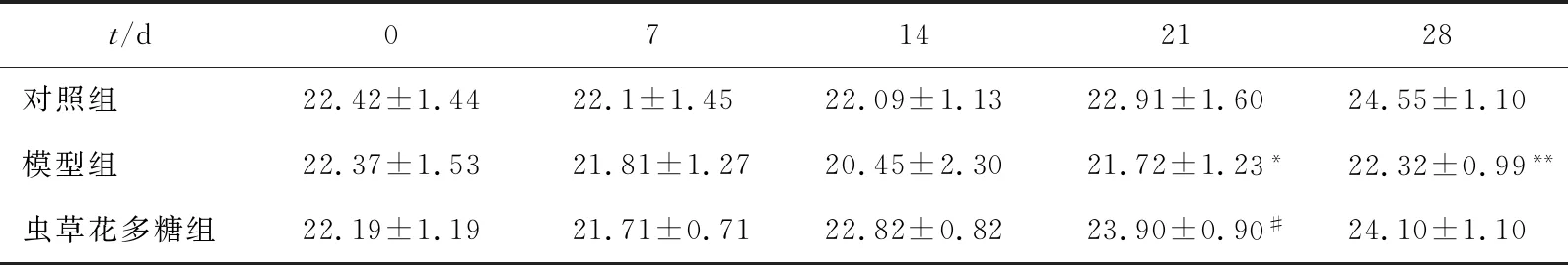
表1 各组小鼠各时间点体质量 单位:g
由表1可知,实验前14 d,各组小鼠体质量无显著性差异。实验第21天,模型组小鼠体质量显著(P<0.05)低于对照组小鼠,虫草花多糖组小鼠体质量显著(P<0.05)高于模型组小鼠;实验结束时,模型组小鼠体质量比对照组显著(P<0.01)下降,虫草花多糖组小鼠体质量比模型组显著(P<0.01)上升。上述结果表明虫草花多糖能够改善CCl4引起的毒性作用。
3.2 虫草花多糖对小鼠肝损伤的影响
为确定虫草花多糖能否直接改善CCl4引起的肝损伤,本实验对小鼠血清肝功能指标AST、ALT水平进行检测,对肝脏组织切片进行H&E染色。
肝功能生化指标是判断肝损伤程度的重要依据[21],检查结果如图1所示,由图1可知,模型组小鼠血清AST、ALT水平显著高于对照组(P<0.05、P<0.01),虫草花多糖组小鼠血清AST、ALT水平显著低于模型组(P<0.05)。更进一步,通过肝组织切片H&E染色观察小鼠肝损伤情况,结果如图2所示。
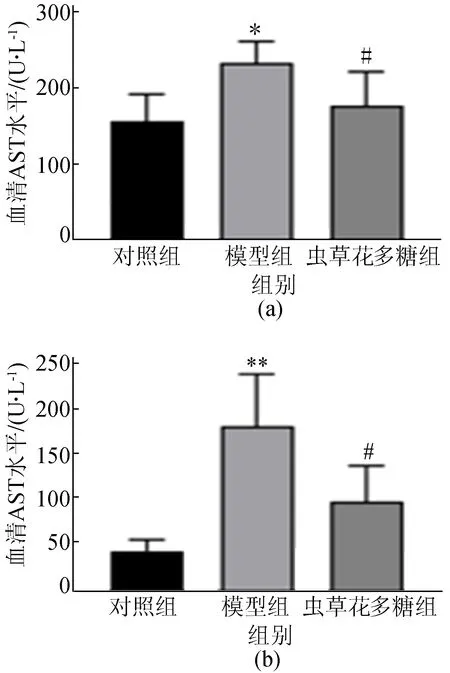
图1 各组小鼠AST和ALT水平
从图2可以看出,对照组小鼠肝脏呈正常小叶结构,未见肝细胞坏死;模型组小鼠肝脏可见肝细胞水肿、坏死,细胞排列紊乱,炎性细胞浸润,胶原纤维堆积形成假小叶;虫草花多糖组小鼠肝脏细胞轻度水肿,无明显坏死,未见假小叶结构形成。上述结果表明,CCl4诱导小鼠发生较严重的肝损伤,经虫草花多糖喂食后,小鼠肝损伤程度显著降低。

图2 各组小鼠肝脏H&E染色结果
3.3 虫草花多糖对小鼠肝纤维化水平的影响
通过天狼星红染色检测肝脏纤维化水平,结果如图3所示。
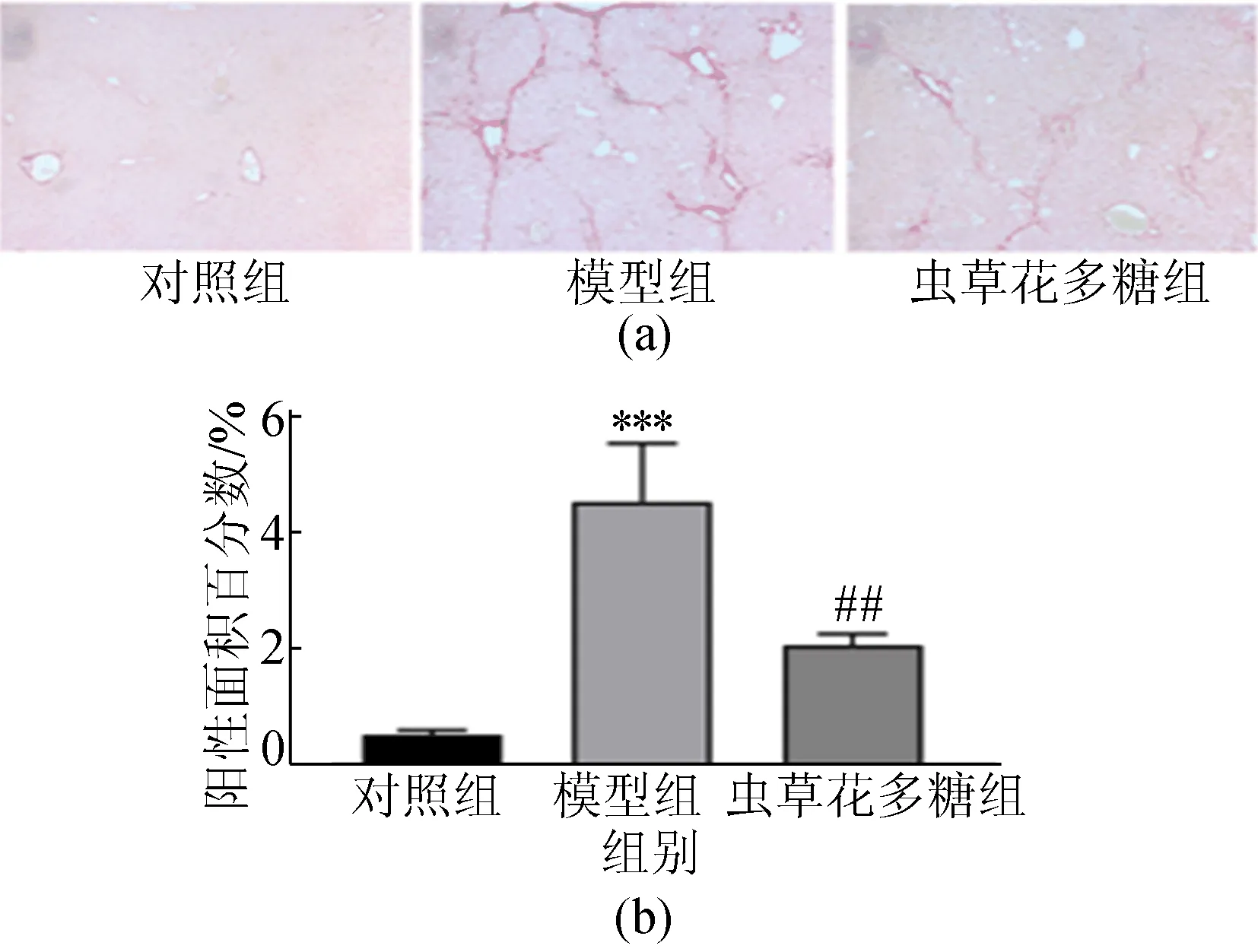
图3 各组小鼠肝脏天狼星红染色图及阳性面积百分数
从图3可以看出,对照组小鼠仅在血管壁观察到胶原纤维,模型组小鼠肝小叶被胶原纤维包裹,小叶的正常结构被破坏,而虫草花多糖组胶原纤维沉积较模型组明显减少。统计天狼星红胶原纤维染色阳性面积,模型组小鼠天狼星红阳性面积显著(P<0.001)高于对照组小鼠,虫草花多糖组小鼠肝脏天狼星红阳性面积显著(P<0.01)低于模型组小鼠。
Ⅰ型胶原蛋白 (collagentype Ⅰ,collagen-1)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是肝成纤维化标志物[22],通过Western Blot实验检测相关蛋白的表达情况,结果如图4所示,从图4可以看出,模型组小鼠肝脏COL1A2(编码collagen-1 α2链)、TGF-β1、α-SMA蛋白表达量显著(P<0.001)高于对照组,虫草花多糖组小鼠肝脏COL1A2、TGF-β1、α-SMA蛋白表达量显著(P<0.05、P<0.01、P<0.01)低于模型组。天狼星红染色结果与Western Blot结果均表明,虫草花多糖喂食降低了小鼠肝纤维化水平。
3.4 虫草花多糖对肝纤维化中炎症反应的影响
上述结果表明虫草花多糖能够抑制CCl4导致的小鼠肝损伤,改善小鼠肝纤维化,本文对相关机制进行了探究。NF-κB与TNF-α相互刺激,共同促进炎症反应[5-7],从而加重肝纤维化进程。通过Western Blot实验,检测各组小鼠肝脏TNF-α、NF-κB表达水平,结果如图5所示,由图5可知,模型组小鼠肝脏TNF-α、NF-κB蛋白表达水平显著(P<0.01、P<0.001)高于对照组小鼠,表明小鼠发生了较为严重的炎症反应;而虫草花多糖组小鼠肝脏TNF-α、NF-κB显著(P<0.05、P<0.01)低于模型组小鼠,表明虫草花多糖能够抑制肝纤维化进程中的炎症反应从而改善肝纤维化。
另一方面,PPARγ能够抑制炎症反应[23-24],本文通过Western Blot实验检测小鼠肝脏PPARγ蛋白表达水平,结果如图6所示,从图6可以看出,虫草花多糖组小鼠肝脏PPARγ蛋白水平显著(P<0.01)高于模型组小鼠,表明虫草花多糖通过促进PPARγ的表达,抑制肝纤维化模型小鼠肝脏的炎症反应,进而改善肝纤维化。
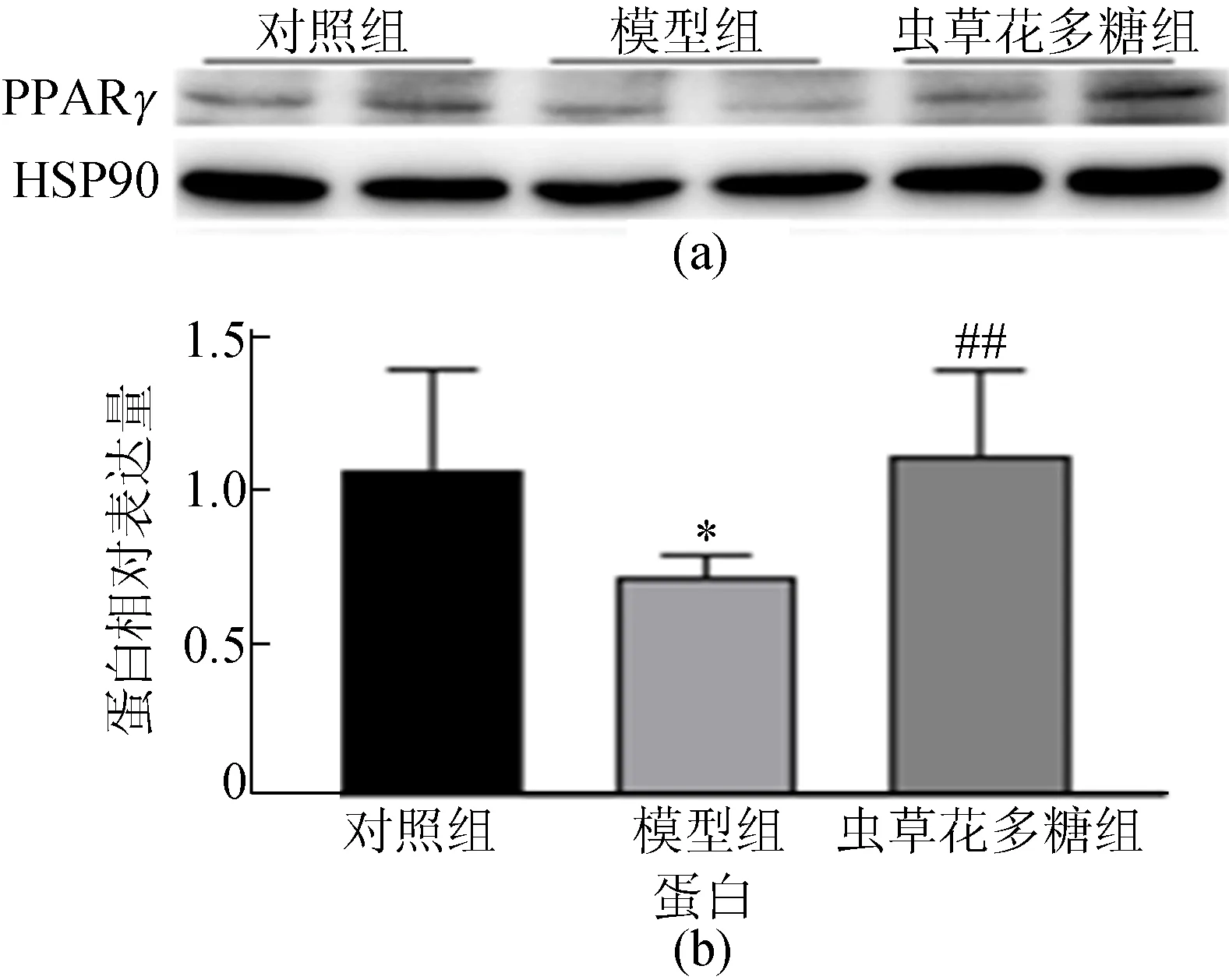
图6 各组小鼠肝脏PPARγ蛋白相对表达量
3.5 虫草花多糖对肝纤维化中细胞凋亡的影响
研究表明,CCl4能够引起强烈的肝毒性,促进小鼠肝脏BCL-2蛋白表达下调,BAX蛋白表达上调,从而导致肝细胞凋亡,促进肝纤维化进程[25-26]。通过Western Blot实验检测BCL-2、BAX蛋白表达水平,结果如图7所示,从图7可以看出,模型组小鼠肝脏BCL-2蛋白表达水平显著(P<0.001)下调,BAX蛋白表达水平显著(P<0.01)上调;虫草花多糖组小鼠肝脏BCL2蛋白表达水平相较模型组显著(P<0.01)上调,BAX蛋白表达水平相较模型组显著(P<0.01)下调。上述结果表明虫草花多糖抑制CCl4诱导的肝细胞凋亡,从而改善肝纤维化。

图7 各组小鼠肝脏BCL-2和BAX蛋白相对表达量
4 讨 论
肝纤维化是肝脏对慢性肝病的病理性修复反应,表现在细胞外基质的过度增生与沉积,是各种慢性肝病向肝硬化发展的重要步骤[27]。研究表明,肝纤维化是一个可逆过程[28-29],但目前尚无疗效确切的化学药物或生物药物用以治疗肝纤维化[30],因此寻找治疗肝纤维化的新方法、新策略就显得尤为重要。由于天然药物能通过多靶点治疗肝纤维化,因此成为近年来的研究热点。
本研究结果表明,虫草花多糖喂食能够显著改善肝纤维化模型小鼠的体质量、血清肝功能生化指标。组织病理学结果显示,虫草花多糖治疗能够显著改善肝纤维化导致的肝脏病理损伤、胶原纤维的过度积累,从而起到治疗肝纤维化的作用。
炎症是促进肝纤维化进程的重要因素[31]。文献研究发现,枸杞多糖能够通过NF-κB信号通路减轻炎症反应,抑制大鼠肝纤维化[32];狗肝菜多糖同样能够通过减轻炎症反应,抑制大鼠肝纤维化[33]。本实验研究发现,虫草花多糖能够显著地下调肝纤维化模型小鼠肝脏TNF-α、NF-κB蛋白表达水平,表明虫草花多糖通过抑制肝脏炎症反应改善肝纤维化。此外,文献[34]报道抑制NF-κB的表达能够减少HSCs活化,促进HSCs凋亡,进而减少细胞外基质产生[34]。本研究中虫草花多糖降低NF-κB的表达,暗示其通过影响HSCs活化进而发挥改善肝纤维化的作用。同时,本实验发现虫草花多糖能够促进PPARγ的表达,而PPARγ具有促进抗炎基因表达的作用[23-24],从另一方面表明虫草花多糖通过抑制肝纤维化模型小鼠肝脏炎症,从而改善肝纤维化。此外,PPARγ的激活能够抑制HSCs的活化[11-12],本实验中,虫草花多糖组小鼠肝脏PPARγ蛋白表达的上调,暗示虫草花多糖具有抑制HSCs活化的潜在作用。
肝实质细胞凋亡也被认为是促进肝纤维化的又一因素[35]。研究表明,金线莲多糖能通过BCL-2/BAX信号通路抑制小鼠肝细胞凋亡,从而抑制肝纤维化[36]。灵芝作为传统中药,其多糖同样能够通过抑制肝细胞凋亡,从而起到抑制肝损伤的作用[37]。本研究发现,虫草花多糖喂食能够显著上调肝纤维化模型小鼠肝脏BCL-2蛋白表达水平,下调BAX蛋白表达水平,表明虫草花多糖能够通过BCL-2/BAX信号通路抑制肝实质细胞凋亡,改善肝纤维化。
基于以上实验结果,本研究表明虫草花多糖通过多靶点改善动物模型肝纤维化,期望其对肝纤维化的治疗提供新思路。

