外标法与主成分校正因子法测定缬沙坦氨氯地平片中已知杂质含量的价值对比
吴健龙,关 东,吕海亮,黄 松,杜 伟,陈亚军★,谢 斌★
(1. 武汉科技大学药学系,湖北 武汉 430065 ;2. 珠海润都制药股份有限公司,广东 珠海 519041)
缬沙坦氨氯地平片是一种复方降压药,其主要成分为缬沙坦和苯磺酸氨氯地平。缬沙坦为血管紧张素Ⅱ受体拮抗剂,苯磺酸氨氯地平为钙离子通道阻断剂。缬沙坦氨氯地平片主要用于治疗轻中度高血压[1],也可用于治疗高血压合并其他疾病,如高血压合并糖尿病[2]。与单用缬沙坦或苯磺酸氨氯地平治疗高血压相比,用缬沙坦联合苯磺酸氨氯地平治疗此病的效果更好,能有效控制患者的血压[3-4]。缬沙坦氨氯地平片为复方制剂,其中含有的杂质由已知杂质和未知杂质组成。为了达到有效控制缬沙坦氨氯地平片质量的目的,本试验参考41 版《美国药典》[5],分别采用高效液相色谱(HPLC)外标法与主成分校正因子法测定缬沙坦氨氯地平片中已知杂质在不同浓度中的含量,比较其回收率。本试验规定的缬沙坦氨氯地平片中的已知杂质为缬沙坦水解杂质、缬沙坦乙酯、氨氯地平有关物质A 和缬沙坦杂质B,但对缬沙坦杂质B 不要求进行含量控制。
1 仪器与试药
1.1 仪器
Agilent1260 高效液相色谱仪,包含在线脱气机、四元高压泵、自动进样器、二极管阵列检测器;XPR6UD5/A、XSR105/A 型电子天平。
1.2 试药
缬沙坦对照品(生产厂家:珠海润都制药股份有限公司;批号:191202 ;含量:99.3%);苯磺酸氨氯地平对照品(生产厂家:中国食品药品检定研究院;批号:100374-201605 ;含量:100.0%);缬沙坦氨氯地平片(生产厂家:珠海润都制药股份有限公司;批号:20200701、20210301);缬沙坦杂质B(生产厂家:广州隽沐生物科技股份有限公司;批号:DM19032510 ;含量:97.83%);缬沙坦水解杂质( 生产厂家:广州隽沐生物科技股份有限公司;批号:DM19011033 ;含量:99.49%);缬沙坦乙酯(生产厂家:广州隽沐生物科技股份有限公司;批号:DM18070911 ;含量:99.22%);富马酸氨氯地平有关物质A(生产厂家:广州隽沐生物科技股份有限公司;批号:DM18071201 ;含量:99.31%);缬沙坦氨氯地平片(生产厂家:珠海润都制药股份有限公司;批号:20200701);空白辅料(生产厂家:珠海润都制药股份有限公司;批号:PXA-1202008049)。甲醇、乙腈为色谱纯,三乙胺、磷酸为分析纯,水为超纯水。
2 方法与结果
2.1 HPLC 色谱条件
色谱柱:十八烷基硅烷键合硅胶为填充剂(WatersSymmetryC18,150 mm×3.9 mm,5μm)。流动相A:取三乙胺10 mL 加水至1000 mL,用磷酸调节pH 值至2.8。流动相B:甲醇-乙腈(7:3,V/V)。洗脱梯度见表1。检测波长:237 nm。进样量:10 μL。流速:1.0 mL/min。柱温:30℃。进样温度:10℃。

表1 洗脱梯度
2.2 溶液配制
2.2.1 空白溶液/ 稀释液 将流动相A 与流动相B等比例混合,即制得空白溶液/ 稀释液。
2.2.2 对照品溶液 取缬沙坦、苯磺酸氨氯地平、已知杂质对照品(缬沙坦水解杂质、缬沙坦乙酯、富马酸氨氯地平有关物质A 对照品),用稀释液分别配制成缬沙坦溶液(浓度为0.32 μg/mL)、氨氯地平溶液(浓度为0.20 μg/mL)、缬沙坦水解杂质溶液(浓度为0.32 μg/mL)、缬沙坦乙酯溶液(浓度为0.32 μg/mL)、氨氯地平有关物质A 溶液(浓度为0.5 μg/mL),即制得对照品溶液。氨氯地平与苯磺酸氨氯地平的换算因子为0.721(408.88/567.05),氨氯地平相关物质A 与富马酸氨氯地平相关物质A 的换算因子为0.778(406.86/522.94)。
2.2.3 供试品溶液 取供试品(缬沙坦氨氯地平片)10 片,置于500 mL 的量瓶中,加稀释液溶解后进行定容、离心处理,取上清液作为氨氯地平供试品溶液,取上清液稀释10 倍作为缬沙坦供试品溶液。
2.2.4 加样供试品溶液 分别取供试品2 片、各已知杂质对照品适量,置于100 mL 的量瓶中,加稀释液溶解,定容至刻度,分别配制成缬沙坦水解杂质溶液(浓度为1.6 μg/mL)、缬沙坦乙酯溶液(浓度为1.6 μg/mL)、氨氯地平相关物质A 溶液(浓度为2.5 μg/mL)。对上述溶液进行离心处理,取上清液作为氨氯地平加样供试品溶液,取上清液稀释10 倍作为缬沙坦加样供试品溶液。
2.2.5 系统适用性溶液 取各已知杂质对照品适量,制成含缬沙坦杂质B0.08 mg/mL、缬沙坦0.16 mg/mL、氨氯地平0.10 mg/mL 的溶液,即制得系统适用性溶液。
2.2.6 空白辅料溶液 取空白辅料95 mg,置于50 mL 的量瓶中,用稀释液溶解,定容至刻度后进行离心处理,取上清液作为空白辅料溶液。
2.2.7 线性储备溶液 取缬沙坦、苯磺酸氨氯地平、已知杂质对照品,用稀释液分别配制成缬沙坦溶液(浓度为3.2 μg/mL)、氨氯地平溶液(浓度为2.0 μg/mL)、缬沙坦水解杂质溶液(浓度为3.2 μg/mL)、缬沙坦乙酯溶液(浓度为3.2 μg/mL)、氨氯地平相关物质A 溶液(浓度为5.0 μg/mL),即制得线性储备溶液。
2.2.8 杂质定位溶液 取已知杂质对照品适量,分别配制成缬沙坦水解杂质溶液(浓度为0.32 μg/mL)、缬沙坦乙酯溶液(浓度为0.32 μg/mL)和氨氯地平相关物质A 溶液(浓度为0.5 μg/mL),即制得杂质定位溶液。
2.2.9 已知杂质回收率溶液 分别取已知杂质对照品适量与本品4 片,置于200 mL 的量瓶中,分别配制成缬沙坦水解杂质溶液(浓度为0.800 μg/mL)、缬沙坦乙酯溶液(浓度为0.795 μg/mL)、氨氯地平有关物质A 溶液(浓度为0.052 μg/mL),将其作为定量限(Limit of Quantitation,LOQ)回收率溶液。同法配制成缬沙坦水解杂质溶液(浓度为0.16 μg/mL)、缬沙坦乙酯溶液(浓度为0.16 μg/mL)、氨氯地平相关物质A 溶液(浓度为0.25 μg/mL)作为50% 回收率溶液。同法配制成缬沙坦水解杂质溶液(浓度为0.32 μg/mL)、缬沙坦乙酯溶液(浓度为0.32 μg/mL)、氨氯地平相关物质A溶液(浓度为0.5 μg/mL)作为100% 回收率溶液。同法配制成缬沙坦水解杂质溶液(浓度为0.48 μg/mL)、缬沙坦乙酯溶液(浓度为0.48 μg/mL)、氨氯地平相关物质A 溶液(浓度为0.75 μg/mL)作为150% 回收率溶液。以上溶液各配制3 份。
2.3 方法学考察
2.3.1 系统适应性 精密量取“2.2”项下的系统适用性溶液10 μL,按“2.1”项下的色谱条件进行检测,记录色谱图。色谱图见图1。进行系统适应性试验的结果显示,系统适用性溶液中的其他成分对测定结果无干扰。
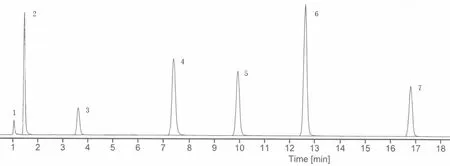
图1 系统适应性试验图谱
2.3.2 选择性考察 精密量取“2.2”项下的空白溶液、空白辅料溶液、杂质定位溶液、供试品溶液与加样供试品溶液各10 μL,以空白溶液作对比,按“2.1”项下的色谱条件进行HPLC 检测。检测的结果显示,空白溶液、空白辅料对检测结果无干扰;供试品溶液、加样供试品溶液中各峰的分离度均≥1.5,缬沙坦、氨氯地平的峰纯度均为1000.0。这表明本检测方法的选择性良好。
2.3.3 强降解试验
2.3.3.1 破坏试验 取缬沙坦氨氯地平片2 片分别置于100 mL 的容量瓶中,加水10 mL 使其崩解,并按如下条件进行破坏试验:1)酸:加1.0 mol/L 的盐酸溶液10 mL,放置20 h。2)碱:加1.0 mol/L 的氢氧化钠溶液10 mL,放置30 min。3)氧化:加30% 的过氧化氢溶液10 mL,放置90 min。4)光照:在照度为(4500lx±500lx)的光照箱中放置9 d。5)高温:在80℃下放置140 h。完成上述操作后,将样品放冷并将其pH 调至中性,加稀释液至刻度线定容,摇匀后进行离心处理,取上清液按“2.1”项下的色谱条件进行测定。检测结果见图2。进行破坏试验的结果表明,缬沙坦氨氯地平片经强酸、强碱、氧化、高温和光照破坏后,杂质峰数目和面积显著增加;所有杂质峰均能与氨氯地平峰、缬沙坦峰完全分离。这表明本检测方法的专属性良好。
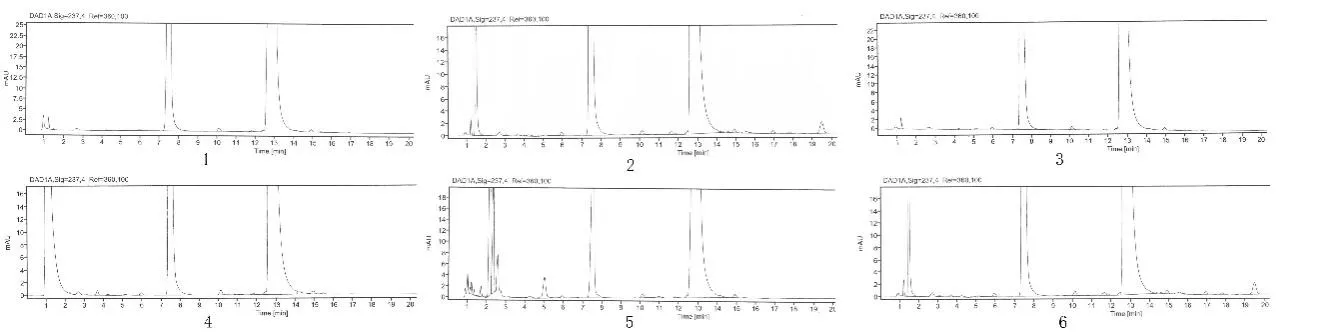
图2 强降解试验结果
2.3.3.2 杂质归属 分别取2 片缬沙坦氨氯地平片当量苯磺酸氨氯地平原料药、缬沙坦原料药、辅料,将其分别混合后得到待检品苯磺酸氨氯地平原料药、缬沙坦原料药、氨氯地平原料药+ 辅料、缬沙坦原料药+ 辅料。每种待检品均按照“2.3.3.1”项下的方法进行破坏试验并实施HPLC 检测,将检测结果与“2.3.3.1”项下的结果对比即得到杂质归属。详见表2。
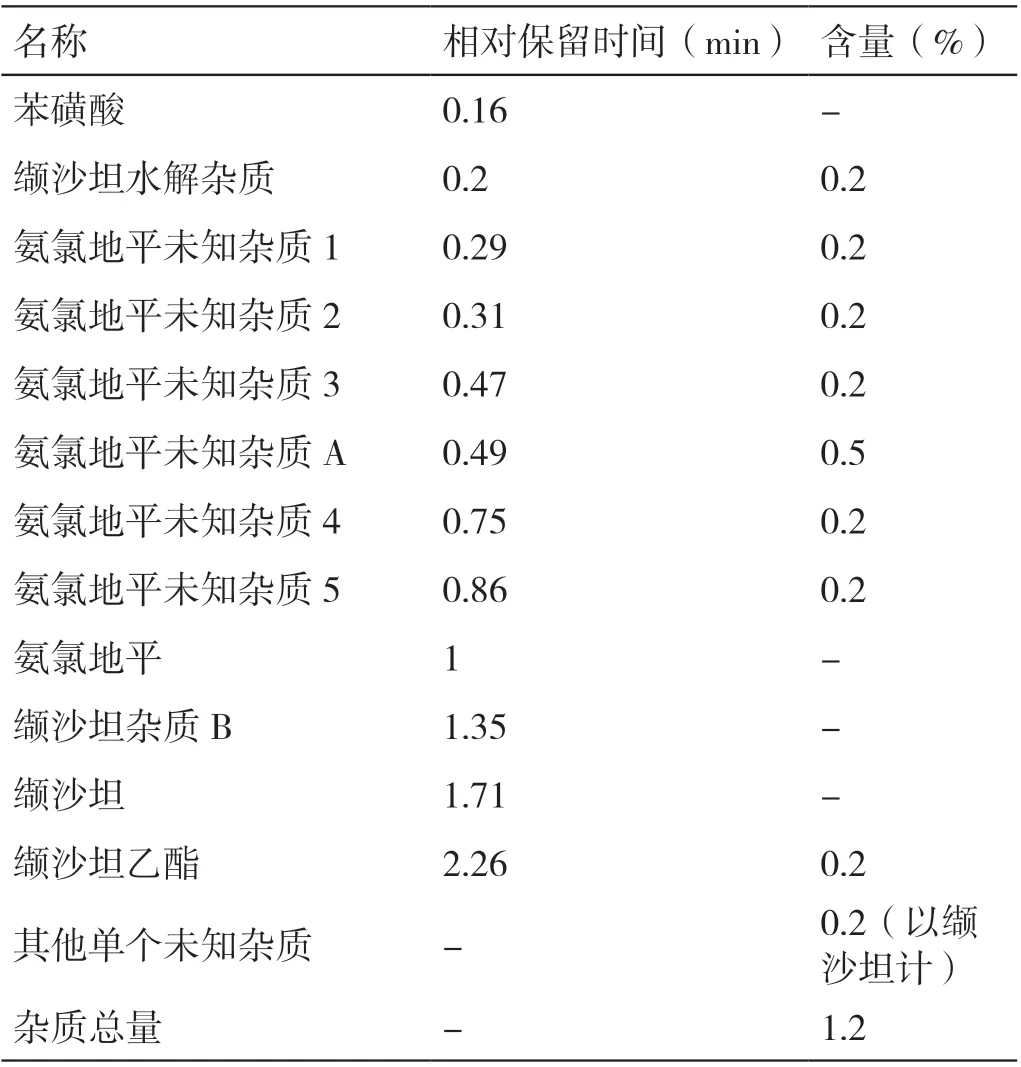
表2 缬沙坦氨氯地平片的杂质归属
2.3.4 LOQ、检测限与线性关系考察 配制各物质浓度为对照品溶液3 倍的LOQ 储备液,取一定量的LOQ 储备液,用稀释液逐步进行稀释,至信噪比≥10:1,摇匀即得到LOQ 溶液。精密量取检测限(limit of detection,LOD)溶液3 mL,置于10 mL的量瓶中,用流动相A 稀释至刻度并摇匀。精密量取LOQ 溶液与LOD 溶液各10 μL,按“2.1”项下的色谱条件进行HPLC 检测。分别精密量取
线性储备液5 mL、8 mL、10 mL、12 mL、15 mL,置于100 mL 的容量瓶中,用稀释液定容至刻度,配制成浓度为50%、80%、100%、120%、150%的线性溶液。精密量取各线性溶液10 μL,按“2.1”项下的色谱条件进行HPLC 检测,以峰面积为纵坐标,以进样浓度为横坐标,绘制标准曲线。回归方程及线性范围见表3。
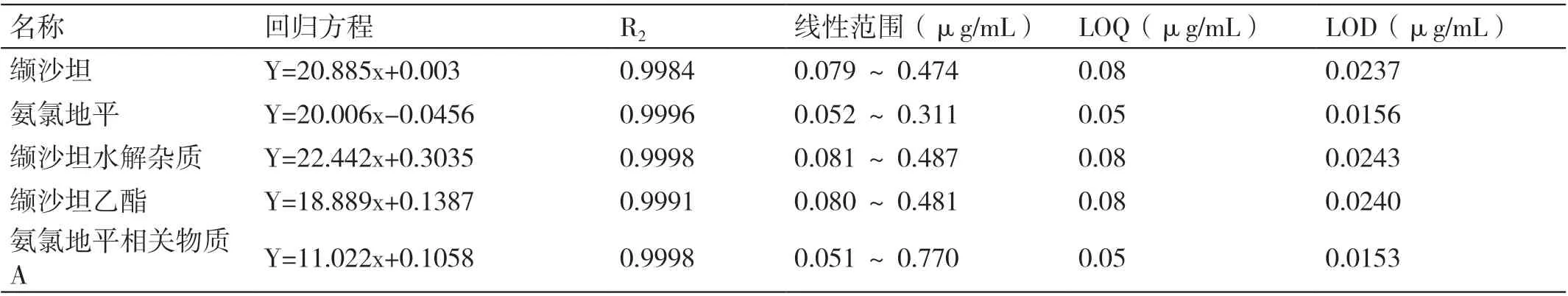
表3 回归方程及线性范围
2.3.5 重复性试验 取同一批号的供试品(批号为20200701),按照“2.2”项下的方法配制成缬沙坦加样供试品溶液、氨氯地平加样供试品溶液,平行配置6 份。精密量取各加样供试品溶液10 μL,按“2.1”项下的色谱条件进行HPLC 测定。检测的结果显示,氨氯地平相关物质A、缬沙坦水解杂质、缬沙坦乙酯峰面积的相对标准偏差(RSD)分别为3.82%、4.27%、3.72%,其他单个杂质未检出。这表明本检测方法的重复性良好。
2.3.6 溶液稳定性 按照“2.2”项下的方法配制加样供试品溶液与对照品溶液,将上述两种溶液在10℃的环境中储存一定时间,分别在放置0 h、24 h、48 h 后精密量取溶液10 μL,按照“2.1”项下的色谱条件进行HPLC 检测,测试加样供试品溶液与对照品溶液在10℃环境中的稳定性。检测的结果表明,加样供试品溶液与对照品溶液在10℃的环境中放置48 h 的稳定性良好。
2.4 主成分校正因子法
2.4.1 相对校正因子 按照“2.3.4”项下的线性关系考察试验,在不同人员、仪器、色谱柱条件下重复检测2 次,根据所得线性关系式按照杂质归属计算相对校正因子。相对校正因子=(主成分斜率/ 杂质斜率)。取2 次线性关系考察校正因子的均值作为实际校正因子f,结果见表4。
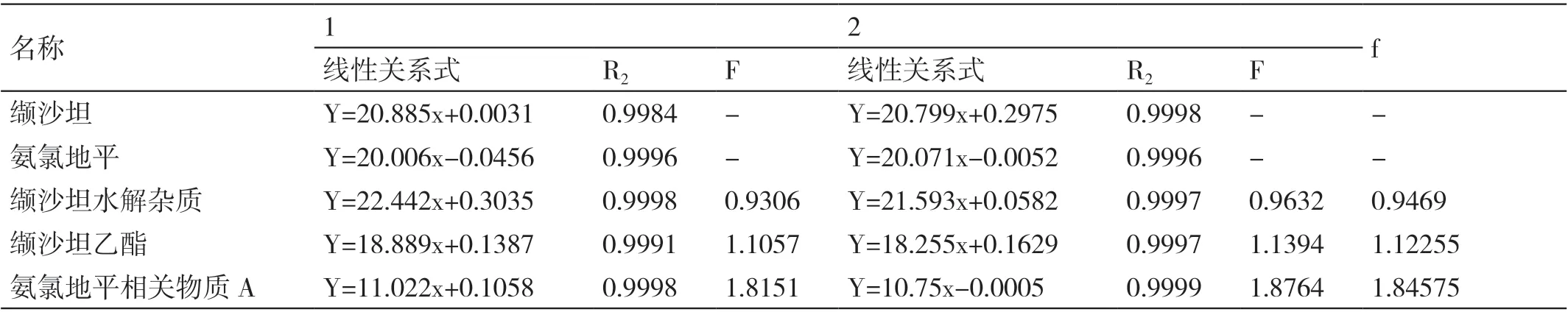
表4 已知杂质校正因子
2.4.2 不同色谱条件下校正因子法对有关物质的测定 考察色谱条件的变化对缬沙坦氨氯地平片有关物质检出情况的影响。按照“2.2”项下的方法配制氨氯地平相关物质A、缬沙坦水解杂质、缬沙坦乙酯(浓度分别为0.257 μg/mL、0.1598 μg/mL、0.1736 μg/mL)加样供试品溶液,考察流动相比例为52:48 和49.5:50.5、柱温变化为±2℃、流速变化为±0.1 mL/min、不同批次的色谱柱对本品杂质检测结果及杂质分离度的影响。结果表明,本品杂质的检测结果不受色谱条件变化的影响,主峰与邻近杂质峰及已知杂质的分离度良好。上述条件下测得杂质含量与实际含量的绝对变化值为:氨氯地平相关物质A 的绝对变化值为0 ~0.02%,缬沙坦水解杂质的绝对变化值为0 ~0.01%,缬沙坦乙酯的绝对变化值为0。其他未知的单个杂质未检出,总杂质的绝对变化值为0 ~0.02%。测得杂质含量大于0.05% 杂质峰的个数一致,主峰纯度均为1000.0。由此可见,本检测方法的耐用性良好。
2.5 外标法与主成分校正因子法测定
按照“2.2”项下的方法制备已知杂质回收率溶液,每种浓度平行制备3 份,按照“2.1”项下的色谱条件分别采用外标法与主成分校正因子法进行检测,重复检测3 次,得到回收率。取3 次测得回收率的平均值,采用SPSS 软件对其进行成对样本t检验,结果显示,采用外标法与主成分校正因子法测得的缬沙坦氨氯地平片中已知杂质的回收率相比,差异无统计学意义(P>0.05)。详见表5。
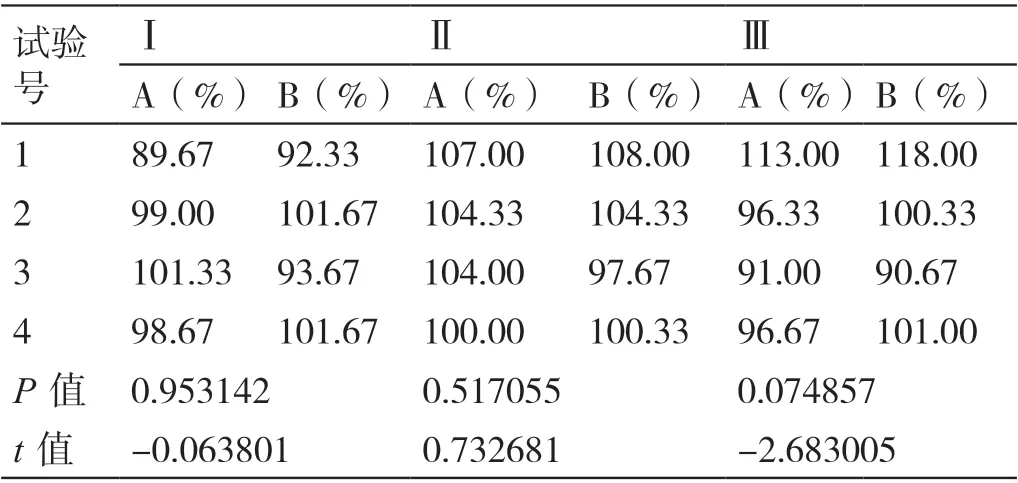
表5 采用外标法与主成分校正因子法测得缬沙坦氨氯地平片中已知杂质回收率的对比
2.6 样品中杂质含量的测定
分别采用外标法和主成分校正因子法对缬沙坦氨氯地平片中的已知杂质进行计算,除去苯磺酸的峰,其他所有未知杂质均参照强降解试验杂质归属表进行杂质归属。取2 批样品(20200701,20210301)按照“2.2”项下的方法制备供试品溶液并进行检测,结果显示缬沙坦水解杂质、缬沙坦乙酯和其他单个未知杂质均未检出。采用外标法进行检测时,氨氯地平相关物质A 的含量分别为0.034% 和0.030%,单一最大杂质的含量分别为0.034% 和0.030%,总杂质的含量分别为0.034% 和0.030%。采用主成分校正因子法进行检测时,氨氯地平相关物质A 的含量分别为0.036%和0.030%,单一最大杂质的含量分别为0.036% 和0.030%,总杂质的含量分别为0.036%和0.030%。
3 讨论
本试验的设计参考了《美国药典》(41 版)和相关的资料、文献[6-8]。从本试验的结果可以看出,采用外标法与主成分校正因子法测定缬沙坦氨氯地平片中已知杂质回收率的准确性均良好,组间相比差异无统计学意义(P>0.05)。这说明采用上述两种方法测定缬沙坦氨氯地平片中已知杂质的含量具有良好的可行性和可靠性。但在对缬沙坦氨氯地平片中已知杂质含量的限度考察中,主成分校正因子法减少了对照品的使用量,可实现以主成分为对照品进行缬沙坦氨氯地平片中有关物质含量的测定,在质量评价中能大幅降低测定成本。
综上所述,外标法与主成分校正因子法均可用于测定缬沙坦氨氯地平片中已知杂质的含量。但采用主成分校正因子法测定缬沙坦氨氯地平片中已知杂质的含量更加方便、经济。

