人胶质瘤U251细胞异柠檬酸脱氢酶1基因转染条件的建立和验证
丁楠,苏婷,许琳婧
(1.大连市公共卫生临床中心检验科,辽宁 大连 116033;2.大连市儿童医院检验科,辽宁 大连 116000)
胶质瘤是常见的原发性脑肿瘤类型,根据世界卫生组织(WHO)制定的组织病理学和临床标准,胶质瘤分为Ⅰ~Ⅳ级[1]。WHO第Ⅳ级肿瘤(胶质母细胞瘤)是最具侵袭性的肿瘤,预后不佳[2-3]。最近一项全基因组分析[4]发现,在约12%的胶质母细胞瘤中,异柠檬酸脱氢酶1基因(IDH1)的132密码子处存在体细胞突变。16密码子在6个继发性胶质母细胞瘤中也发现这些突变,提示IDH1突变可能发生在低级别胶质瘤形成后,并推动肿瘤向胶质母细胞瘤发展。近年来,很多学者对IDH1基因突变在肿瘤发生中的作用进行深入研究[5]。本研究利用转染技术,对人胶质瘤U251细胞进行IDH1基因过表达,建立适用于U251细胞IDH1过表达的最佳转染方案,并通过筛选获得稳定转染的IDH1过表达人胶质瘤U251细胞系,以期为后续针对胶质瘤细胞IDH1突变的各种研究奠定基础,现报道如下。
1 材料与方法
1.1 实验材料 U251人胶质瘤细胞系购自上海子实生物科技有限公司。DMEM高糖培养基、0.25%胰酶-EDTA(美国Gibco公司);PBS缓冲液、胎牛血清、青霉素/链霉素双抗(美国HyClone公司);抗生素G418二硫酸盐(美国Sigma-Aldrich公司);jetPRIME转染试剂(法国Polyplus-transfection公司);IDH1 Human Mutant ORF Clone、pCMV6-Entry Tagged Cloning Vector、Anti-DDK(FLAG)单克隆抗体(美国Origene公司);RNAiso Plus、Primer-Script RT reagent Kit with gDNA Eraser、SYBR Premix Ex Taq(Tli RnaseH Plus,日本Takara公司);氯仿、甘氨酸(中国国药试剂公司);异丙醇、无水乙醇、甲醇(中国科密欧公司);Tris、SDS(中国Solarbio公司);SDS-PAGE凝胶快速制备试剂盒(中国Biosharp公司);BCA蛋白定量试剂盒、蛋白电泳Marker(美国Thermo公司);PVDF膜(0.22μm,德国Millipore公司);脱脂奶粉(中国伊利公司)。
采用三气二氧化碳培养箱、超纯水仪、倒置显微镜、台式冷冻大容量离心机、凝胶成像系统、超净工作台、PCR扩增仪、蛋白电泳槽、半干转印槽、酶标仪、微量蛋白核酸分析仪、pH仪、电子分析天平。实验所需要的引物,由Takara公司合成,见表1。
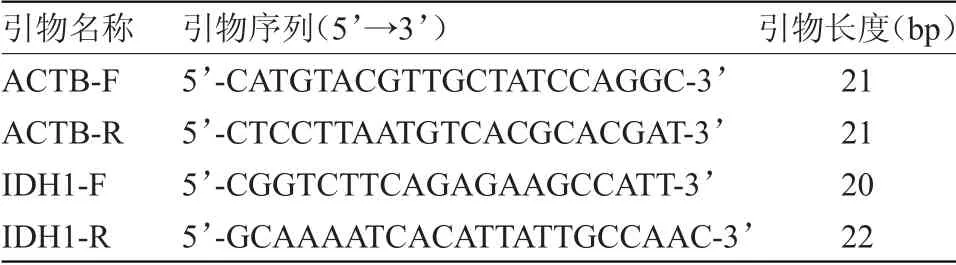
表1 PCR引物Table1 PCRPrimer
1.2 方法 DMEM细胞完全培养基(500 ml):500 ml DMEM基础培养基+50 ml 10%胎牛血清+10 ml 2%青霉素/链霉素溶液,充分混匀,4℃保存备用。Western blot电泳缓冲液(1 L):25 mmol/L Tris 3.029 g+190 mmol/L甘氨酸14.263 g+0.1%SDS 1 g加入800 m1去离子水中搅拌溶解,调整pH至8.3,定容至1 L。Western blot转移缓冲液(半干转1 L):48 mmol/L Tris 5.815 g+39 mmol/L甘氨酸2.928 g+200 ml 20%甲醇+0.04%SDS 0.4 g,加入至800 m1去离子水中搅拌溶解,容量瓶定容至1 L。TBS缓冲液(1 L):3 g Tris+8 g NaCl+0.2 g KCl,加入至800 ml蒸馏水,pH调至7.4,再加水定容至1 L。TBS-T缓冲液:1×TBS+0.1%Tween-20。
1.3 实验步骤
1.3.1 细胞培养与传代 按照实验室细胞培养规范培养细胞,操作过程避免细胞污染,如进行细胞培养前打开紫外线灯照射台面30 min。按步骤加入试剂进行实验操作,传代前观察待传代细胞的生长状态及形态,使用EDTA胰酶使贴壁细胞变圆脱壁。
1.3.2 G418筛选浓度确定 300 mg G418加入3 ml PBS溶液,浓度为100 mg/ml,完全溶解后,0.22μm过滤,-20℃环境下保存。用DMEM完全培养基将G418稀释为0、100、200、300、400、500、600、700、800、900、1 000 mg/L。96孔板接种细胞,每孔200μl含G418完全培养基,每个浓度设4个平行,含G418培养基需现用现配。将培养孔中培养基吸除,PBS洗涤1次,每孔加入不同浓度筛选培养基,隔天更换1次筛选培养基,培养14 d,以最低细胞全部死亡浓度为基准,筛选出的浓度即为后续IDH1转染组和空白质粒(VCT)组细胞筛选及培养培养所需G418浓度。
1.3.3 细胞转染 使用浓度为200μl jetPRIME缓冲液稀释IDH1 HUMAN MUTANT ORFCLONE和pCMV6-ENTRY Cloning Vector。然后使用转染液滴定细胞,4 h后使用G418筛选培养基替换转染培养基,24 h后再筛选稳定细胞株。
1.3.4 RT-PCR法检测mRNA mRNA提取严格按照实验步骤,离心取上清液。
1.3.5 微量蛋白核酸分析仪检测RNA浓度 A260/A280可得到核酸的纯度,DNA一般1.8~2.0,RNA一般为2.0,测定mRNA浓度及纯度,符合要求方可进行后续实验。
1.3.6 反转录、cDNA扩增体系及扩增条件 按照日本宝生物公司PrimerScript RTreagent Kit with gDNA Eraser和SYBRPremix Ex Taq(Tli RnaseH Plus)试剂盒说明书进行,引物用无菌超纯水复溶即可。
1.3.7 Western blot实验 按要求稀释好梯度的标准品和提取的蛋白,加入200μl工作液,37℃放置30 min,酶标仪562 nm测吸光度,绘制标准曲线,根据吸光度值得蛋白浓度。采用4×SDSPAGELoading Buffer加入提取的蛋白样本后,震荡混匀,99℃5 min,煮沸变性后,置于冰上冷却,即可电泳,样品于-20℃环境下保存。按照说明书和目的蛋白分子量,配置12%SDS-PAGE胶。制备Working Solution,将其均匀的覆盖整个膜,室温静置2 min,按照检测仪器的使用方法操作,曝光条件根据每种条件每种抗体的曝光效果确定。
1.4 统计学方法 采用Minitab 17.0统计软件进行数据分析。
2 结果
2.1 G418用于筛选IDH1稳定转染U251细胞株浓度的确定 G418完全培养基培养正常细胞14 d,U251细胞全部死亡所需要的最低浓度为300 mg/L。
2.2 两组IDH1基因表达水平比较 IDH1转染组细胞表达IDH1基因高于空白质粒组(VCT组),差异具有统计学意义(P<0.05),见图1。
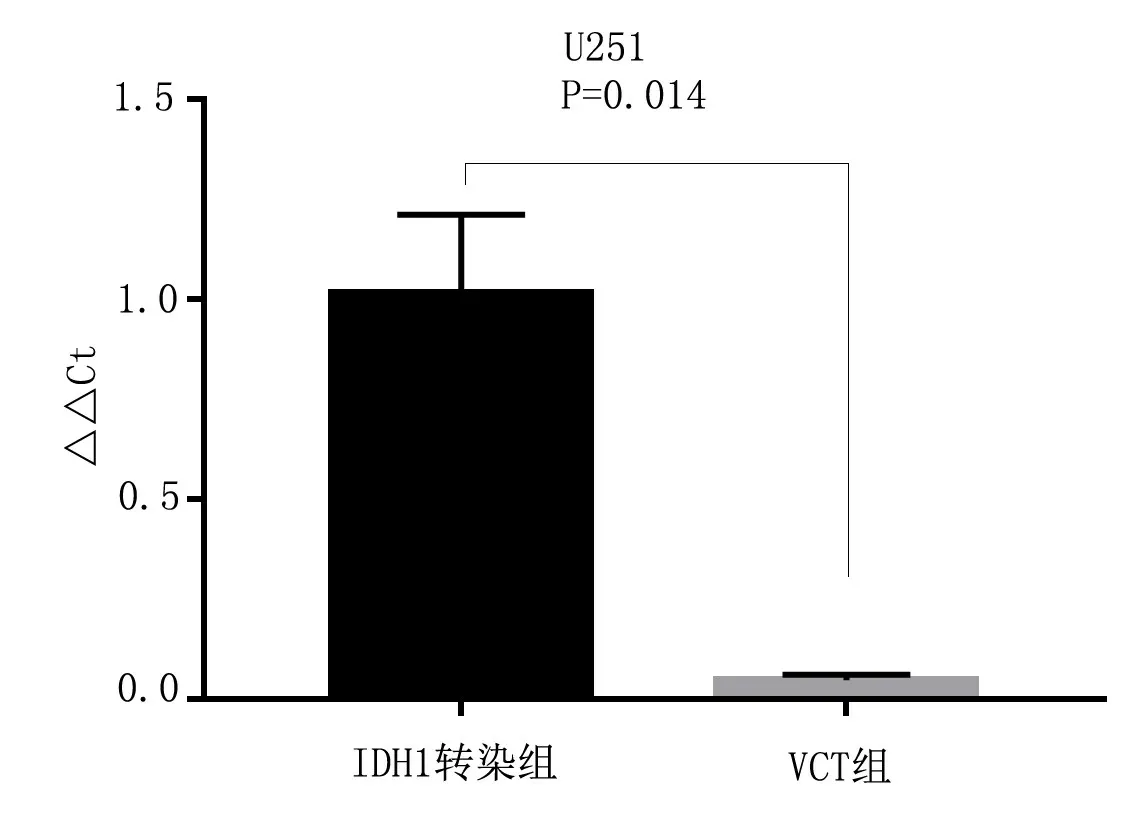
图1 两组IDH1基因表达水平比较Figure1 Comparison of IDH1 gene expression levels between the two groups
2.3 两组IDH1和标签DDK抗体蛋白表达比较DDK蛋白,两组细胞均有表达;IDH1蛋白,IDH1转染组表达IDH1更明显,见图2。
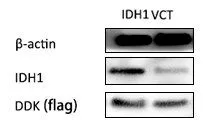
图2 两组IDH1和标签DDK抗体蛋白表达比较Figure 2 Comparison of the protein expression of IDH1 and tagged DDK antibodiesbetween the two groups
3 讨论
IDH1(R132H)突变是胶质瘤的重要预后预测因子和诊断标志,具有重要的临床意义。大部分Ⅱ、Ⅲ胶质瘤均存在IDH1基因突变,这种突变通常杂合子点突变,影响132位点的氨基酸精氨酸,导致其天然酶活性的丧失和替代酶活性的增加(产生D-2-羟基戊二酸)[6-7]。有研究表明,IDH1 R132H在体内外显著降低已建立的胶质瘤细胞系的侵袭性[8-10]。
本研究在胶质母细胞瘤细胞U251中转染IDH1过表达质粒。通过增殖情况,选择用于含质粒细胞筛选的最适抗生素G418浓度,经过G418筛选培养基,分别获得IDH1过表达质粒转染和空白质粒转染的U251细胞株。本研究DDK标签抗体验证了质粒转染条件的成功建立。IDH1转染组和空白质粒组U251细胞IDH1基因和蛋白在细胞中的表达,验证了转染试验成功,为后续针对胶质瘤细胞IDH1突变的各种研究奠定了基础。

