红景天苷对低氧性肺动脉高压小鼠心功能的影响*
赵白信,于慧娟,焦方杰,邢丽丽,黄蕾,张艳,段少博,姚辉梅
1.郑州市第七人民医院,河南 郑州 450016;2.郑州大学第一附属医院,河南 郑州 450052;3.河南省人民医院,河南 郑州 450003
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是指因缺氧引起的平滑肌细胞异常增殖及血管重塑而导致肺小动脉病变及肺动脉压力升高,最终发展为右心衰竭,严重威胁患者的生命安全[1-2]。HPH发病初期较为隐匿,容易被忽视,其临床诊断需依靠右心导管检查,但右心导管检查具有一定的创伤性且对医生技术有较高的要求,临床普及性有限。超声心动图作为一种安全、无创、可重复性强的检测方式,可间接评估肺动脉压力,对HPH的诊疗及预后评估有重要意义[3-5]。在HPH的进展过程中,肺血管重塑是其重要的病理环节,而炎症反应是肺血管重塑的重要驱动因素[6]。因此,减轻炎症反应,抑制肺血管重塑是延缓HPH进展的关键。红景天苷是草本植物红景天的主要有效成分,具有抗炎、抗氧化应激、抗病毒、抗肿瘤作用[7-8]。研究表明,红景天苷能舒张血管平滑肌,抑制高血压大鼠的血管重塑,发挥心血管保护作用[9]。目前,红景天苷与肺心病的相关性研究较多,但关于其对HPH小鼠心功能的影响及其作用机制尚未明确。因此,本研究建立HPH小鼠模型,探讨红景天苷对HPH小鼠心功能的影响及作用机制,旨在为红景天苷治疗HPH提供理论支持与实验证据。
1 材料
1.1 动物50只雄性C57BL/6小鼠,8周龄,体质量18~22 g,购自上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪)2018-0006。小鼠饲养在温度(22±2)℃,相对湿度(60±5)%,12 h/12 h明暗交替环境中,自由饮水进食。本研究在实施前已获得郑州大学动物伦理委员会批准,伦理批号:20180006。
1.2 药物与试剂红景天苷(上海源叶生物科技有限公司,纯度≥98%,货号:B20504);逆转录试剂盒(上海玉博生物科技有限公司,货号:205111);BCA蛋白定量试剂盒(上海信裕生物科技有限公司,货号:80816-500);二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、HE染色试剂盒(北京索莱宝科技有限公司,货号:DA1015D、SEKR-0009、SEKR-0005、G1120);核转录因子-κB((nuclear factor kappa B,NF-κB)、p-NF-κB、p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38 MAPK)、p-p38 MAPK一抗及HRP标记的羊抗兔二抗(美国Abcam公司,货号:ab223343、ab141406、ab195049、ab278674、ab6728)。引物序列由上海生工生物工程有限公司合成设计。
1.3 仪器ABIViiA TM7型实时荧光定量PCR仪(美国Life Technologies公司);Elx 800型酶标仪(美国Bio-Tek公司);SLP-2600型石蜡切片机、DM8000M型光学显微镜(德国徕卡公司);GE VOLUSON S6型彩色多普勒超声诊断系统(美国通用电气公司);Allegra X-12型离心机(贝克曼库尔特中国有限公司,离心半径:10 cm)。
2 方法
2.1 动物分组、模型制备及药物干预50只雄性C57BL/6小鼠按体质量分为对照组、模型组及红景天苷高(200 mg·kg-1)、中(100 mg·kg-1)、低(50 mg·kg-1)剂量组,每组10只。除对照组外,其余小鼠依据参考文献的方法建立HPH模型[10-11],具体如下:将小鼠置于常压低氧舱内,O2浓度维持10%,CO2浓度<5%,以无水氯化钙控制仓内水蒸气,每天8 h,每周6 d,维持4周,其余时间同对照组处于同一环境中(常温常压及正常的O2浓度和CO2浓度)。红景天苷高、中、低剂量组小鼠入仓前30 min腹腔注射20 mL·kg-1红景天苷溶液,每天1次,每周6次,维持4周[12],对照组和模型组予以腹腔注射等体积生理盐水。
2.2 超声心动图检测末次腹腔注射24 h后实施超声心动图检查,检测小鼠右心结构与功能。采用体积分数10%水合氯醛腹腔注射麻醉小鼠,取左侧卧位及仰卧位采集图像,12S探头,rodent模式,二维超声检查心脏结构,于左心室短轴乳头肌水平测量偏心指数(eccentricity index,EI),心尖四腔切面舒张期测量右心室壁厚度(right ventricular wall thickness,RVWT)、右室基底段内径(right ventricular diameter,RVD)、右室面积变化率(right ventricular fractional area change,RVFAC)。检测完成后转化频谱为多普勒模式,于胸骨旁主动脉根部短轴切面肺动脉瓣口处测量肺动脉瓣峰值血流速度(plumonary arterial velocity,PAV)及肺动脉血流加速时间(acceleration time,AT)。
2.3 右心导管法检测平均肺动脉压(mean pulmonary arterial presure,m PAP)及右心室收缩压(right ventricular systolic presure,RVSP)超声心动图测量完毕后,取仰卧位,将小鼠四肢固定于木板,分离右侧颈外动脉,PE导管经压力传感器链接PowerLab生理记录仪,另一端经颈外静脉缓慢插入右心室,再进入肺动脉,记录mPAP及RVSP,其中1 kPa=7.5 mm Hg。
2.4 ELISA法检测血清IL-6、TNF-α水平断头法处死小鼠,留取血液1 mL,室温下静止1 h,3 000 r·min-1离心15min,取上层血清,按照ELISA试剂盒说明书检测血清IL-6、TNF-α含量。
2.5 肺动脉血管组织病理学观察取小鼠肺组织,以4%多聚甲醛固定,石蜡包埋,制成厚度4μm的切片,HE染色,于显微镜下观察肺动脉血管组织的病理变化。
2.6 右心肥大指数(right ventricular hypertrophy
index,RVHI)检测PBS缓冲液冲洗干净心脏,剪开心房,沿室间隔将心脏分离成右心室、左心室和室间隔,称量右心室(right ventricle,RV)、左心室(left ventricle,LV)及室间隔(ventricular septum,S)的质量,计算RVHI。
RVHI=RV/(LV+S)
2.7 RT-qPCR检测肺组织NF-κB m RNA、p38MAPK m RNA的相对表达量每组选取5只小鼠肺组织,Trizol法提取总RNA,采用逆转录试剂盒将总RNA逆转录得到cDNA,RT-qPCR检测相关基因的表达水平。按照试剂盒说明书设定反应体系,反应条件:95℃预变性5 min;95℃变性25 s,60℃退火35 s,72℃延伸55 s,反应40个循环,再次72℃延伸8 min。GAPDH为管家基因,采用2-ΔΔCt计算目的基因的相对表达量。实验重复3次,取平均值。各基因引物序列见表1。

表1 引物序列
2.8 Western Blot检测肺组织中p38MAPK、p-p38MAPK、NF-κB、p-NF-κB蛋白的相对表达量取肺组织,提取总蛋白,BCA法检测蛋白浓度,电泳后转移至PVDF膜,5%脱脂奶粉封闭1 h,加入一抗(1∶1 000),4℃孵育过夜,PBS洗涤后加入二抗(1∶2 000),室温孵育1 h,洗膜后化学发光显影,Image Lab凝胶图像分析软件分析条带灰度值,以目的条带与内参条带GAPDH的灰度的比值表示目的蛋白相对表达水平。
2.9 统计学方法采用SPSS 26.0统计学软件分析数据,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
3 结果
3.1 红景天苷对HPH小鼠超声心动图指标的影响与对照组比较,模型组小鼠的RVWT、RVD显著升高(P<0.05),EI、RVFAC、PAV、AT显著降低(P<0.05);与模型组比较,红景天苷高、中、低剂量组小鼠的RVWT、RVD显著降低(P<0.05),EI、RVFAC、PAV、AT显著升高(P<0.05);与红景天苷高剂量组比较,红景天苷中、低剂量组小鼠的RVWT、RVD显著升高(P<0.05),EI、RVFAC、PAV、AT显著降低(P<0.05);与红景天苷中剂量组比较,红景天苷低剂量组小鼠RVWT、RVD显著升高(P<0.05),EI、RVFAC、PAV、AT显著降低(P<0.05)。提示红景天苷能显著改善HPH小鼠的超声心动图指标,且呈明显的剂量依赖性。见表2。
表2 红景天苷对HPH小鼠超声心动图指标的影响 (±s,n=10)
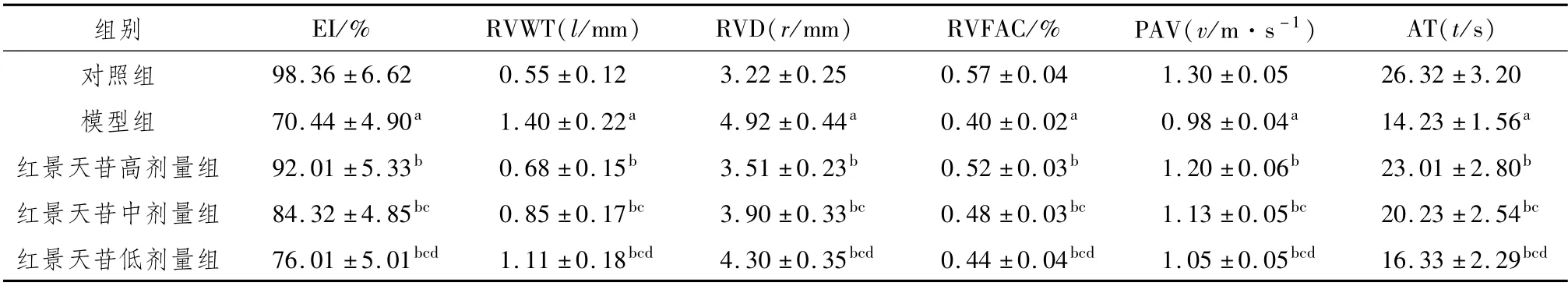
表2 红景天苷对HPH小鼠超声心动图指标的影响 (±s,n=10)
注:与对照组比较,a P<0.05;与模型组比较,b P<0.05;与红景天苷高剂量组比较,c P<0.05;与红景天苷中剂量组比较,d P<0.05
组别 EI/% RVWT(l/mm) RVD(r/mm) RVFAC/% PAV(v/m·s-1) AT(t/s )30±0.05 26.32±3.20模型组 70.44±4.90a 1.40±0.22a 4.92±0.44a 0.40±0.02a 0.98±0.04a 14.23±1.56a红景天苷高剂量组 92.01±5.33b 0.68±0.15b 3.51±0.23b 0.52±0.03b 1.20±0.06b 23.01±2.80b红景天苷中剂量组 84.32±4.85bc 0.85±0.17bc 3.90±0.33bc 0.48±0.03bc 1.13±0.05bc 20.23±2.54bc红景天苷低剂量组 76.01±5.01bcd 1.11±0.18bcd 4.30±0.35bcd 0.44±0.04bcd 1.05±0.05bcd 16.33±2.29对照组 98.36±6.62 0.55±0.12 3.22±0.25 0.57±0.04 1.bcd
3.2 红景天苷对HPH小鼠mPAP、RVSP、RVHI的影响与对照组比较,模型组小鼠的mPAP、RVSP、RVHI显著升高(P<0.05);与模型组比较,红景天苷高、中、低剂量组小鼠的mPAP、RVSP、RVHI显著降低(P<0.05);与红景天苷高剂量组比较,红景天苷中、低剂量组小鼠的mPAP、RVSP、RVHI显著升高(P<0.05);与红景天苷中剂量组比较,红景天苷低剂量组小鼠的mPAP、RVSP、RVHI显著升高(P<0.05)。说明红景天苷能改善HPH小鼠的心肺功能。见表3。
表3 红景天苷对HPH小鼠m PAP、RVSP、RVHI的影响 (±s,n=10)

表3 红景天苷对HPH小鼠m PAP、RVSP、RVHI的影响 (±s,n=10)
注:与对照组比较,a P<0.05;与模型组比较,b P<0.05;与红景天苷高剂量组比较,c P<0.05;与红景天苷中剂量组比较,d P<0.05
?
3.3 红景天苷对HPH小鼠血清中IL-6、TNF-α水平的影响与对照组比较,模型组小鼠血清中IL-6、TNF-α的水平显著升高(P<0.05);与模型组比较,红景天苷高、中、低剂量组小鼠血清中IL-6、TNF-α的水平显著降低(P<0.05);与红景天苷高剂量组比较,红景天苷中、低剂量组小鼠血清中IL-6、TNF-α的水平显著升高(P<0.05);与红景天苷中剂量组比较,红景天苷低剂量组小鼠血清中IL-6、TNF-α的水平显著升高(P<0.05)。说明红景天苷能降低HPH小鼠的炎症因子水平。见表4。
表4 红景天苷对HPH小鼠血清中IL-6、TNF-α水平的影响 (±s,ng·L-1)

表4 红景天苷对HPH小鼠血清中IL-6、TNF-α水平的影响 (±s,ng·L-1)
注:与对照组比较,a P<0.05;与模型组比较,b P<0.05;与红景天苷高剂量组比较,c P<0.05;与红景天苷中剂量组比较,d P<0.05
组别 n IL-6 TNF-α 10 18.22±3.25 38.54±4.23模型组 10 59.63±5.28a 142.32±8.89a红景天苷高剂量组 10 26.35±4.35b 50.32±6.01b红景天苷中剂量组 10 34.01±4.50bc 82.35±7.48bc红景天苷低剂量组 10 45.30±5.02bcd 102.42±7.85对照组bcd
3.4 红景天苷对HPH小鼠肺动脉血管组织病理变化的影响对照组小鼠肺小动脉血管壁薄,形态、管腔正常,结构清晰;模型组小鼠肺小动脉血管管壁增厚,管腔变窄,周围大量炎症细胞浸润,有血管重塑表现;与模型组比较,红景天苷高、中、低剂量组小鼠肺小动脉组织病理变化程度呈剂量依赖性减轻。说明红景天苷能明显逆转HPH小鼠的肺动脉血管组织病理变化。见图1。
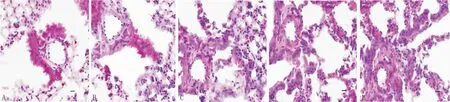
图1 红景天苷对HPH小鼠肺动脉血管组织病理变化的影响(HE染色,×200)
3.5 红景天苷对HPH小鼠肺组织NF-κBmRNA、p38MAPK mRNA表达水平的影响各组小鼠肺组织中NF-κB mRNA、p38MAPK mRNA相对表达量无明显差异(P>0.05)。见表5。
表5 红景天苷对HPH小鼠肺组织NF-κB mRNA、p38MAPK m RNA表达水平的影响(±s,n=5)
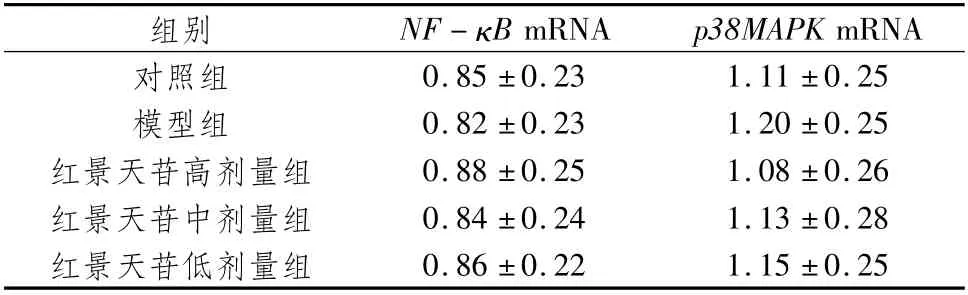
表5 红景天苷对HPH小鼠肺组织NF-κB mRNA、p38MAPK m RNA表达水平的影响(±s,n=5)
mRNA对照组组别 NF-κB mRNA p38MAPK 0.85±0.23 1.11±0.25模型组 0.82±0.23 1.20±0.25红景天苷高剂量组 0.88±0.25 1.08±0.26红景天苷中剂量组 0.84±0.24 1.13±0.28红景天苷低剂量组0.86±0.22 1.15±0.25
3.6 红景天苷对HPH小鼠肺组织p-NF-κB、NF-κB、p-p38MAPK及p38MAPK蛋白表达的影响与对照组比较,模型组小鼠肺组织p-NFκB/NF-κB、p-p38MAPK/p38MAPK的水平显著升高(P<0.05);与模型组比较,红景天苷高、中、低剂量组小鼠肺组织p-NF-κB/NF-κB、pp38MAPK/p38MAPK的水平显著降低(P<0.05);与红景天苷高剂量组比较,红景天苷中、低剂量组小鼠肺组织p-NF-κB/NF-κB、p-p38MAPK/p38MAPK的水平显著升高(P<0.05);与红景天苷中剂量组比较,红景天苷低剂量组小鼠肺组织p-NF-κB/NF-κB、p-p38MAPK/p38MAPK的水平显著升高(P<0.05)。说明红景天苷能抑制HPH小鼠肺组织中NF-κB、p38MAPK的磷酸化。见图2,表6。
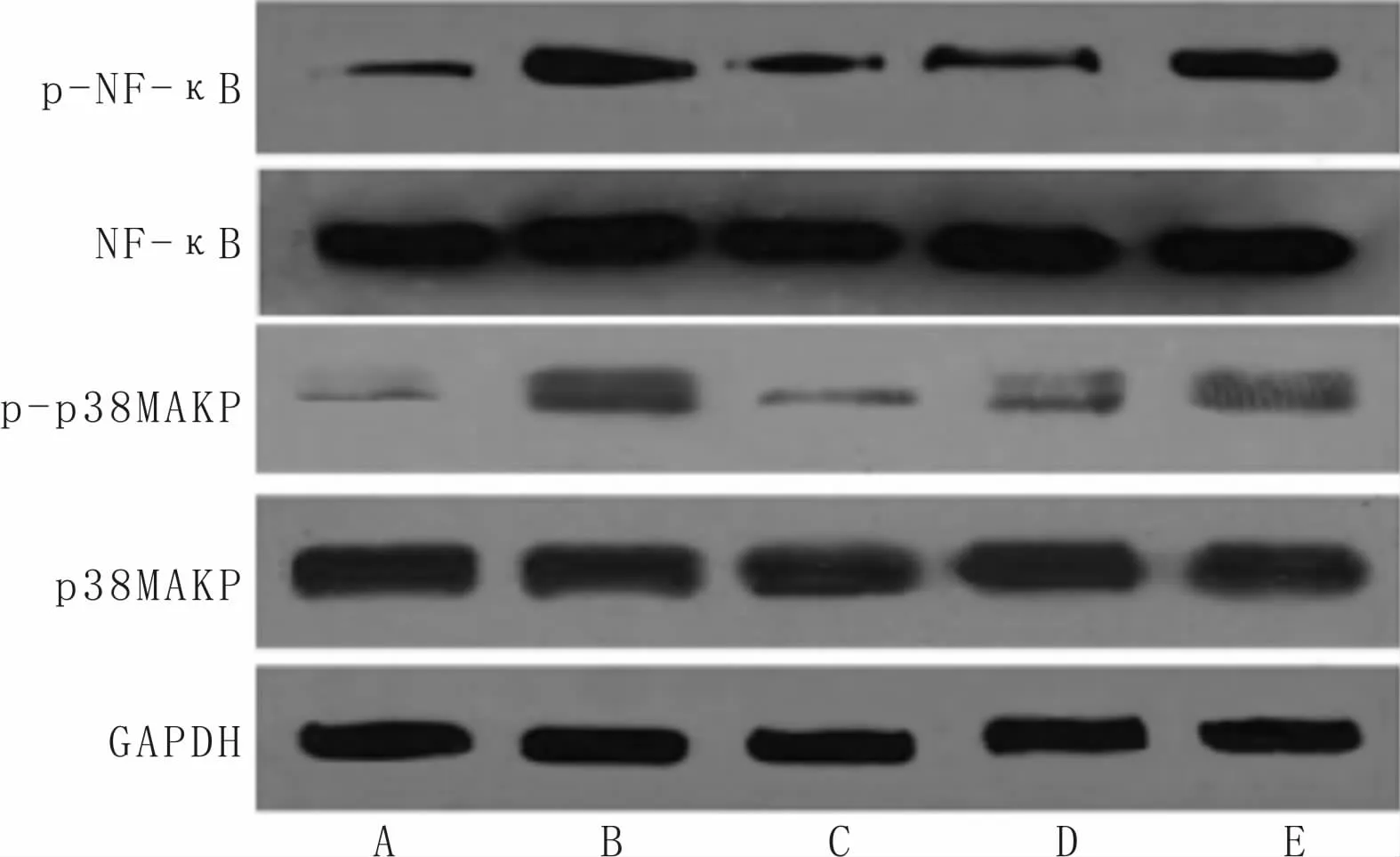
图2 Western Blot检测p-NF-κB、NF-κB、p-p38MAPK及p38MAPK蛋白表达
表6 红景天苷对HPH小鼠肺组织p-NF-κB、NF-κB、p-p38M APK及p38M APK蛋白表达的影响 (±s,n=5)

表6 红景天苷对HPH小鼠肺组织p-NF-κB、NF-κB、p-p38M APK及p38M APK蛋白表达的影响 (±s,n=5)
注:与对照组比较,a P<0.05;与模型组比较,b P<0.05;与红景天苷高剂量组比较,c P<0.05;与红景天苷中剂量组比较,d P<0.05
B p-p38MAPK/p38MAPK对照组组别 p-NF-κB/NF-κ 0.15±0.04 0.08±0.02模型组 0.95±0.15a 0.80±0.15a红景天苷高剂量组 0.22±0.08b 0.15±0.05b红景天苷中剂量组 0.42±0.10bc 0.32±0.10bc红景天苷低剂量组 0.65±0.13bcd 0.50±0.12 bcd
4 讨论
HPH的肺血管病变主要局限于细小动脉,血管内膜平滑肌细胞增生导致管壁增厚、管腔狭窄,肺周围阻力增加,进而出现肺循环淤阻及右心衰竭[13]。炎症介质介导的肺毛细血管管壁通透性增加,肺血管结构破坏,血管内皮收缩、舒张因子失衡是导致肺血管阻力升高和血管重塑的重要原因[14]。因此,阻断炎症反应介导的病理变化,抑制肺血管重塑,成为治疗HPH的重要环节。目前虽有内皮素受体拮抗剂、血管紧张素转换酶抑制剂等靶向抗血管扩张药物可减轻HPH的肺血管阻力,但价格昂贵;而其他糖皮质激素、免疫制剂等抗炎药物的不良反应多[15-16]。近年来,随着中医药学的发展,红景天苷作为中药红景天的主要有效成分,在降压、抗炎、增强免疫、保护心血管方面的作用逐渐被认知,为HPH的治疗提供了新的研究方向。
藏药红景天具有抗炎、抗衰老、免疫调节、清除自由基、增强免疫力、保护心血管等多种药理作用,广泛用于一氧化碳中毒迟发性脑病、急性脑梗死等疾病的治疗,在改善血液循环、抑制血小板聚集、保护神经细胞方面有显著的优势[17-21]。红景天苷为红景天的主要化学成分,能下调肺组织中TNF-α、IL-1的表达,改善HPH大鼠肺动脉压、颈动脉压与心肺功能[22]。Wei等[23]研究发现,红景天苷可抑制大鼠局灶性脑缺血后的炎症信号通路,减轻炎症及氧化应激反应,改善脑缺血。另外,红景天苷还可抑制高糖诱导的血管平滑肌细胞过度增殖,机制可能与抑制线粒体分裂有关[24]。以上研究均证实,红景天苷具有抑制肺组织炎症和血管内皮细胞增殖、降压、改善血液循环的作用。本研究显示,与模型组比较,红景天苷给药组小鼠RVWT、RVD、mPAP、RVSP、RVHI及血清IL-6、TNF-α水平显著降低,而EI、RVFAC、PAV、AT显著升高,肺动脉血管组织病理变化明显减轻,且作用效果呈剂量依赖性。提示,红景天苷可改善HPH进展过程中小鼠的右心结构及功能,降低炎症水平,抑制肺血管的重塑。
p38MAPK/NF-κB是与炎症反应调控机制密切相关的信号通路。p38MAPK能通过转录因子磷酸化发挥作用,参与炎症反应及细胞凋亡、分化的细胞周期过程[25]。研究证实,p38MAPK在受到各种刺激时可迅速磷酸化,促进相关底物的活化,介导炎症反应的发生[26]。NF-κB是在成熟B淋巴细胞中发现的重要核转录因子,可调控多种细胞因子、黏附分子和趋化因子的表达,从而调节机体的炎症反应[27]。You等[28]认为磷酸化的NF-κB参与肺动脉平滑肌细胞的增殖。本研究显示,与模型组比较,红景天苷高、中、低剂量组小鼠肺组织中p-NFκB/NF-κB、p-p38MAPK/p38MAPK的水平显著降低,且呈明显的剂量依赖性。
综上所述,红景天苷可显著改善HPH小鼠的心脏功能,减轻炎症反应,其作用可能与抑制p38MAPK、NF-κB蛋白磷酸化有关。

