纵隔包虫病CT 及CMR 表现并文献复习
张志杰 曹剑 王怡宁
包虫病为全球性分布的人畜共患疾病,我国农牧区为高发地区之一,人群患病率为0.5%~5.0%[1]。该病可发生于全身各个脏器,以肝脏居多,其次是肺部。胸内肺外包虫病非常罕见,发病率为5%~7%,而包虫病中仅不足0.1%发生于纵隔[2]。目前感染人体的包虫病主要分为囊型包虫病和泡型包虫病。2021 年由中华医学会放射学分会组织制定了肝包虫病影像学诊断专家共识,根据囊型包虫病生物学演变进程中囊、实性成分的构成和小囊泡分布模式的影像特征将其分为5 型:1 型,多个小囊泡无实性成分;2 型,具有实性成分及多个小囊泡;3 型,围绕有多个小囊泡的中心合并大和/或不规则囊肿的实性肿块;4 型,实性肿块无囊泡成分;5 型,大囊肿无实性成分。泡型包虫病的分型目前尚未达成一致。该共识还推荐CT 作为肝包虫病的常规检查方法,MRI 作为肝包虫病的必要补充方法。本文回顾性分析1 例纵隔包虫病(属于囊型包虫病影像分型中的5 型)的临床、病理资料及CT、心脏MR 影像表现并进行文献分析,以提高对该病的认识。
1 临床资料
病人男,38 岁,无明显诱因出现意识障碍,伴口吐白沫、牙关紧闭及抽搐。心电图示心肌缺血伴房室传导阻滞,ST 段呈下斜型(>0.1 mV),肌红蛋白>1 200.0 ng/mL(正常值5.0~70.0 ng/mL),嗜酸性粒细胞0.02×109/L[正常值(0.02~0.52)×109/L],血清学包虫实验阴性。既往有肝段内多发包虫病感染史。
2 心脏影像表现
CT 平扫显示右侧冠状沟类圆形囊状稍低密度,腔内密度均匀,CT 值为30~40 HU,壁薄呈断线状钙化;增强扫描后未见强化,病灶边界与右冠状动脉近段分界不清,并见管径局限变窄,右侧房室交界部受压凹陷。MRI 显示右侧冠状沟占位,T1WI 呈等信号,T2WI 黑血序列呈稍高信号,信号均匀,边界清晰,电影序列示右房、右室运动及三尖瓣开放受限,病灶随房室运动轻度抖动,右室射血分数20%,T1mapping 显示腔内信号均匀,native T1值为3 671~3 837 ms。静息首过灌注及延迟增强扫描影像均显示病灶无明显强化(图1-3)。
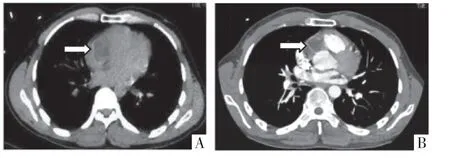
图1 心脏CT 平扫及增强影像。A 图,CT 平扫短轴面影像,显示右侧冠状沟内类圆形囊状稍低密度影,壁薄呈断线状钙化;B 图,CT 增强短轴面影像,显示病灶未见强化,邻近右冠状动脉近段受压,形态纤细,局部变窄。
3 手术及病理结果
术中见右侧冠状沟一灰白扁圆形肿物,靠近主动脉根部,右侧冠状动脉近段受压、推移,病灶质地柔软,表面光滑,与邻近组织粘连,行粘连松解+包虫内囊及部分外囊切除术。术后病理:肿物切面为囊性,囊壁厚0.1~0.2 cm,囊内可见灰黄粉皮样物及少量淡黄清亮液体,局灶质地硬;镜下见肿物由增生的纤维外囊壁及大片红染板层无结构的内囊构成,伴部分组织钙化。病理诊断为细粒棘球蚴病伴钙化(图4)。

图4 病理图。A 图,镜下可见板层状结构,其内伴钙化;B图,镜下可见红染板层状结构(HE,×100)。
4 讨论
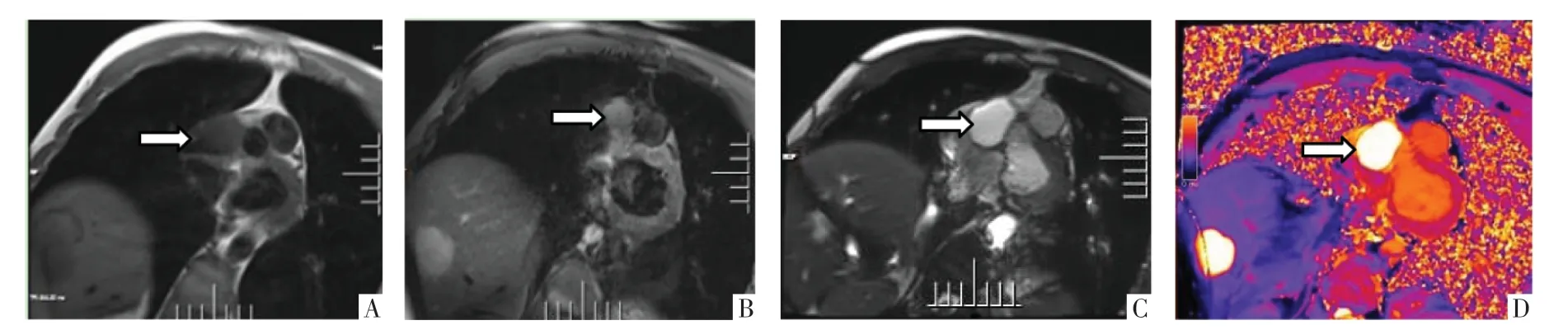
图2 心脏MR 平扫影像。A、B、C 图分别为T1WI、T2WI 黑血序列和电影序列短轴面影像,可见T1WI 上病灶呈低信号,T2WI 黑血序列上呈稍高信号,电影序列上呈高信号。D 图为T1 mapping 序列短轴面影像,可见病灶信号均匀。

图3 心脏MR 增强影像。A、B、C 图为首过静息灌注短轴面影像,不同期相上的病灶均未见强化。D 图,为延迟增强短轴面影像,显示病灶未见强化。
4.1 临床及病理特征 包虫病又称细粒棘球蚴病,是由棘球绦虫的幼虫寄生于哺乳动物体内所致的人畜共患疾病。文献[3]报道31~60 岁年龄组中,女性病例明显多于男性,男女比例为1∶3.2~4.1,推断原因可能是由于从事传统农牧业劳动的家庭中女性更多于男性,女性与易感动物接触机会较多。另外,包虫病可发生于人体的任何部位,其中发病率较高的脏器是肝脏和肺部,发病率分别为50%~70%、20%~30%[4]。纵隔内包虫病则较为罕见,当病灶表现出占位效应时大多数病人会有临床症状,但不具有特异性,这主要取决于病灶的大小、位置和邻近结构的受累程度。Ileri 等[5]对77 例纵隔包虫病病人进行研究,结果显示超过55%的病灶位于椎旁沟,36%位于前纵隔,8%以下位于腔室内。也有文献[6]报道纵隔包虫病病灶36%位于前纵隔,45%位于后纵隔,18%位于中纵隔,这些病人多因胸骨后或胸骨旁疼痛、咳嗽、吞咽或呼吸困难而就诊,也有病人以急性心包炎、急性冠状动脉综合征、房室传导阻滞为首发症状就诊。Chellaoui 等[7]对纵隔包虫病病人的常规实验室检查分析发现,嗜酸性粒细胞检查结果诊断价值有限,仅50%的病人血清学实验呈阳性。纵隔包虫病的发病机制尚不明确,有文献[8]报道该病可能由已经存在于肝穹顶的病灶经膈肌直接播散,或是病灶破裂后经下腔静脉产生的血源性播散,易发生于前纵隔。结合本例病人CT、心脏MR 影像表现和肝脏左叶外侧段包虫感染病史,可以推断其传播途径与经膈肌直接播散较为相似。另外,笔者通过回顾国内外有关纵隔包虫病的个案报道发现,单囊型和多子囊型较其他类型多见,分析其可能的原因是由于纵隔空间相对较小且结构复杂,病灶的早期囊型生物学特征即可引起临床症状。本例病人以胸痛不适和意识障碍入院,行心脏CT 检查后发现右侧冠状沟占位并压迫冠状动脉及右房、右室,结合临床症状、流行病史和发病部位诊断为纵隔包虫病,与上述文献[6,8]报道结果较为一致。本例病人出现心电图和心肌酶异常等临床症状,考虑为包虫病灶向上压迫右冠状动脉导致的心肌缺血所致。刘等[9]研究发现,镜下观察单囊型包虫病的内囊由生发层(生发细胞)和角皮层(红染平行的板层状结构)构成,其中生发层中可见生发囊和头节;外囊可见增生纤维组织形成的包膜,部分区域可伴钙化。本例病理结果与上述病理表现基本相符,但未见头节,推测其可能在术中随生发层一起脱落。
4.2 影像表现 包虫病标准化临床分型是WHO包虫病专家组在Gharbi 超声分型基础上根据其生物学演变进程(如囊变、内囊塌陷、实变或钙化)制定并达成共识,影像学分型与之基本保持一致[1]。近年有文献[4,8]报道纵隔包虫病中多数病灶以囊型为主,其他分型较少见,CT 平扫显示腔内囊状低密度影,部分病灶壁可呈线状钙化,占位效应明显,增强后无强化。本例病灶表现与之较为相似。心脏MR检查具有较高的软组织分辨力,可以充分显示包虫病灶的成分和结构,可为临床诊断和治疗提供更多补充信息。本例病灶壁薄,腔内信号均匀,T1WI 上呈低信号,电影序列上呈高信号,黑血抑脂序列呈稍高信号,出现以上影像表现的原因为病灶腔内成分的构成主要是以浆液性物质为主的无色透明液体,同时掺杂因退化出现的可被吸收、浓缩的胶冻样物,这些与术中所见一致。有文献[10]报道,活动期包虫病灶腔内成分的构成可有原生质体头节或包虫砂的沉积,这种现象在T1mapping 序列可能会呈现混杂信号,与处于生物学演变进程晚期囊型包虫病灶的均匀信号不同,推测原因可能是晚期囊型包虫病灶腔内头节已死亡机化,故腔内信号较处于活动期的包虫病病灶均匀,临床依此可以判断病灶是否处于活动期来指导抗寄生虫药物的使用。但这还需要进一步收集更多数据进行研究证实。另外,有文献[11]报道包虫壁延迟增强后呈线状高信号,而本例病灶壁未见强化,与之不同,笔者认为该征象有待探讨,如报道的病灶所处的生物学演变进程不同,亦可有不同的延迟强化表现。
4.3 鉴别诊断 纵隔包虫病发病率低,临床较为罕见,但纵隔包虫病囊型发病率相对较高,故临床工作中诊断纵隔囊性占位也应考虑到纵隔包虫病感染的可能,注意与纵隔内囊性占位,如心包囊肿、支气管囊肿和胸腺囊肿、成熟型囊性畸胎瘤鉴别:①心包囊肿,位于纵隔后下区,形状呈三角形、椭圆形或类圆形,无囊壁,内部无钙化,均匀水样密度,增强扫描无强化。②支气管囊肿与胸腺囊肿,均表现为均匀的水样密度影,支气管囊肿多位于中纵隔,增强CT 成像特点为病灶内无强化,囊肿壁多数强化;而胸腺囊肿大多数位于前纵隔,病灶内无强化。③囊性畸胎瘤,多以厚壁单房和多房囊性为主,囊壁厚度不均,其内成分可有脂肪或钙化,增强后囊壁和壁内实性成分可轻度强化。总之,以上病变通过其好发部位和腔壁有无强化可以与纵隔包虫病进行鉴别。

