CMR 在心房结构和功能评估中的应用进展
马岩岩 钟玉敏
心脏磁共振(cardiac magnetic resonance,CMR)成像是定量评估心腔大小和功能的金标准,是一种无创性影像检查方法,不受透声窗的影响,也无电离辐射的风险,尤其适用于成人缺血性、非缺血性心脏病以及儿童先天性心脏病 (congenital heart disease,CHD)的诊断及随访,为临床提供了诸多有价值的信息[1-3]。一些研究[4-6]表明,在心动周期中,左心房和右心房不仅是储存血液的容器和心室充盈的管道,其结构和功能的改变在许多心血管疾病中显示出重要的诊断和预后价值。常用的评估心房结构和功能的影像学检查方法包括CMR 和超声,其中CMR 较超声具有更多优势。本文就CMR 在心房结构和功能评估中的临床应用及其研究进展予以综述。
1 心房结构和功能的CMR 参数测量
CMR 是一种无创性评估心房容积的成像方法,具有较高的时间和空间分辨力且可重复性好,可以较好地评估心房结构和功能[7-8]。
1.1 心房大小 CMR 评估心房大小的参数主要包括心房的直径、面积和容积[2,9]。其中心房容积评估的准确度最高。2019 年欧洲磁共振心腔定量评估专家共识建议使用左心房容积来提高评估的准确性[1]。对于右心房大小的评估,也推荐使用右心房容积作为评估指标[10]。
CMR 测量心房容积的主要方法包括基于二腔和四腔的双平面面积-长度法、Simpson 法以及三维模型法[11]。其中,基于短轴切面的Simpson 法被认为是CMR 测量心房容积的金标准,但影像采集耗时较长[12]。一项测量中国健康人群心房大小的磁共振参考值的研究中提出,双平面面积-长度法可替代短轴Simpson 法用于左心房容积的测量,其不仅节省图像采集和分析时间,还可以合理地评估左心房容积,但测量值要比实际容积小;而对于右心房容积的测量,则首选短轴法[7]。另外,心房大小还与性别有关,但经过体表面积(body surface area,BSA)标准化后可减小这种性别差异,所以心房参数指数化可以提供更多有效的信息,如左房容积指数(left atrial volume index,LAVI) 和右房容积指数(right atrial volume index,RAVI)[2,9]。另外,心房容积指数在肥胖病人的应用中可能存在一定的局限性,因为心房容积的增加不一定与BSA 成比例地增加,因此可能导致评估结果不准确[1]。
1.2 心房功能 在整个心动周期中,心房容积的改变可分为3 个期相,相应采用3 个功能参数评估心房功能,即心室收缩期接受相应血流的储存功能、舒张早期输送血流进入心室的管道功能、舒张末期自身收缩把剩余血液泵入心室的收缩功能[12]。这3个心室收缩舒张阶段所对应的心房容积参数依次为收缩末期的心房最大容积(maximum volume,Vmax)、舒张末期的心房最小容积(minimum volume,Vmin)和心房收缩前容积(pre-atrial contraction volume,VpreA)[7]。3 种容积计算得出的容积分数包括总射血分数、被动射血分数及主动射血分数,可以评估心房3 个期相的功能,相应的计算公式分别为总射血分数=(Vmax-Vmin)/Vmax×100%,被动射血分数=(Vmax-VpreA)/Vmax×100%,主动射血分数=(VpreA-Vmin)/VpreA×100%。
评估心房功能除了上述相关指标外,还可以通过心房应变和应变率来评估。目前主要应用的MRI技术包括MR 心肌标记成像、相位对比MRI(phasecontrast MRI,PC-MRI)、刺激回波位移编码成像(displacement encoding with stimulated echoes,DENSE)、应变编码成像(strain encoding,SENC)和心脏MR 特征追踪成像(cardiac MR feature tracking,CMR-FT)等[8]。心房在心动周期的3 个不同期相也对应着3 个应变值,分别为收缩期的储存应变(reservoir strain,εs)、舒张早期的管道应变(conduit strain,εe)以及舒张末期的收缩应变(pump strain,εa),具体的测量值及相应的应变率见图1,依次代表心房的储存功能、管道功能和收缩功能。有研究[5,12]表明,心房应变和应变率的改变,常早于心房大小和容积的改变,能够更早期、更敏感地提示一些心血管疾病。
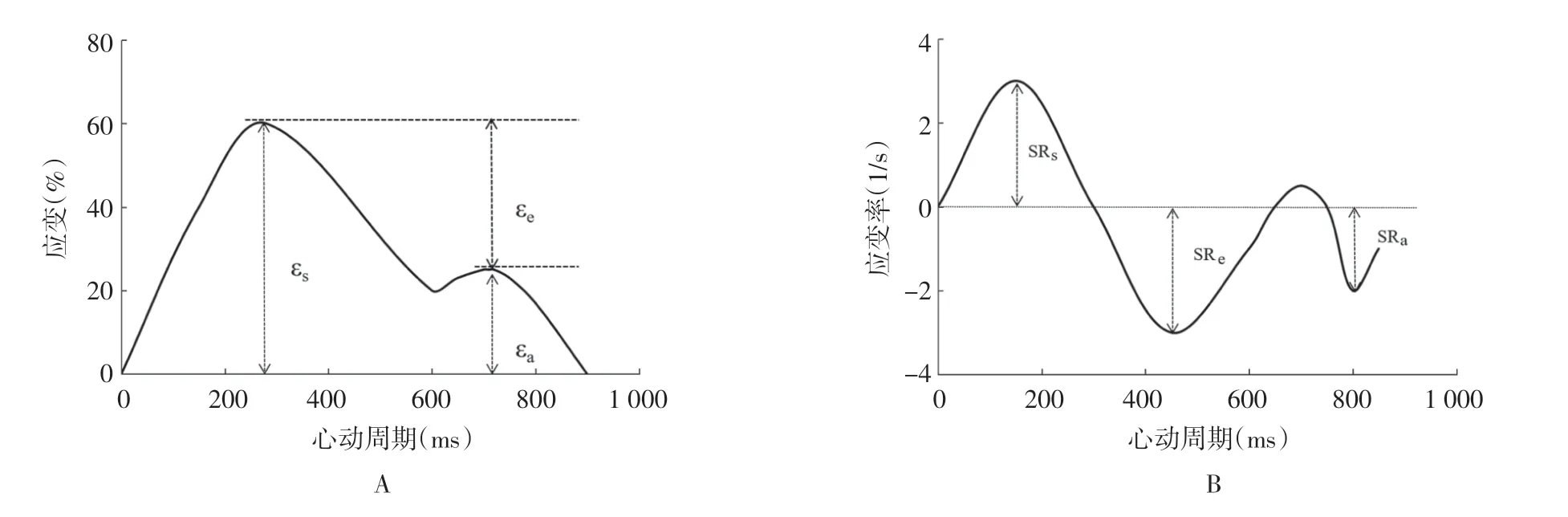
图1 心房时间-应变曲线(A)和应变率曲线(B)。A 图中εs、εe、εa 依次为储存应变、管道应变和收缩应变,B 图中SRs、SRe、SRa 依次为储存应变率、管道应变率和收缩应变率。
2 CMR 在心房结构和功能改变中的临床应用
2.1 心室功能不全和心力衰竭(heart failure,HF) 在心室功能不全的群体中,大多数人处于HF 的临床早期阶段,因此心室功能不全的早期诊断和治疗可以降低HF 的发生率。
心房结构和功能与心室功能密切相关。在心房容积方面,2016 年美国超声协会(American society of echocardiography,ASE)指南[13]提出,最大左房容积指数(LAVImax)>34 mL/m2作为评估左室舒张功能不全(LV diastolic dysfunction,LVDD)的4 个标准之一。也有研究[14]显示,最小左房容积(LAVmin)可以更好地反映左室舒张压,即使在有轻度舒张功能障碍时。Morris 等[15]研究发现,在LAVI 基础上加入左房应变值可以提高对左室功能不全的诊断率,并且可以评估2 年内因HF 住院的风险。对于右心室功能,右房大小和应变也可以反映右室舒张功能不全的严重程度,且能提供重要的预后信息[16]。另外,肺动脉高压(pulmonary arterial hypertension,PAH)病人的右房功能也会明显受损,其中右心室功能失代偿的PAH 病人的右房应变和应变率明显降低[17]。
心房结构和功能的异常还可以预测HF。左房功能障碍可以导致LVDD,进而可能发展为射血分数保留型HF(HF with preserved ejection fraction,HFpEF)。然而,并不是所有的HFpEF 病人都存在LVDD。由于要结合临床症状、心脏的形态以及生理指标,因此在临床实践中对这两种疾病的诊断仍然具有挑战性[18]。有研究[19]表明,左房应变下降是鉴别临床HFpEF 病人和无症状LVDD 病人的重要预测因子。Habibi 等[20]研究发现,在LAV 的相关测量值中,只有最小LAVI 与HF 事件独立相关,并且经CMR 测得的左房应变与HF 事件之间存在独立负相关。Cameli 等[21]对36 例左房收缩功能下降的HF病人进行研究,结果发现在所有左房功能参数中左房应变是肺毛细血管楔压升高的最强预测因子,其受试者操作特征曲线下面积为0.93,敏感度和特异度分别为100%和93%。
2.2 房颤(atrial fibrillation,AF) AF 是一种进行性疾病,最常始于血流动力学负荷增加或心房结构重构,包括心房扩大和心房纤维化。心房纤维化可能会导致正常的电传导中断和新的回路建立,从而增加AF 的发生率及持续时间。长期的AF 也可以促使心房进行性扩张和功能损害,如心房顺应性和收缩性降低[22]。由此可知,心房的结构和功能与AF 密切相关。
经药物治疗或射频消融术后成功复律的AF 病人,LAV 会有明显改善。有研究[6,22]表明,LAV 可能是未来的AF 治疗靶点。Osranek 等[23]对孤立性AF病人经过平均27 年的随访发现,LAV 可以很好地预测不良心血管事件(脑血管事件、急性心肌梗死、HF 住院以及死亡)的发生。LAV 对消融术后AF 的复发也具有一定的预测价值[24]。
MR 延迟钆增强(late gadolinium enhancement,LGE)是评估局部心肌纤维化的有效方法。一些研究[6,22]表明,复律后的AF 病人,LGE 成像显示心肌纤维化程度下降。Pontone 等[24]研究表明,LGE 成像显示的纤维化程度越高,发生主要不良心脑血管事件的风险就越高。但由于存在心房壁菲薄、心脏和呼吸运动,以及有限的空间分辨力等局限性,该技术在临床上并未得到广泛应用,同时还需要更多技术层面的提升,以实现对心房纤维化的准确评估[25]。心房纤维化程度用于预测AF 病人治疗后的复发风险也有一定价值。Marrouche 等[26]应用LGE 成像对持续性和阵发性AF 病人进行了多中心前瞻性研究,根据心房壁纤维化范围占整个心房壁的百分比将左房纤维化程度划分为4 个等级(Ⅰ级:<10%,Ⅱ级:≥10%且<20%,Ⅲ级:≥20%且<30%,Ⅳ级:≥30%),结果显示,纤维化程度每增加1%,AF 复发的风险增加6%,并且预测AF 复发的能力有所提高。另有研究[27]表明,左房重构和右房重构均与阵发性AF 治疗后复发相关,而且2 种指标的联合应用可能比单独应用的预测效果更好。
2.3 原发性心肌病和缺血性心脏病 有研究显示,肥厚性心肌病(hypertrophic cardiomyopathy,HCM)病人相比健康对照组的LAV 普遍增大,左房纵向应变减少;LAVmax和LAVmin均可以预测HCM 不良心血管事件的发生,且后者比前者更敏感[28-29]。2014 年的欧洲心脏病学会指南将左房直径纳入风险分层模型,进而对HCM 病人5 年的心脏性猝死风险进行预测。有研究[30]表明右房容积的增大可能是HCM发生AF 的预测因子。Gulati 等[31]研究发现,扩张性心肌病(dilated cardiomyopathy,DCM)病人的LAV明显增高,且其与左室重塑、舒张功能不全以及二尖瓣关闭不全有关,LAV 是DCM 病人无移植生存率和HF 事件发生的独立预测因子,所以推荐将LAV 的测量常规应用于CMR 检查。
缺血性心脏病病人的心房结构和功能也存在异常。有研究[32]发现,在慢性稳定性冠状动脉疾病的早期,心房容积未发生变化之前,左房和右房的收缩应变及应变率已经降低,提示已经发生了一定程度的心房重构。Schuster 等[33]研究表明,心房结构和功能相关参数对心肌梗死后的主要不良心血管事件具有预测价值,其中左房储存应变是所有左房评估参数中唯一具有独立预测价值的因子。
2.4 先天性心脏病的术后随访 心房结构和功能异常对先心病的诊断和预后也有一定的临床价值,心房与心室功能密切相关。某些先心病能引起心房结构和功能的改变,如房室交界处的异常解剖、心室压力的升高和心室顺应性的降低,从而影响心房的前后负荷,进而导致心房结构和功能的改变。有研究者[12]对术前和术后的CHD 病人研究发现,两者心房功能障碍可能存在一个共同的途径,即心房代偿期时,储存和管道功能降低,收缩功能增加;心房失代偿期时,储存和管道功能进一步下降,收缩功能下降。
Stephensen 等[34]对房间隔缺损(atrial septal defect,ASD)病人术后的心房容积进行了MRI 评估,结果显示经导管封堵术后3 个月,右房容积下降,而LAV无变化,表明右房结构和功能的改变对ASD 术后存在潜在的预后价值。对于ASD 术后左房结构和功能改变的MRI 研究较少。一项超声的相关研究[4]显示,经导管封堵术后1 个月,ASD 病人的LAV 升高,左房应变及应变率明显下降,表明长期检测左心房功能可能有助于预测AF 的发生。
法洛四联症术后(repaired tetralogy of Fallot,rTOF)病人的心房结构和功能也会发生改变。Kutty等[35]研究发现,CMR-FT 获得的右心房容积和右房应变普遍存在异常。Hu 等[36]对rTOF 病人的左心房功能改变研究显示,在左心房扩大前,左房应变分析即可发现术后左心房功能不全,并提示左心房和右心房之间存在一定的协同作用。上述2 项研究表明CMR-FT 有望增加现有的CMR 技术对CHD 心房功能的评估价值。此外,心房结构和功能的异常也可以提示rTOF 病人的不良预后,如Ait 等[37]的研究表明,右房扩大是rTOF 病人不良临床预后的一个独立预测因子。Ta 等[38]研究发现左房功能与疾病预后有关,并且CMR 获得的左心房收缩功能升高,而储存功能和管道功能无显著变化,这可能是左室功能不全的早期表现,提示一定的不良预后。还有研究发现,CMR 获得的右房应变与Ebstein 畸形病人的纽约心脏协会(New York Heart Association,NYHA)分级和脑钠肽水平有关,可能是HF 发生的预测指标[39]。
3 小结
心房在调节心脏整体功能方面起着重要作用,它是血液回流心脏的蓄水池、管道和收缩泵。尽管在评估心房大小和功能的临床实践中超声检查更常用,但CMR 仍是定量评估心房大小和功能的金标准。心房大小和功能的异常与很多心血管疾病(包括CHD)有关,具有重要的诊断和预后价值。然而,如何以及何时将心房的相关指标纳入CHD 的影像评估标准仍是目前存在的问题。将来不仅需要来自大型前瞻性试验的可靠临床研究结果数据,确认心房在CHD 中的临床价值,而且还需要设备和成像技术的标准化,制定年龄和性别调整的正常参考值,使其更好地应用于临床。

