原发性小肠淋巴瘤(I):组织学类型及CT 诊断
黄梦庭 吴林霞 刁楠 韩萍
原发性胃肠道淋巴瘤是指原发于胃肠道黏膜下淋巴组织的恶性肿瘤,是结外淋巴瘤的常见表现形式,占所有结外淋巴瘤的30%~45%[1],占胃肠道恶性肿瘤的1%~4%[1-2]。其诊断需符合以下标准[3]:发病时无可触及的浅表淋巴结肿大;胸部影像学检查结果正常(无增大淋巴结);外周血白细胞计数正常;病变主要累及胃肠道,伴或不伴邻近区域淋巴结受累;无肝脾受累。原发性胃肠道淋巴瘤的晚期可有多脏器受累,在临床、影像和病理学上都无法与继发性胃肠道淋巴瘤区分;全身性淋巴瘤的胃肠道受累也很常见,近一半是在尸检或其他原因进行影像学检查时偶然发现[4-5]。因此,广义的原发性胃肠道淋巴瘤是指所有以胃肠道受累为主要临床特征的病例。
原发性小肠淋巴瘤(primary small intestinal lymphoma,PSIL)是指原发于十二指肠、空肠和回肠黏膜下淋巴组织的恶性肿瘤。PSIL 发病率低,起病隐匿,早期缺乏典型的症状和体征,同时由于十二指肠镜及结肠镜难以达到空、回肠,多数病人在初诊时已处于疾病进展期,因而早期明确诊断是较大的临床挑战。
近些年来随着影像技术的不断进步,尤其是CT肠道成像(CT enterography,CTE)、MR 肠道成像(MR enterography,MRE)的临床应用,使得PSIL 的检出率逐渐升高,影像学表现对小肠病变的诊断及鉴别诊断具有重要意义。因此,本文就PSIL 的临床特点、CTE 技术及其影像表现等进行介绍。
1 小肠的影像解剖及血供
成人的小肠全长5~7 米,上端起于胃幽门,下端连接盲肠,包括十二指肠、空肠和回肠,通过肠系膜附着于后腹壁,因此小肠活动度较大。空肠、回肠无明显分界,一般空肠指近侧2/5 的肠袢,回肠为远侧3/5 的肠袢。空、回肠主要由肠系膜上动脉的空肠支动脉和回肠支动脉供血,自第一腰椎水平发出后,沿途分出13~18 条小肠动脉,邻近的小肠动脉彼此吻合形成连续的动脉弓,再发出直小动脉到达相应肠管[6]。小肠的静脉最终汇入肠系膜上静脉。
据Cole 氏小肠分组法可将小肠分为6 组,分别为:第1 组,十二指肠;第2 组,左上腹部小肠(近段空肠);第3 组,左中下腹部小肠(远段空肠);第4组,中腹部小肠(近段回肠);第5 组,右中下腹部小肠(中段回肠);第6 组,盆腔部小肠(远段回肠)。见图1。
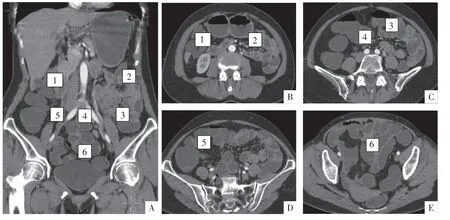
图1 CT 影像上Cole 氏小肠分组法的大致解剖区域。A 图为冠状面影像,B-E 图均为横断面影像。1-6 依次为:十二指肠、近段空肠、远段空肠、近段回肠、中段回肠、远段回肠。
2 胃肠道淋巴瘤的组织学类型
胃肠道内存在丰富的淋巴组织,包括固有层淋巴细胞、上皮内淋巴细胞、派尔斑(Peyer’s patches)及肠系膜淋巴结4 种不同类型淋巴组织[2,7]。派尔斑主要见于远段空肠和回肠,位于黏膜层并延伸至黏膜下层,为椭圆形或圆形淋巴滤泡,类似于淋巴结[8]。胃肠道淋巴瘤组织学类型多种多样,绝大多数为B 细胞源性非霍奇金淋巴瘤。弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL;38%~57%)及结外边缘区B 细胞淋巴瘤(extranodal marginal zone B-cell lymphoma,ENMZL;23%~48%)是最常见的2 种组织学亚型[7]。ENMZL 通常发生在胃,与幽门螺杆菌的慢性感染有关,是一种浅表播散性病变,易导致黏膜结节或溃疡形成及轻度肠壁增厚[9]。DLBCL 可以是新发的,也可来自ENMZL 或其他低级别淋巴瘤的转化,这种类型的淋巴瘤可形成广泛的肠壁增厚或巨大肿块,但梗阻并不常见[10]。Burkitt淋巴瘤常以回盲部肿块或回肠末端肠壁增厚为特征。原发性胃肠道霍奇金淋巴瘤较罕见(<1%)[7]。
3 胃肠道淋巴瘤的临床表现
胃肠道淋巴瘤可累及胃肠道全程,胃最常受累(60%~75%),其次是小肠(20%~30%)、大肠(5%~20%),很少累及食管[2,11]。好发年龄为50~60 岁,男性多于女性,儿童少见。其危险因素包括:幽门螺杆菌感染、人免疫缺陷病毒、EB 病毒、乙型肝炎病毒、炎症性肠病和系统性红斑狼疮等[4,12]。根据发病部位不同,胃肠道淋巴瘤的临床表现多样且无特异性,多数病人主要表现为间歇性腹痛、不规则发热,还可有腹胀、恶心、呕吐、食欲减退、腹部肿块等,也可表现为消化不良,如腹泻、体质量减轻,少数病人可出现胃肠道出血、肠梗阻、肠套叠等相关并发症[13]。
4 CTE 检查
CTE 是肠道检查的有效方法,可清晰显示肠腔、肠黏膜及肠管外组织结构的改变。检查前需进行肠道准备,如未充分扩张及清洁肠管则在CT 扫描时难与肿块、增大的淋巴结等病变区分。因此,适度充盈肠腔,对于CTE 检查的成功至关重要。
CTE 检查前肠道准备[14]:①扫描前8 h 禁食,不禁水,口服泻药(复方聚乙二醇电解质散)清洁肠道;②充盈肠道:扫描前1 h,每隔15 min 口服2.5%等渗甘露醇溶液400~500 mL,总量1 600~2 000 mL;建议最后1 次口服等渗甘露醇溶液后10~15 min 再进行CT 扫描,有助于捕获左上腹空肠充盈像;③建议采用2.5%等渗甘露醇溶液进行直肠灌肠,剂量为300~500 mL。
CTE 检查方法[14]:建议采用64 层及以上螺旋CT 设备以螺旋方式进行薄层扫描,扫描范围包括全腹+盆腔。管电压为120 kV,管电流为250 mA,扫描层厚和间隔为0.50~0.625 mm,图像重建层厚和间隔为1 mm。先行CT 平扫,注射对比剂后32~35 s 及65~70 s 行动脉期、静脉期扫描。建议使用含碘350或370 mg/mL 的高浓度对比剂,注射总量为1.5~2.0 mL/kg 体质量,注射流率3~4 mL/s。对于完全性肠梗阻病人,无需口服对比剂,可直接进行CT 检查。采用不同的窗宽、窗位观察影像以利于显示肠壁、肠系膜和肠腔、腹腔内气体。对于CT 图像的后处理,以多平面重组为主,辅以最大密度投影、曲面重组及容积再现技术。
5 小肠淋巴瘤CTE 表现
PSIL 表现多样,主要累及黏膜下层,在黏膜下浸润形成息肉或结节状肿块,或黏膜下弥漫浸润使肠壁增厚。当肿瘤较大时,向肠腔内表面侵犯,可表现有多发浅表溃疡,向肠腔外浸润时可累及肌层和浆膜层[15]。部分肿块较为柔软,主要是由于植物神经丛和肌层组织的弥漫破坏但较少或不引起结缔组织反应,使病变小肠壁张力减弱及顺应性下降,扩张的肠管呈“动脉瘤样”改变[16-17]。肿瘤较少出现坏死及出血,可有区域淋巴结受累肿大。CT 表现可为以某一种形态为主,同时也可伴有另一种或多种形态的表现,见表1。

表1 PSIL 影像表现
5.1 肿瘤沿肠壁浸润 肿瘤可同时浸润小肠黏膜下层和固有肌层,沿肠壁蔓延使肠壁明显增厚。表现为肠管管壁呈较长节段、对称或稍不对称环形增厚,平扫呈等密度,增强呈较均匀、轻度至中度强化(图2),可伴有腹膜后淋巴结肿大。在肠腔内对比剂的衬托下,正常小肠黏膜皱襞消失,正常与异常组织间常无明确分界。此类型肿瘤可向浆膜外侵犯,邻近肠系膜血管分支可被包绕;部分肿瘤因破坏肠壁内神经丛,引起肠蠕动消失,肠壁虽有明显增厚,但病变管腔可无狭窄,甚至出现明显增宽,约30%的病例管腔扩张可超过4 cm,这一现象被称为“动脉瘤样扩张”[18](图3)。受累的肠腔也可出现狭窄,肠管可有不同程度变形,由于肠壁张力减弱,肠管较为柔软,较少引起肠梗阻。
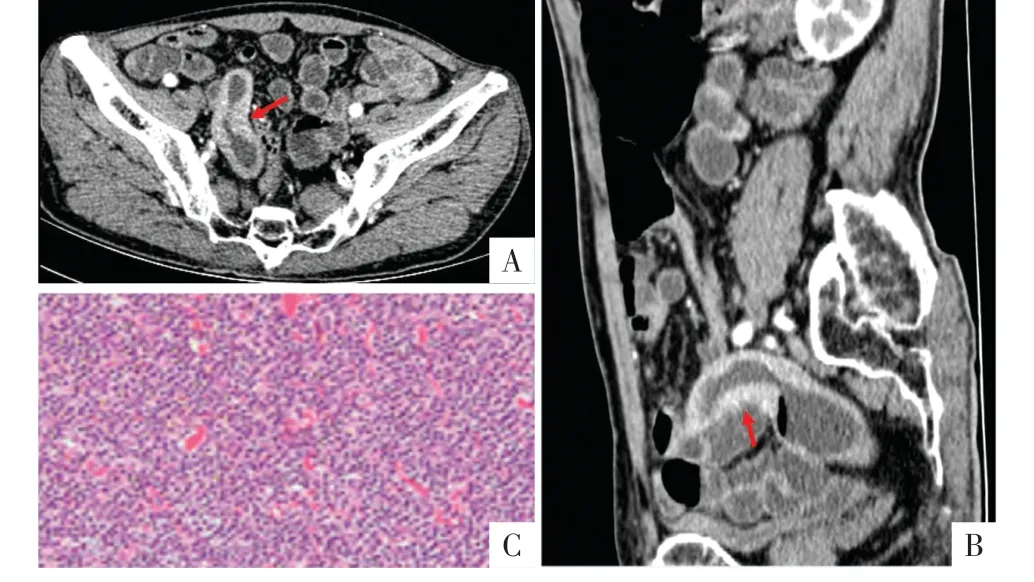
图2 病人男,78 岁,便秘2 个月。小肠黏膜相关淋巴组织结外边缘区淋巴瘤。A、B 图分别为CTE 增强扫描横断面、矢状面影像,显示盆腔内回肠可见节段性、稍不规则管壁增厚,管腔无明显狭窄;增强扫描呈均匀、中度强化(箭头)。C 图为病理图,镜下见单核样小B 淋巴细胞弥漫生长,免疫组化显示CD20(+),CD3(-),Ki67[低增殖指数(LI):5%](HE,×20)。
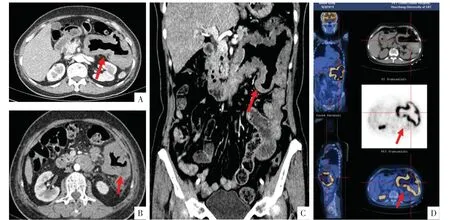
图3 病人女,62 岁,腹痛3 月余。小肠T 细胞淋巴瘤。A、B 图为小肠CTE 增强扫描横断面影像,C 图为冠状面影像,均显示近段空肠管壁增厚,向外浸润、穿孔,与结肠脾区分界不清(箭头),受累肠段呈“动脉瘤样扩张”。D 图为PET/CT,显示病变肠段代谢异常,标准摄取值(SUV)值明显升高(箭头)。
5.2 肿瘤呈肿块样生长 表现为黏膜或黏膜下单个或多个、大小不等的息肉或结节状肠壁肿块影,突向小肠腔内,密度较均匀,增强扫描呈较均匀的轻-中度强化(图4)。肿瘤为滤泡膜细胞来源时,可引起淋巴瘤性息肉病。较大的肠壁肿块可致肠套叠、肠梗阻,但不多见。发生肠套叠时,可见肠壁分层,肠壁密度减低,增强检查强化相对较弱(图5)。
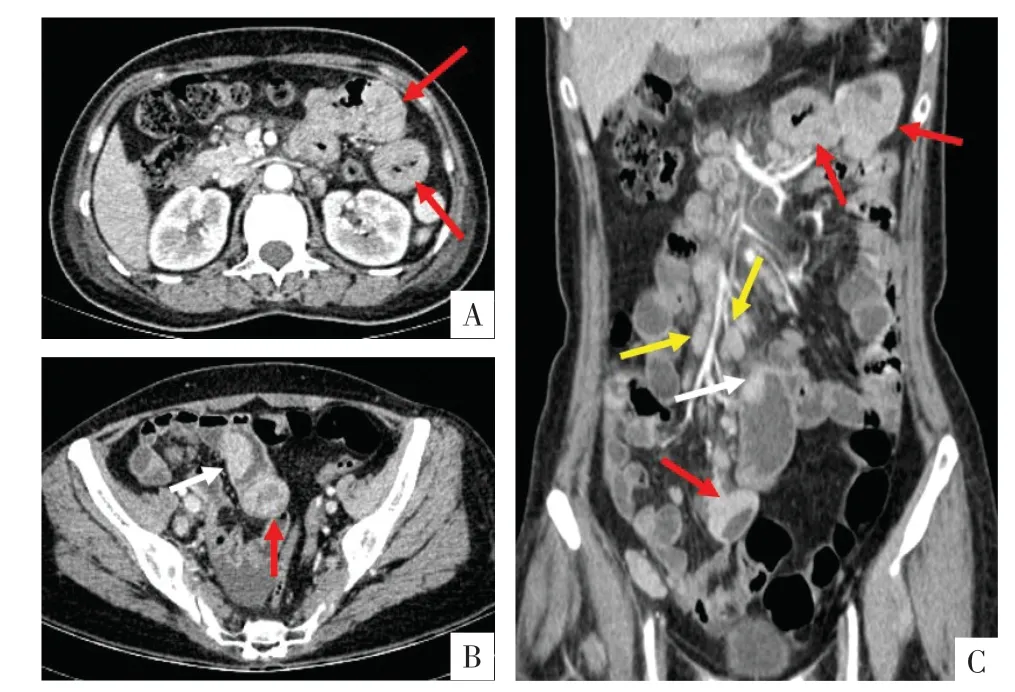
图4 病人女,50 岁,右腹疼痛1 月余,黑便1 周。ALK 阳性的间变性大细胞淋巴瘤。A、B 图为CTE 增强扫描横断面影像,C 图为冠状面影像,显示空肠及回肠多节段肠壁增厚并异常强化(红箭头),肠腔内可见结节状软组织肿块(白箭头),肠系膜间、腹膜后多发淋巴结肿大并均匀强化(黄箭头)。
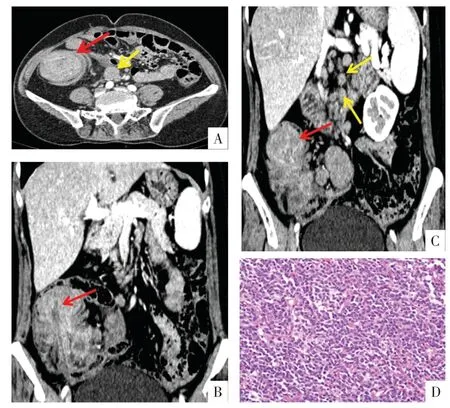
图5 病人女,54 岁,间断左下腹疼痛半个月。(回盲部)母细胞性套细胞淋巴瘤。A 图为CT 增强扫描横断面影像,B、C 图为冠状面影像,显示右下腹回盲部见软组织团块影,远端回肠及其系膜套入盲肠(红箭头),病变呈“同心圆”或“靶环状”表现(A,红箭头);病灶周围肠系膜浑浊,腹膜后多发淋巴结肿大(黄箭头)。D 图为病理图,镜下可见具有母细胞样形态的中等偏大细胞弥漫生长,免疫组化显示CD20(+),CD3(-),Ki67(LI:80%)。
5.3 肿瘤向腔外生长 肿瘤浸润肠壁浆膜层,向外生长可穿透肠壁。较大的病灶因缺乏间质的支持可导致肠壁缺血、坏死和穿孔[19],可累及邻近肠段,与邻近肠袢形成瘘管。同时,相邻的病变肠段彼此融合可呈相通的扩大肠腔和/或大的团块,形成巨大“空洞性”病变(图6),肿块表面可形成溃疡。当肿瘤浸润全层肠壁或向外生长时,会增加化疗时穿孔的风险[20]。
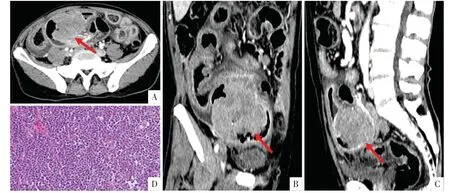
图6 病人男,54 岁,下腹部疼痛3 月余,伴腹胀。(小肠)弥漫大B 细胞淋巴瘤,肿瘤穿透肠壁肌层及浆膜层。A-C 图分别为CT 增强扫描动脉期横断面影像、斜冠状面影像、矢状面影像,显示右下腹见一巨大软组织团块影(箭头),密度不均匀,邻近小肠管壁增厚,周围脂肪间隙浑浊。D 图为病理图,显示弥漫一致的大细胞于小肠肠壁内弥漫浸润生长,免疫组化显示CD20(+),CD3(-),Ki67(LI:约90%)。
5.4 肿瘤累及肠系膜和淋巴结 肿瘤穿透肠壁可沿着肠系膜浸润、蔓延,可见肠系膜脂肪浑浊、密度升高,系膜增厚和条索状影;还可见肠系膜、腹膜后不同程度的淋巴结肿大,肿大的淋巴结密度较均匀,增强扫描呈轻-中度强化。多发、增大的淋巴结可包绕肠系膜血管排列成串状,呈“三明治”征[13,17](图7)。淋巴结肿大明显或巨大时,可推移、压迫、阻塞小肠袢,甚至引起肠梗阻。
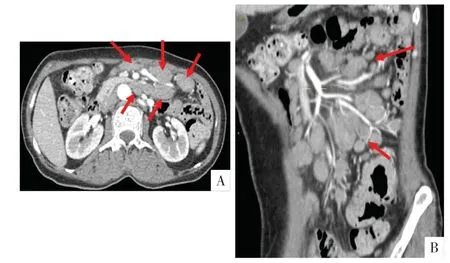
图7 病人女,65 岁。小肠淋巴瘤伴多发淋巴结肿大。A 图,腹部增强CT 横断面影像显示多发、明显肿大的淋巴结沿着肠系膜上血管及其分支在腹侧及背侧排列(箭头),呈“三明治”样表现。B 图,腹部增强CT 斜矢状面影像显示多发、明显肿大的淋巴结沿着肠系膜上血管及其分支呈串状排列(箭头),回肠壁增厚,邻近肠系膜脂肪间隙浑浊。
5.5 混合表现 小肠淋巴瘤通常是多节段的病变,上述影像学表现可以是2 种或多种形式混合存在,在影像诊断时应注意观察分析。
6 小结
PSIL 发病率低,主要CT 表现为肠壁呈节段性或弥漫性对称性增厚,以回肠远段多见,可多段发生;虽有肠壁增厚,但肠腔狭窄不明显,部分病人小肠壁扩张,甚至呈动脉瘤样扩张(主要是由于肿瘤取代了肠壁的固有肌层并破坏了其间植物神经丛)。PSIL 还可表现为单发或多发的息肉状或结节状肠壁肿块,向腔内或腔外生长,常伴有肠系膜、腹膜后淋巴结明显增大。肿块和肿大的淋巴结密度较均匀,增强扫描呈均匀的轻、中度强化。该病较少并发肠套叠、肠梗阻,但也不能除外。
CTE 检查的成功是发现病变与正确诊断的前提,三维多方位和仔细观察是正确诊断的保障,PET/CT 明显高代谢对小肠淋巴瘤有较好的辅助诊断价值,淋巴瘤的诊断应综合分析影像学征象、临床表现等资料,但最终确诊与亚型分型仍依赖病理学及免疫组化检查。

