肠道病毒感染致神经损伤小鼠脑组织NOD样受体蛋白3的表达
张梦娣,梁若楠,纪望全,张 雪,陈 晨,闫玉洁,张楚雯,朱培育,李 栋,陈帅印,杨海燕,段广才,晋乐飞
郑州大学公共卫生学院流行病学教研室 郑州 450001
手足口病(hand,foot,and mouth disease,HFMD)是由肠道病毒(enterovirus,EV)感染引起的急性传染病,5岁以下婴幼儿普遍易感,具有自限性。HFMD一般临床表现为发热,手、足、口等部位散发性皮疹和疱疹,部分病例可发展为严重中枢神经系统并发症,如脑炎、脑干脑炎、急性弛缓性麻痹等[1-3]。EV属于单股正链RNA的小核糖核酸病毒,可以通过内吞作用感染宿主细胞并释放RNA[4],进而激活机体固有免疫。多种免疫细胞和细胞因子参与EV感染诱导的免疫应答,过度的免疫应答与HFMD的发生发展紧密相关[5-7]。HeLa细胞感染EV71后,促炎因子IL-1β和IL-18的表达和分泌增加[8]。研究[9]发现,Caspase-1抑制剂可减少EV71在小鼠大脑中的复制。阻断IL-1β可以预防EV感染引起的慢性炎症[10]。临床研究[11]证实,脑炎患儿血清IL-1β水平显著升高。NOD样受体是固有免疫的重要组成部分,它可以识别病毒RNA。NOD样受体家族成员与炎性小体介导的固有免疫密切相关,NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)是目前研究较为清楚的炎性小体[12]。NLRP3通过凋亡相关微粒蛋白募集pro-Caspase-1形成炎性小体,pro-Caspase-1聚集后通过自我剪切产生活化的Caspase-1,后者对pro-IL-1β和pro-IL-18进行剪切,最终形成活化的IL-1β和IL-18,这些促炎因子分泌到细胞外,诱发一系列炎症反应[13]。研究[14]表明NLRP3炎性小体功能失调与神经系统损伤有关,如神经退行性疾病等。然而,NLRP3炎性小体在EV感染诱发的神经系统损伤中的作用尚不清楚。本研究利用HFMD的常见病原体EV71和相对少见病原体柯萨奇病毒A组2型(coxsackievirus A2,CVA2)感染小鼠,检测小鼠脑组织中NLRP3、Caspase-1、IL-1β和IL-18的转录和表达,探讨NLRP3在EV感染致神经系统损伤中的作用,有助于揭示HFMD神经系统损伤的机制。
1 材料与方法
1.1 主要试剂与仪器胎牛血清和DMEM培养基(美国Gibco公司),异氟烷(深圳市瑞沃德生命科技有限公司),Trizol (美国Invitrogen公司);mRNA反转试剂盒和qPCR SYBR Master Mix(上海翌圣生物科技有限公司),PMSF及RIPA组织裂解液(北京索莱宝生物科技有限公司),BCA试剂盒(博迈德生物技术有限公司);β-actin、Caspase-1、NLRP3 、IL-1β 一抗(美国Cell Signaling Technology公司),山羊抗兔IgG二抗(武汉三鹰生物公司);VP1一抗、FITC/Cy3双标荧光二抗(武汉塞维尔公司)。Olympus IX73 倒置显微镜 (日本Olympus公司)、WB电泳仪(美国Bio-Rad公司)、Leica TCS SP8激光共聚焦显微镜(德国Leica公司)、ECL化学发光成系统(美国GE公司)、荧光定量PCR仪(北京酷搏科技有限公司)。
1.2 细胞和病毒使用人横纹肌肉瘤(human rhabdomyosarcoma,RD)细胞富集病毒,细胞株购自中国科学院典型培养物保藏委员会细胞库,用含体积分数10%胎牛血清的DMEM培养基培养。EV71毒株(ZZ1350,序列号KY886010.1)分离自郑州市儿童医院1例重症HFMD患儿的粪便标本,CVA2毒株(HN202009,序列号MT992622)分离自新乡医学院第一附属医院1例重症HFMD患者的粪便标本。使用单层RD细胞检测并计算病毒滴度[15-16],感染滴度以空斑形成单位(plaque forming unit,pfu)表示。
1.3 实验动物与分组SPF级5日龄BALB/c小鼠30只购自河南省医学实验动物中心,实验动物生产许可证号:SCXK(京)2016-0009,常规饲养于郑州大学公共卫生学院动物房。光照循环条件为 12 h明/12 h暗,温度20~24 ℃,湿度40%~60%。30只小鼠分为EV71组、CVA2组和对照组,每组10只。基于课题组前期的研究[17],EV71组和CVA2组小鼠分别以4×106和7×103个pfu的感染滴度经腹腔、肌内注射EV71和CVA2,对照组小鼠腹腔注射等体积的RD 细胞培养上清。感染后观察小鼠并记录临床症状和生存情况。
1.4 脑组织病理学和免疫荧光共定位检测感染后第7天,采取异氟烷吸入法对3组小鼠实施安乐死,每组取4只小鼠的脑组织,40 g/L多聚甲醛固定并进行石蜡包埋、5 μm厚切片,通过HE和尼氏染色观察脑组织病理学改变。免疫荧光双标染色标记NLRP3和EV71/CVA2 VP1蛋白的表达,严格按照说明书步骤进行操作。
1.5 脑组织中NLRP3、Caspase-1、IL-1β、 IL-18 mRNA的qRT-PCR检测感染后第7天,每组取3只小鼠的脑组织,采用Trizol法提取总RNA,合成cDNA。使用qRT-PCR 法检测NLRP3、Caspase-1、IL-1β、 IL-18的mRNA表达水平,引物序列和产物大小见表1。反应体系:Hieff qPCR SYBR Green Master Mix 10 μL、10 mol/L上下游引物各0.4 μL、模板cDNA 2 μL,加ddH2O 至20 μL。反应条件:预变性90 ℃ 30 s;变性95 ℃ 15 s,退火60 ℃ 30 s,40个循环。以β-actin为内参,使用2-ΔΔCt法[18]进行相对定量。
1.6 脑组织NLRP3、Caspase-1和IL-1β 蛋白的Western blot检测感染后第7天,每组取3只小鼠脑组织,使用含有蛋白酶抑制剂PMSF及磷酸酶抑制剂的RIPA组织裂解液提取总蛋白,用BCA试剂盒测定总蛋白浓度,100 g/L SDS-PAGE电泳,转移蛋白到PVDF膜上,使用50 g/L脱脂奶粉室温封闭1 h后加一抗(NLRP3、Caspase-1、 IL-1β均按照1∶1 000稀释)孵育,4 ℃过夜,洗膜3次,加二抗(按照1∶3 000稀释)室温孵育1 h,洗膜3次,使用ECL增强化学发光试剂盒显影。应用Image J软件分析。以目的蛋白与内参β-actin条带灰度值的比值作为目的蛋白的相对表达量。

表1 引物序列和产物大小
1.7 统计学处理应用SPSS 21.0进行分析。3组小鼠脑组织中 NLRP3、Caspase-1、IL-1β、 IL-18 mRNA和NLRP3、Caspase-1和IL-1β 蛋白表达的比较采用单因素方差分析和SNK-q检验。检验水准α=0.05。
2 结果
2.1 EV71和CVA2感染小鼠动物模型接种EV71和CVA2的小鼠均在第2天开始精神萎靡、活动减少,随着感染时间的延长,以上症状加重,逐渐出现共济失调、嗜睡、抽搐、后肢瘫痪等症状,且体重明显下降;EV71组小鼠在感染后3~8 d内全部死亡,CVA2组小鼠在感染后4~9 d内全部死亡。本研究成功构建了EV71和CVA2感染动物模型,模拟出与人类疾病相似的神经系统症状。
2.2 3组小鼠脑组织神经元病变与对照组比较,CVA2组和EV71组小鼠脑组织出现血管袖套现象和大范围的炎细胞浸润,同时胶质细胞增生形成胶质结节,噬神经细胞现象明显(图1)。对照组小鼠脑组织尼氏小体呈正常微粒状或虎斑状,且神经元排列整齐、边界清晰、颜色深蓝;而CVA2组和EV71组小鼠的脑组织尼氏小体排列紊乱、颜色浅,有明显的溶解、变性和碎片化改变(图2)。
2.3 NLRP3与EV71、CVA2病毒在小鼠脑组织的共定位与对照组比较,EV71组和CVA2组小鼠脑组织NLRP3的表达均明显增加,并且可以检测到病毒VP1抗原的阳性信号。EV71组可见EV71(绿色)与NLRP3(红色)的共定位细胞;CVA2组可见CVA2(红色)与NLRP3(绿色)的共定位细胞(图3)。
2.4 3组小鼠脑组织NLRP3、Caspase-1、IL-1β、 IL-18 mRNA的表达结果见表2。与对照组比较,CVA2组和EV71组小鼠脑组织中Casepase-1、NLRP3、IL-1β以及IL-18 mRNA的表达升高。
2.5 3组小鼠脑组织 NLRP3、Caspase-1和IL-1β 蛋白的表达结果见表3。与对照组比较,EV71组和CVA2组小鼠脑组织中NLRP3、Caspase-1和IL-1β 蛋白的表达升高。
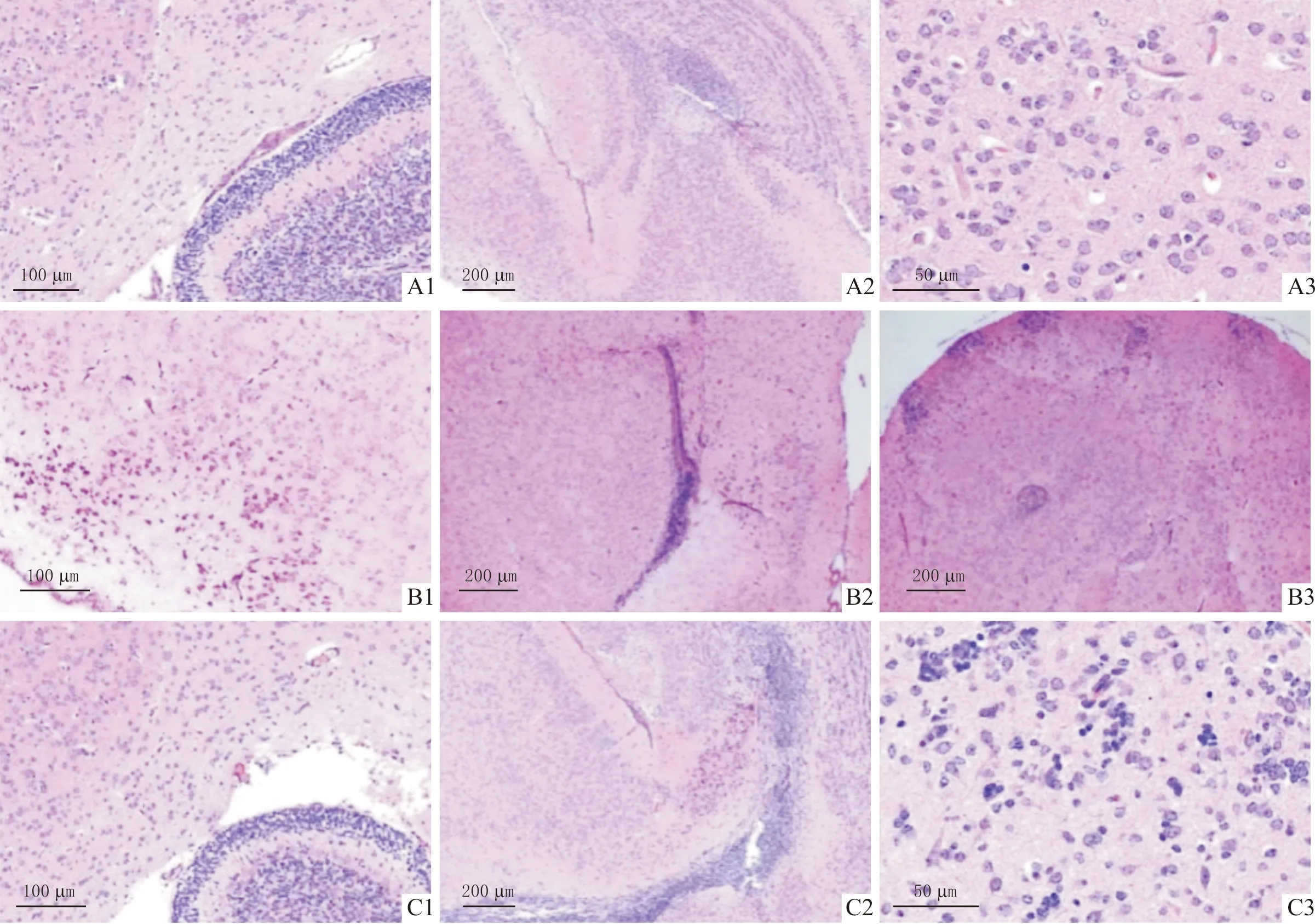
A、B、C:分别为对照组、CVA2组、EV71组;1~3:不同视野
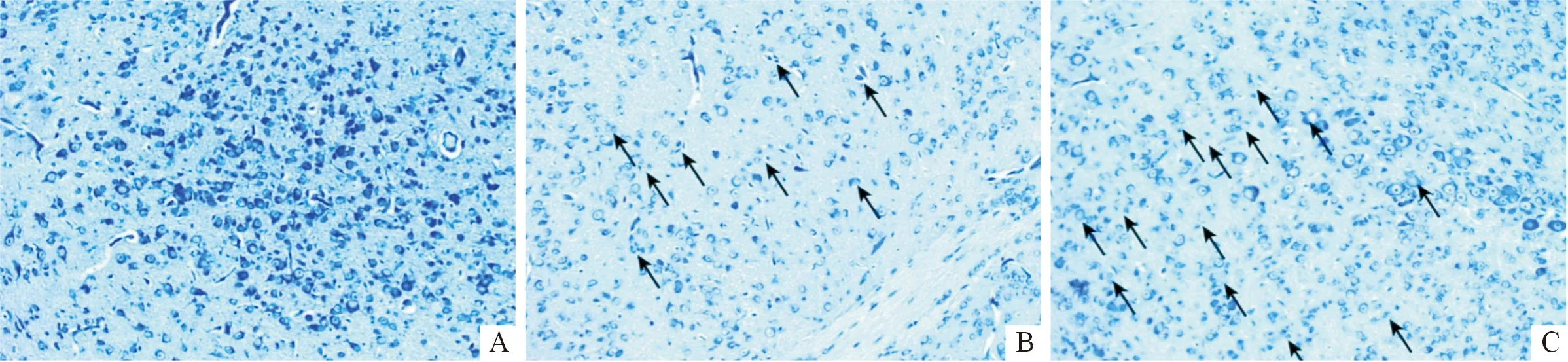
A、B、C:分别为对照组、CVA2组、EV71组;箭头示尼氏小体溶解、碎片化
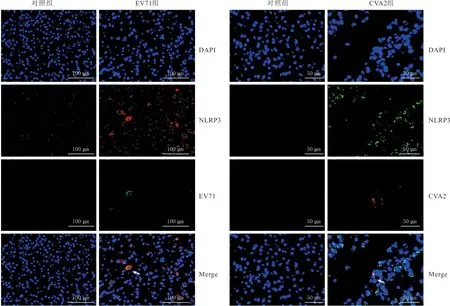
左图:红色表示NLRP3,绿色表示EV71抗原; 右图:绿色表示NLRP3,红色表示CVA2抗原;白色箭头示病毒与NLRP3的共定位
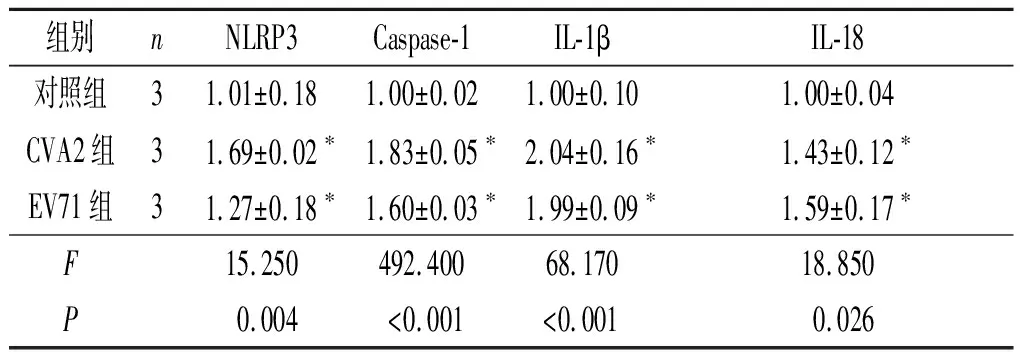
表2 3组小鼠脑组织 NLRP3、Caspase-1、IL-1β、 IL-18 mRNA的表达
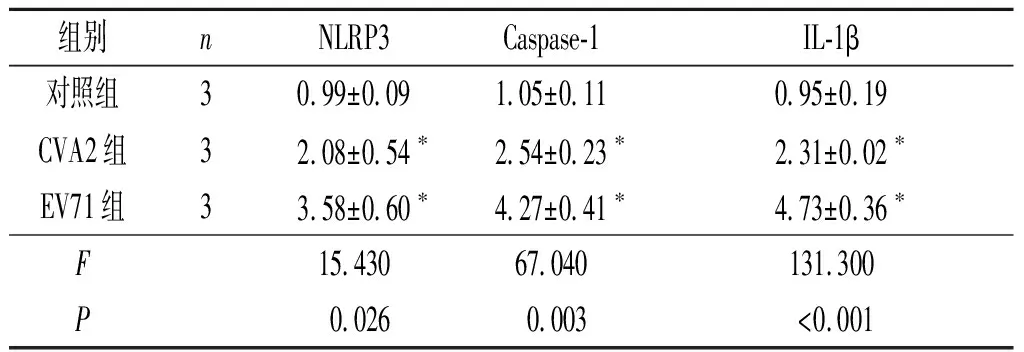
表3 3组小鼠脑组织NLRP3、Caspase-1和IL-1β 蛋白的表达
3 讨论
EV感染引起的HFMD是我国严重的公共卫生问题之一,部分可发展为重症,出现脑炎、脑膜炎等神经系统并发症[4]。研究[19-20]表明,EV71感染可直接对神经系统造成损伤,另外过度的炎症反应也参与EV71感染引起的神经系统损伤[5]。本研究结果显示,EV71和CVA2感染小鼠脑组织出现炎细胞浸润、噬神经细胞现象以及尼氏小体病变,表明EV71和CVA2感染均引起不同程度的神经系统损伤。免疫荧光共定位结果显示EV71及CVA2均可感染神经系统,NLRP3可能参与EV71和CVA2感染所致的神经系统损伤。
越来越多的研究[21]认为多种免疫细胞、炎症因子参与HFMD的发展,例如伴有严重并发症的HFMD患者血浆中IL-1β水平显著升高。NLRP3炎性小体的激活是调节IL-1β分泌的关键[13]。已有研究[22]表明,NLRP3参与了柯萨奇B3病毒(coxsackievirus B3,CVB3)诱导的心肌损伤;EV71感染早期,NLRP3炎性小体通过启动有效的炎症反应来控制EV71的增殖,EV71的蛋白酶2A和3C也可与NLRP3相互作用[23]。有研究[22]发现,抑制NLRP3可减轻CVB3感染后症状。也有报道[24]称NLRP3炎性小体对CVB3感染小鼠有保护作用。IL-1β是机体内IL-1表达的活性形式,可以激活免疫细胞,引起细胞毒性作用,也可以促进炎症细胞聚集参加炎症反应;IL-18属于IL-1超家族,两者都可以促进炎症反应[25]。本研究结果显示CVA2组和EV71组小鼠脑组织中Caspase-1、NLRP3、IL-1β以及IL-18 mRNA和NLRP3、Caspase-1和IL-1β 蛋白表达水平均升高,提示EV71和CVA2感染诱导脑组织NLRP3激活,NLRP3可能在EV71和CVA2引起的神经系统损伤中发挥重要作用。
NLRP3是机体天然免疫反应的重要组成部分,作为一种模式识别受体可有效地调节天然免疫应答[26]。本研究结果显示EV71组和CVA2组小鼠脑组织NLRP3的表达升高,并且观察到了NLRP3与病毒VP1的共定位。以上结果表明,EV71和CVA2均可感染神经系统并且诱导NLRP3炎性小体的活化,EV71和CVA2诱导小鼠脑组织NLRP3活化的机制有待进一步研究。
综上所述,NLRP3炎性小体的活化可能参与EV71和CVA2感染所致的神经系统损伤。

