ABCC2基因单核苷酸多态性对食管鳞癌术后患者无病生存期的影响
曹放,孙志伟,史幼梧,孙婧,杜丰,肖艳洁,余靖,贾军,杨颖△
食管癌是严重威胁人类健康和生命的疾病。最新统计数据显示,2015 年我国新发食管癌47.79 万例,死亡37.5 万例,位列癌症发病第3 位,死亡第4位[1]。鳞状细胞癌是食管癌主要的病理组织学类型,约占全部食管癌的90%[2]。食管鳞状细胞癌预后较差,5年生存率不足20%[1-2]。目前多采用手术、放疗、系统治疗(如化疗及免疫治疗等)、介入治疗以及射频消融等多种治疗手段,以期改善患者的生活质量,延长生存期。尽管外科技术不断进步,且新辅助化疗、辅助化疗及围手术期放化疗等围手术期治疗方式日益完善,术后仍有28%~74%的患者复发[3]。探索术后患者复发的相关因素,可以为患者个体化治疗,改善预后提供一定的依据。
一直以来,基因突变和基因多态性都是探索个体化治疗和精准医疗的热点。单核苷酸多态性(single nucleotide polymorphism,SNP)是常见的基因变异形式,可能与癌症的发生、发展及预后相关,是个体罹患疾病及生存差异的基础。食管鳞癌患者的围手术期治疗多以紫杉醇为主。结合临床实践需要,参考已发表的研究结果,本研究以紫杉醇药代动力学通路为基础[4],探讨ATP 结合盒亚家族(ATP binding cassette subfamily,ABC)B 成员1(ABCB1)、ABCG2、ABCC1 及ABCC2 这4 个基因的SNP 对食管鳞癌患者术后无病生存期的影响,旨在为手术患者提供新的生物标志物以评估预后,并根据不同的复发风险进行个体化管理与治疗。
1 对象与方法
1.1 研究对象 收集2010年9月—2018年12月北京大学肿瘤医院肿瘤内科VIP2 病区收治的227例食管鳞癌患者。排除晚期、未接受手术、未接受围手术期治疗或围手术期未接受紫杉醇治疗的患者,最终纳入77例围手术期接受紫杉醇治疗的食管鳞癌根治术患者作为研究对象。鳞癌的诊断以术后的病理诊断为准。所有患者均签署书面知情同意书,同意出于科学研究的目的,对其生物学样本进行检测并采集其医疗记录进行分析。本研究得到了北京大学肿瘤医院伦理委员会的批准(伦理批件号2016KT91)。
1.2 研究方法
1.2.1 研究设计及SNP选择 本研究为预后研究,研究设计为回顾性队列研究。采集患者静脉血并保存在-92 ℃冰箱中。研究选择的SNP 均来自美国国家生物技术信息中心SNP 数据库(National Center for Biotechnology Information SNP database),符合以下条件的SNP最终被纳入研究:(1)中国人群中次要等位基因频率(minor allele frequency,MAF)≥20%。(2)基因分型检出率(genotying call rate)≥95%。(3)基因连锁不平衡系数r2<0.8。(4)优先选择位于基因转录区域的错义SNP,即基因外显子区域,其次选择同义SNP,最后是内含子SNP。最终7个SNP被确定为研究对象,即ABCB1 rs1045642、rs2032582、rs3213619,ABCG2 rs2231137、rs2231142,ABCC1 rs246221和ABCC2 rs3740066,见表1。
根据人群中基因分布频率的不同,等位基因分为主要型(A)和次要型(a);基因型分为主要等位基因纯合型(AA)、杂合型(Aa)和次要等位基因纯合型(aa)。Aa、aa 分别与AA 比较的方法,称为基因加性模型;将杂合型及次要等位基因纯合型之和(Aa+aa)与AA 比较的方法,称为基因显性模型;将aa与AA+Aa比较的方法,称为基因隐性模型。
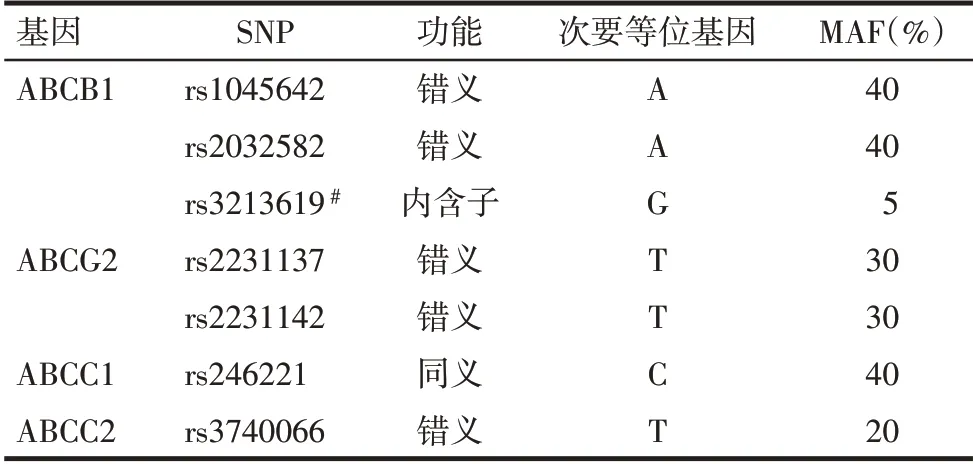
Tab.1 Characteristics of selected single nucleotide polymorphisms表1 纳入研究的单核苷酸多态性的特征
1.2.2 基因测序分型 采用MassARRAYTMMaldi-tof 系统(Sequenom,Inc.)进行SNP基因测序分型。采用MassARRAYTMAssay Design 软件设计聚合酶链反应(PCR)扩增的引物和单碱基延伸引物(表2),采用MassARRAYTMCompac 分析仪进行质谱检测。约5%的样本行重复检测用于质量控制。

Tab.2 Primer sequence of selected single nucleotide polymorphisms表2 单核苷酸多态性基因测序的引物序列
1.2.3 收集指标 收集患者年龄、性别、吸烟史、饮酒史、食管病变位置以及是否为多原发病变等信息。无病生存期(disease-free survival,DFS)是指从根治术后到第一次复发或因任何原因导致死亡之间的时间。复发的确认以影像学诊断结合临床实际为准。对复发患者的随访以门诊访视为主,同时结合电话及微信随访,所有复发的影像学报告均以纸质版形式存档。
1.3 统计学方法 所有统计分析均采用SAS v9.4 软件(SAS Institute Inc.,Cary,NC)进行。分别以遗传加性模型、显性模型和隐性模型进行SNP分析。首先应用比例风险回归模型,即Cox回归模型评估遗传变异对无病生存的影响,然后校正年龄和性别行进一步分析。研究结果以粗风险比(crude hazard ratio,cHR)、校正风险比(adjusted HR,aHR)及其95%置信区间(CI)表示。多次检验和小样本量可能导致研究结果假阳性,本研究采用半贝叶斯收缩方法(semi-Bayesian Shrinkage)进行调整和验证[5]。由于缺乏生物机制研究,且流行病学证据有限,因此先验系数选择均值0、方差1.92的正态分布,即指数化后先验HR=1.000,先验95%CI为0.250~4.000。
2 结果
2.1 一般临床特征 在本研究中,77例食管鳞癌术后患者年龄59(54,62)岁,男62例(80.5%)。52例(67.5%)有吸烟史,51例(66.2%)有饮酒史。10例(13.0%)为多原发病变,其余67例单发病灶患者中,3例(4.5%)位于食管胸上段,13例(19.4%)位于胸中段,51例(76.1%)位于胸下段。所有患者均接受了一种甚至多种围手术期治疗,包括新辅助治疗38例(49.4%),辅助化疗31例(40.3%),辅助放化疗22例(28.6%)。术后64例(83.1%)患者复发,13例患者无复发(16.9%),中位DFS为368(194,776)d。
2.2 临床特征对DFS的影响 将患者年龄(连续变量)、性别(男=0,女=1)、吸烟史(无=0,有=1)、饮酒史(无=0,有=1)、食管病变位置(胸下段=0,胸上中段=1)以及是否为多原发病变(否=0,是=1)等信息与SNP(加性模型:野生型=0,杂合型=1,纯合型=2;显性模型:野生型=0,其他=1;隐性模型:纯合型=1,其他=0)作为自变量纳入研究,以是否复发(无复发=0,复发或因任何原因导致死亡=1)为因变量,进行Cox 回归分析。结果显示,未发现性别、年龄、肿瘤位置及吸烟、饮酒史等与DFS有关,见表3。
2.3 SNP 对DFS 的影响分析 在显性基因模型下,ABCC2 rs3740066的次要等位基因与DFS缩短有关。在校正性别和年龄后,该关联仍有统计学意义[cHR(95%CI)=4.623(1.111~19.241),P=0.035;aHR(95%CI)=4.290(1.010~18.215),P=0.048],即 含ABCC2 rs3740066 的次要等位基因T 的患者复发危险较野生型提高3倍以上。其他基因的SNP在各个基因模型下,以及ABCC2 rs3740066 在其他基因模型下,均未发现有统计学意义的关联性。见表4。
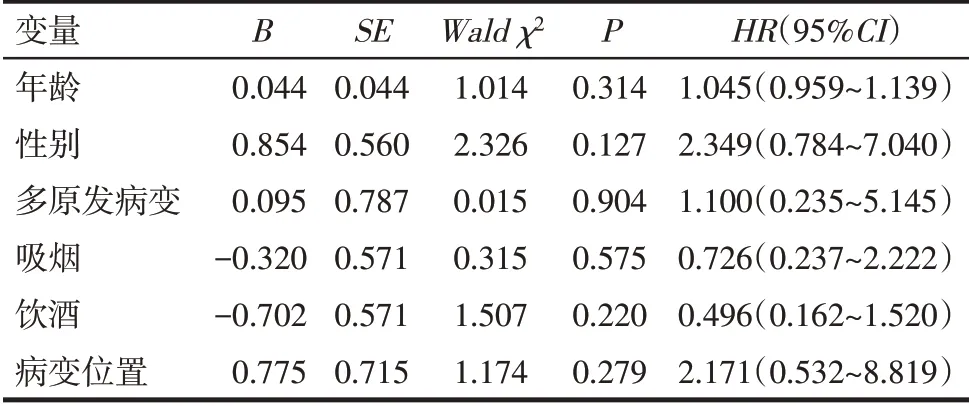
Tab.3 Analysis of the influence of clinical characteristics on disease-free survival表3 临床特征对无病生存期的影响分析
2.4 潜在假阳性结果的校正 多次检验和小样本量可能导致假阳性结果,本研究采用半贝叶斯收缩对病例进行校正,在采用先验假设[先验HR=1.000,95%CI:0.250~4.000)]的前提下,经半贝叶斯收缩,在显性模型下,与ABCC2 rs3740066野生基因型(CC型)比较,含次要等位基因T的基因型semi-BayesiancHR(95%CI)=2.171(0.828~5.692),P=0.115;semi-BayesianaHR(95%CI)=2.070(0.786~5.457),P=0.141。关联差异无统计学意义。
3 讨论
本研究探索了药代动力学相关基因多态性对食管鳞癌术后DFS的影响,结果显示,在食管鳞癌根治术后的患者中,显性基因模型下ABCC2 rs3740066含次要等位基因的基因型与DFS 缩短有关,而未发现临床因素,如性别、年龄、烟酒史以及食管原发肿瘤位置及数量等与DFS有关。
3.1 ABC 转运蛋白家族与恶性肿瘤 在药物代谢中,ABC转运蛋白家族起到重要的作用,作为主动外排泵,其成员主动地将各种物质,包括氨基酸、多糖、肽、脂质、药物和毒素转运出细胞外。根据ATP结合域氨基酸序列的不同,ABC 转运蛋白家族可分为7个亚型,即ABCA~G,包括ABCB1(也称为多药耐药-1,MDR1)、ABCG2(乳腺癌耐药蛋白,BCRP)以及ABCC2(多药耐药相关蛋白-2,MRP2)等,均在多药耐药中发挥着重要的作用[6]。既往研究也多集中在这些基因与药物不良反应及疗效的相关性上[7-8]。另一方面,除药物代谢外,ABC转运体还可作为癌症患者预后的生物标志物。研究证实,在肿瘤干细胞中有多种ABC 转运体,如ABCG2 和ABCC2,这些转运体通过主动外排缺氧条件下产生的细胞毒性代谢物,保护肿瘤干细胞免受缺氧相关细胞损伤,延长肿瘤干细胞的存活期[9]。有文献报道ABC转运蛋白低表达与多种恶性肿瘤,如肝内胆管癌、前列腺癌、头颈鳞癌等患者预后差有关[10-12]。ABCC2 作为ABC转运家族的一员,在药物分布、代谢和清除以及胞外运输中发挥着重要的作用,相较于分化好的肿瘤,ABCC2 在组织学分级高、分化差的肿瘤中表达更高。
3.2 ABCC2 基因多态性与恶性肿瘤 ABCC2 基因的SNP 与肿瘤细胞的药物抵抗、化疗药物清除和相关毒性以及患者预后有关[13]。目前,有关食管鳞癌中该基因多态性与患者复发关系的研究少见,但在胰腺癌、肺癌、乳腺癌、结直肠癌等恶性肿瘤患者中ABCC2 与疗效和预后相关。在胰腺导管腺癌中,ABCC2 基 因 多 态 性 包 括rs3740067、rs3740073、rs717620、rs2273697 等的次要等位基因与患者预后差显著相关[14]。乳腺癌中,纯合子野生型ABCC2 rs717620 可致外排蛋白表达增加,引起他莫昔芬活性代谢物在胞内和血浆水平的有效浓度降低,导致治疗失败和患者术后复发[15]。肺癌中,ABCC2等位基因变异与化疗药物诱导的毒性和生存期有关[16-17]。而在结直肠癌中,ABCC2 的表达与DFS 延长有关[18]。由于人种及肿瘤类型的差异,对于ABCC2 基因多态性的影响,各研究结论不一,但均证实了其在肿瘤中起到了关键的调节作用。本研究中的ABCC2 rs3740066与胰腺癌研究中的rs3740067处于高度连锁不平衡,rs3740066 为错义变异,可能影响ABCC2 的表达与功能。与胰腺癌研究结论相似,本研究发现该SNP 的次要等位基因与预后不良相关。有研究认为ABCC2 影响预后的机制之一是通过活性氧(ROS)的信号活动。ROS是肿瘤细胞存活和转移的关键调控因素,包括侵袭、黏附、血管生成和增殖[19]。手术诱发的炎症反应创造了富含ROS的环境,而ABCC2可能通过转运活性氧影响肿瘤细胞生存,但具体机制以及SNP 在其中发挥的作用仍需生物学实验探索及验证。
3.3 研究的局限性 由于笔者所在内科病区的术后辅助治疗患者较少,加之部分患者拒绝签署知情同意提供血液学样本,故本研究样本量较小,导致检验效能较低,因此可能会遗漏有统计学意义的关联。例如,本研究未发现选择的临床因素,如性别、年龄等与DFS 相关,而既往对临床因素的研究也缺乏统一的结论,因此可能由于临床因素并不影响无病生存,但也可能是由检验效能低所导致。此外,作为回顾性研究,本研究可能会受到如回忆偏倚、混杂偏倚、测量偏倚等的影响,从而影响研究结果。基于定义,需要控制的混杂偏倚指的是“时间上发生在自变量和因变量之前,并能同时影响自变量和因变量的因素”,而SNP作为胚系突变,受混杂因素影响不大,因此本研究仅对性别和年龄做了校正,对围手术期治疗及分期等未行控制。而其他偏倚对作为胚系突变的SNP 及相关研究结论影响则更小。第三,出于对假阳性的顾虑,本研究采用了半贝叶斯收缩,收缩后并未发现有统计学意义的关联。由于缺乏生物机
制研究,且流行病学证据有限,因此本研究选择了先验系数均值0、方差1.92的正态分布,即指数化后先验HR95%CI为1.000(0.250~4.000),该选择是主观的,可能影响研究结论的客观性。综上,虽然经过半贝叶斯收缩,未发现有统计学意义的结果,但并不能够得出“基因多态性与无病生存期不存在关联”的结论;相反,受小样本量及多次检验的影响,以及半贝叶斯结果的提示,强烈建议未来更多的基础研究和大样本研究加以验证。最后,由于缺乏相应的生物学机制研究,因此该研究的结论难以在功能层面上进行解释,也对未来生物机制研究提出了更高的要求。
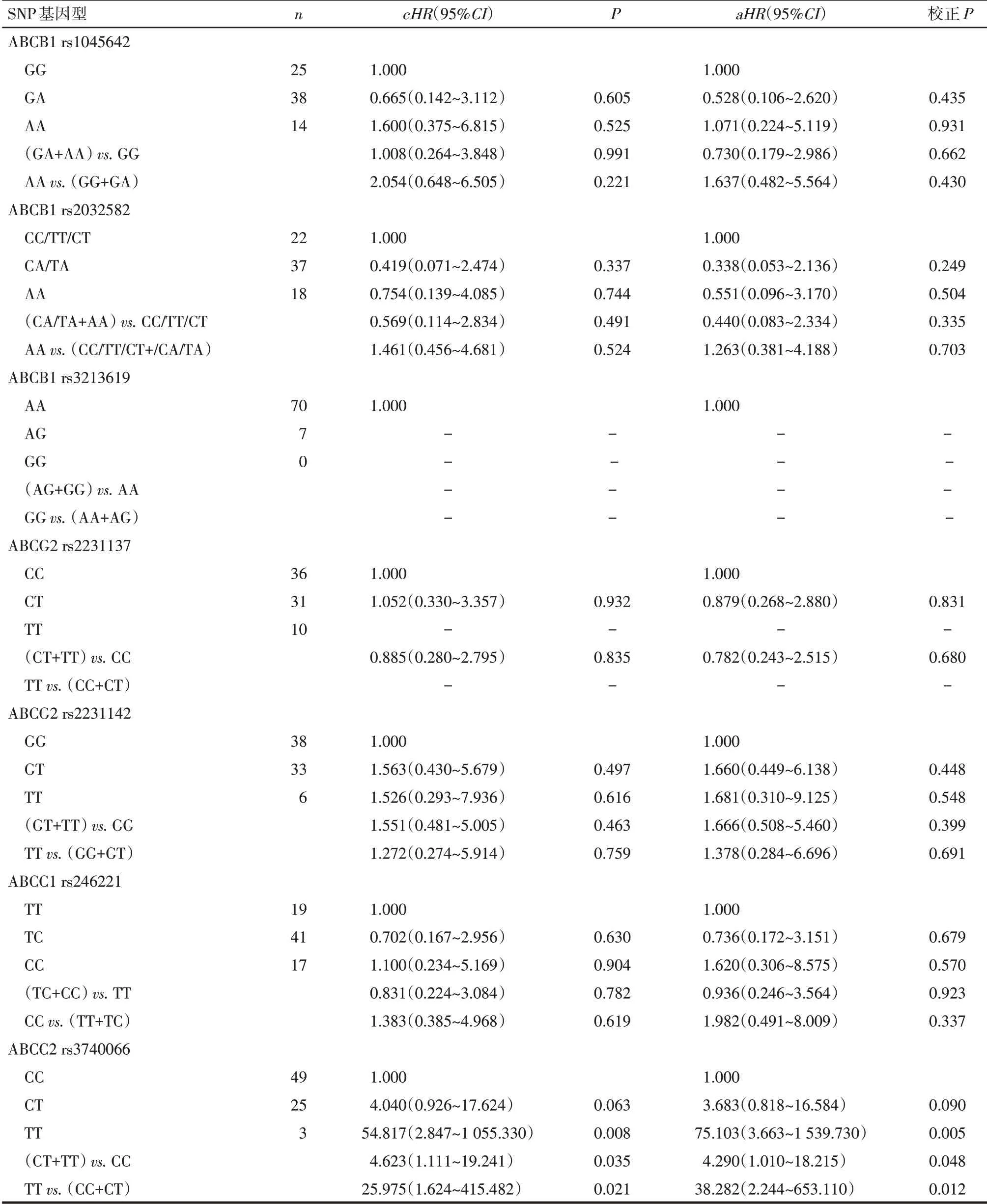
Tab.4 The effect of SNPs on disease free survival表4 SNP对无病生存期的影响分析
综上所述,本研究发现药物代谢动力学基因ABCC2 rs3740066 与食管鳞癌术后患者无病生存相关。但由于缺乏生物学研究,ABCC2 rs3740066 在其中发挥作用的机制尚不清楚,因此在需要更大样本量研究证实的同时,也需要更多的基础实验加以验证。

