皮质前额叶和海马PPAR-α通路参与N-棕榈酰乙醇胺抗大鼠抑郁样行为
李瑞瑞,张露文,张渺,于海玲
抑郁症是一种以显著而持久的情绪低落为临床特征的精神障碍,预计到2030年将成为全球第一大疾病负担[1]。目前,以选择性5-羟色胺再摄取抑制剂为代表的新型抗抑郁药为临床主要用药,但存在起效慢、临床治愈率低、不良反应较多等缺点[2]。内源性大麻素系统由内源性大麻素、内源性大麻素受体及与其合成相关的代谢酶类组成,参与调节情绪、记忆、认知、植物神经系统和自主活动等神经活动进程[3-4]。研究表明,内源性大麻素系统的功能障碍会促进焦虑和抑郁等精神疾病的发生,皮质前额叶(prefrontal cortex,PFC)和海马分泌的内源性大麻素可防止应激诱导的行为改变,产生抗焦虑和抗抑郁作用[5-7]。N-棕榈酰乙醇胺(N-palmitoylethanolamide,PEA)是内源性大麻素类似物,为过氧化物酶体增殖物 激 活α受 体(peroxisome proliferator-activated receptor α,PPARα)的内源性激动剂,具有抗炎、镇痛、神经保护等活性,在抑郁动物模型中已表现出抗抑郁和抗焦虑样作用[8-9]。有研究证明,PEA可改善小鼠的疼痛和认知障碍,而在PPARα基因敲除小鼠中上述作用大多消失[10]。本实验室前期研究发现,PEA可改善海马组织内部分氧化应激因子的异常表达,上调PFC 的突触素表达,使海马和PFC 内PPARα 表达恢复正常,从而减轻大鼠抑郁样行为[9,11]。本研究旨在进一步探究PEA 通过PFC 和海马的PPARα途径发挥抗抑郁作用的可能机制,为抑郁症的治疗提供潜在靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级健康雄性SD 大鼠50 只,体质量180~200 g,购自延边大学实验动物中心,许可证号:SCXK(吉)2017-0003。大鼠自由摄食饮水,在自然光照、室温(23±2)℃、相对湿度(55±5)%的清洁空调室饲养,严格遵循国家《实验动物管理条例》。
1.1.2 实验试剂 PEA(延边大学药学院提供,化学结构式见图1);盐酸氟西汀分散片(百忧解,20 mg∕片,礼来苏州制药);PPARα拮抗剂MK886(上海瀚香生物);鼠源多唾液酸-神经细胞黏附分子(polysialic acid neural cell adhesion molecule,PSA-NCAM)抗体、辣根过氧化物酶标记的山羊抗小鼠IgG二抗(SIGMA);DAB显色试剂盒(北京中杉金桥);脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和核转录因子(nuclear factor,NF)-κB酶联免疫吸附试验(ELISA)检测试剂盒均购于南京森贝伽生物科技公司。

Fig.1 Structure of N-palmitoylethanolamide图1 N-棕榈酰乙醇胺结构式
1.1.3 实验仪器 DW-40L262 医用低温保存箱(青岛海尔特种电器有限公司),PRO200 匀浆器(美国PROScientific),TGL-16aR 高速冷冻离心机(上海安亭科学仪器厂),DW-2102A酶联免疫检测仪(北京六一生物科技有限公司),BX53光学倒置显微镜(日本奥林巴斯)。
1.2 动物分组、模型制备及实验流程 大鼠适应性饲养1周后,按照随机数字表法分为正常对照组、模型组、氟西汀组、PEA 组和PEA+MK886 组,每组10 只。除正常对照组外,其余4 组每天上午8:00 均给予慢性不可预见性温和应激(CUMS)和孤养应激,连续4 周。CUMS 干预1 周后开始灌胃给药,剂量均为10 mg∕kg,PEA+MK886 组在PEA 灌胃后腹腔注射MK886(3 mg∕kg)。
除正常对照组外,其余每组每日接受以下2 种不同的CUMS:电击足底20 次、5 ℃水中游泳5 min、45 ℃水中游泳5 min、禁食禁水18 h、50 ℃热刺激10 min、潮湿垫料17 h、合笼饲养17 h、空笼17 h、45°倾斜鼠笼24 h、夹尾1 min、悬尾1 min、异物放置24 h、灯光闪烁和昼夜循环颠倒24 h 等。动物每相邻2 d 接受刺激不重复,确保大鼠不能预测特定刺激的出现。
1.3 脑切片的制备及免疫组化染色检测PSA-NCAM 表达水平 实验第36 天,每组按照随机数字表法取3 只大鼠,将大鼠麻醉后处死,用预冷的生理盐水从左心室灌注到右心房,待流出液变清透后,继续灌注4%多聚甲醛(0.1 mol∕L 的PBS配制,pH=7.4)进行组织固定。低温下迅速取出全脑,于4%多聚甲醛溶液中固定12 h后进行石蜡包埋与切片。
石蜡切片于烘箱60 ℃烤片,60 min 后进行脱蜡和水化,二甲苯溶液冲洗2 次,15 min∕次,无水乙醇2 次,10 min∕次,95%和85%乙醇各1 次,5 min∕次,结束后PBS 洗涤3 次,5 min∕次,抗原热修复。冷却至室温后PBS洗涤3次,5 min∕次,滴加适量内源性过氧化物酶阻断剂覆盖于组织表面,室温放置15 min,PBS 洗涤3 次,5 min∕次。切片滴加PSA-NCAM 鼠源抗体(1∶150),4 ℃过夜。次日室温放置30 min后滴加适量的反应增强剂,PBS 洗涤3 次,5 min∕次。滴加适量辣根过氧化物酶标羊抗小鼠IgG 抗体,室温30 min,PBS 洗涤3 次,10 min∕次。滴加DAB显色液,适时流水冲洗,苏木素复染,自来水冲洗返蓝后进行脱水,最后用中性树胶进行封片。光学倒置显微镜下观察并拍照,Image Pro Plus 6.0 软件分析平均光密度值。
1.4 脑组织取样本采集和ELISA 检测 剩余大鼠于样本采集前12 h 禁食不禁水,麻醉大鼠后快速取脑,在低温操作台上分别分离PFC 和海马组织,液氮速冻后置于-80 ℃冰箱保存待用。参照ELISA试剂盒说明书的步骤进行操作,根据标准品所得的标准曲线计算出大鼠PFC 中BDNF、GDNF 含量,及PFC 和海马中TNF-α、IL-1β 和NF-κB 含量。BDNF、GDNF和IL-1β含量分别用ng∕g脑组织表示,NF-κB和TNFα含量用µg∕g脑组织表示。
1.5 统计学方法 采用SPSS 25.0 进行数据分析,采用GrapPad Prism 7.0 做图。符合正态分布的计量数据采用均数±标准差(±s)表示,正常对照组、模型组、氟西汀组、PEA组间各指标比较采用单因素方差分析,组间多重比较采用LSD-t法;PEA+MK886组和PEA组间各指标比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠PFC 和海马中PSA-NCAM 蛋白表达水平比较 正常对照组的PFC、海马DG区以及CA3区的PSA-NCAM 阳性免疫反应产物呈棕黄色颗粒,数量较多,排列密集,染色深,神经元胞核被染成蓝色。与正常对照组相比,模型组的PSA-NCAM 阳性免疫反应产物排列稀疏、密度明显降低,染色变浅,平均光密度显著降低(P<0.05)。与模型组相比,氟西汀组和PEA 组大鼠PFC 和海马CA3 区PSANCAM免疫反应产物数量增多,颜色较深,平均光密度显著增高(P<0.05)。与PEA 组相比,PEA+MK886 组的PSA-NCAM 阳性免疫反应产物染色变浅,平均光密度降低(P<0.05),见图2~4。
2.2 各组大鼠PFC中BDNF 和GDNF 含量比较 与正常对照组相比,模型组大鼠PFC 中的BDNF、GDNF含量均显著降低(P<0.05);与模型组相比,氟西汀组和PEA 组PFC 中的BDNF、GDNF 含量升高(P<0.05)。与PEA 组相比,PEA+MK886 组PFC 中BDNF、GDNF的含量均显著降低(P<0.05),见表1。
2.3 各组大鼠PFC 和海马中TNF-α、IL-1β 和NFκB含量比较 与正常对照组相比,模型组大鼠PFC和海马中TNF-α、IL-1β 和NF-κB 含量均显著增加(P<0.05);与模型组相比,氟西汀组和PEA 组大鼠PFC 中TNF-α、IL-1β 和NF-κB 含量均降低(P<0.05);与PEA 组相比,PEA+MK886组大鼠PFC 和海马中TNF-α、IL-1β 和NF-κB 的含量均显著增加(P<0.05),见表2。
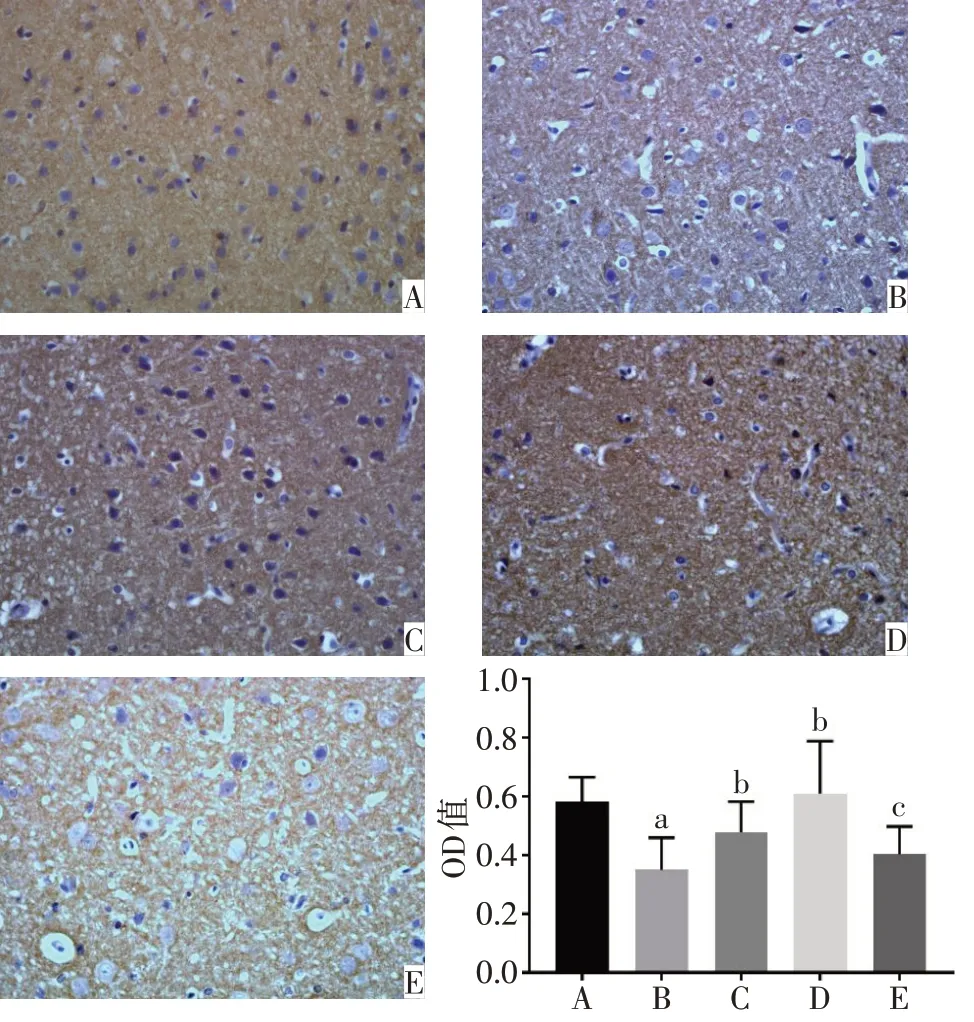
Fig.2 Immunohistochemical staining results of the expression of PSANCAM in prefrontal cortex of rats(×400)图2 各组大鼠PFC中PSA-NCAM蛋白表达的免疫组化染色结果(×400)
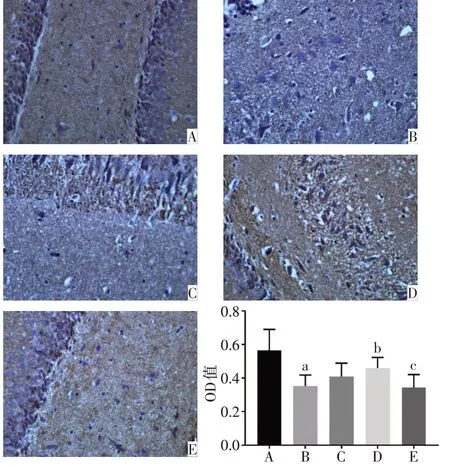
Fig.3 Immunohistochemical staining results of the expression of PSA-NCAM in DG of hippocampus of rats(×400)图3 各组大鼠海马DG区PSA-NCAM蛋白表达的免疫组化染色结果(×400)
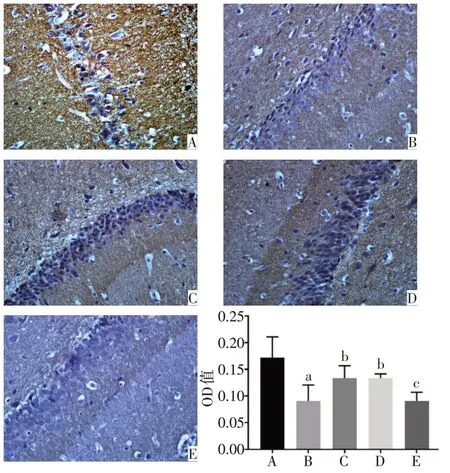
Fig.4 Immunohistochemical staining results of the expression of PSA-NCAM in CA3 of hippocampus of rats(×400)图4 各组大鼠海马CA3区PSA-NCAM蛋白表达的免疫组化结果(×400)
Tab.1 Comparison of the content of BDNF and GDNF in PFC tissue between the five groups表1 各组大鼠PFC中BDNF和GDNF含量的比较(n=7,ng∕g,±s)

Tab.1 Comparison of the content of BDNF and GDNF in PFC tissue between the five groups表1 各组大鼠PFC中BDNF和GDNF含量的比较(n=7,ng∕g,±s)
**P<0.01;a与正常对照组比较,b与模型组比较,c与PEA组比较,P<0.05。
组别正常对照组模型组氟西汀组PEA组PEA+MK886组F t BDNF 410.95±35.63 179.19±66.76a 294.49±41.37b 346.64±86.37b 187.25±24.22c 19.362**4.723**GDNF 130.25±27.25 72.99±18.79a 158.60±46.26b 127.26±30.97b 79.38±20.94c 9.696**3.622**
3 讨论
近年来,应激被认为是诱导抑郁症等精神类疾病的主要因素之一。应激是指外界环境剧烈变化时,机体的生理和心理失衡而出现的精神、神经内分泌和免疫等方面的反应[12]。经CUMS刺激建立的抑郁动物模型,与人类抑郁症的发病机制接近,已被广泛应用于抑郁症机制研究和药物筛选,此模型主要以测量“快感缺失”来判断模型是否成功[13]。本实验室前期研究已证实,CUMS 诱导大鼠出现了行为异常和生理功能障碍,抑郁症模型建立成功,经过28 d的PEA 治疗后,大鼠的体质量增长,自发活动、蔗糖偏好率均明显增加,表明大鼠的食欲和情绪有所改善、消化系统功能有所好转,探索行为和自发活动性及好奇程度都有所改善,奖赏反应和快感提升[9,11]。本研究进一步探究PEA改善大鼠抑郁样作用的机制。
PFC和海马是与认知、情绪密切相关的脑区,两者具有内在联系,PFC 在联想恐惧和奖励学习的神经元回路中起着关键的调节作用,在慢性应激后PFC和海马可能出现结构可塑性的改变,导致焦虑、抑郁情绪,认知改变等[14]。突触是一种高特异性的细胞黏附结构,黏附分子和糖蛋白类在其形成、成熟和功能调节中起到重要作用。PSA-NCAM 是一种带有唾液酸的特殊神经细胞黏附分子,在神经细胞黏附、轴突生长以及对神经元前体细胞的迁移等方面有重要作用。PSA-NCAM 与神经元的生长、发育和存活有密切联系,同时PSA-NCAM 也参与了突触的生长,突触可塑性形成和维持过程[15]。本研究中,PEA 处理后PFC 以及海马DG 和CA3 区的PSANCAM 蛋白表达较模型组均明显增加。BDNF 和GDNF参与神经元的存活、分化和生长,在神经系统的生长过程中发挥营养和保护作用[16]。研究发现,抑郁症患者BDNF 及GDNF 水平的下降可导致脑神经元损伤后修复、再生能力下降,进而影响5-羟色胺、多巴胺等神经递质的合成及分泌,并影响抗抑郁药的治疗效果[17-18]。本课题组前期研究发现,PEA可以逆转CUMS 诱导的海马BDNF 和GDNF 水平的下调[11]。本次实验中,PEA组PFC中BDNF和GDNF水平较模型组升高,提示PEA可促进神经元增殖、迁移、轴突生长和突触形成,增加PFC和海马的神经可塑性。
Tab.2 Comparison of TNF-α,IL-1β and NF-κB contents in PFC and hippocampus between the five groups表2 各组大鼠PFC和海马中TNF-α、IL-1β和NF-κB含量比较 (n=7,±s)

Tab.2 Comparison of TNF-α,IL-1β and NF-κB contents in PFC and hippocampus between the five groups表2 各组大鼠PFC和海马中TNF-α、IL-1β和NF-κB含量比较 (n=7,±s)
*P<0.05,**P<0.01;a与正常对照组比较,b与模型组比较,c与PEA组比较,P<0.05。
组别正常对照组模型组氟西汀组PEA组PEA+MK886组F t TNF-α(µg∕g)PFC 2.39±0.51 5.63±1.32a 3.73±1.31b 3.07±0.64b 5.66±1.44c 13.113**4.334**海马4.21±1.47 7.77±1.29a 4.82±1.31b 5.22±0.69b 6.49±1.71c 11.416**3.108**IL-1β(ng∕g)PFC 606.74±167.74 1 124.45±308.49a 828.25±173.81b 811.45±251.78b 1 056.20±268.61c 5.862**2.491*海马763.96±197.49 1 087.39±212.28a 896.43±157.26 818.94±177.27b 1 034.20±265.57c 3.989*2.426*NF-κB(µg∕g)PFC 8.29±4.17 23.12±5.89a 13.10±1.99b 11.74±5.34b 18.53±2.84c 13.405**2.972*海马12.89±2.11 21.46±4.28a 14.01±2.94b 13.57±2.72b 18.94±3.27c 11.609**3.344**
研究发现,精神疾病患者的脑组织中有多种炎症标志物高表达,脑内炎性细胞因子水平的增加可引起神经细胞损伤,这为抑郁症的细胞因子学说提供了有力支持[19]。TNF-α 通过促使炎症介质的迅速生成导致细胞因子的级联放大效应,从而导致“瀑布效应”,是判断炎症反应的可靠指标[20]。IL-1β是炎症反应调控中关键的炎性细胞因子,也是体内诱导炎症作用较强的炎症介质之一。NF-κB 参与免疫、炎症、应激反应以及细胞增殖和凋亡等过程,它作为炎症信号通路中的关键调节因子,常被视为调控炎症反应的重要靶点[21-22]。本研究发现,CUMS诱导后大鼠PFC 和海马中的TNF-α、IL-1β 和NF-κB含量出现升高,经PEA 干预后明显下降,提示PEA可能通过抑制NF-κB 信号通路从而减少中枢神经系统TNF-α、IL-1β等的释放,阻断炎症的级联放大效应,从而减轻过度炎症引发的PFC 和海马中神经元损伤,缓解慢性应激大鼠的焦虑抑郁样行为表型。
在采用选择性PPARα拮抗剂MK886预处理后,PEA对大鼠生理功能和行为学的改善作用不同程度被消除,本实验室前期研究结果显示PEA 可以上调CUMS大鼠PFC和海马中PPARα的蛋白和mRNA的表达[9,11],进一步证实PEA改善CUMS大鼠的抑郁样行为的机制可能与PPARα信号通路有关。
综上所述,PEA 可通过调控PFC 和海马的PPARα 通路,促进PFC 和海马的神经元增殖、突触形成,增加神经可塑性;同时可通过减少炎性细胞因子的分泌来减轻PFC 和海马中神经元损伤,改善慢性应激大鼠的焦虑抑郁样行为表型。

