洋葱黄矮病毒的实时荧光RT-PCR检测方法
刘建青 王韬远 李小宇 张春雨 苏 颖 魏 健 张金花* 王永志*
(1 吉林省农业科学院,吉林公主岭 136100;2 长春师范大学生命科学学院,吉林长春 130032;3 芜湖职业技术学院,安徽芜湖 241000)
洋葱黄矮病毒(Onion yellow dwarf virus,OYDV)是一种隶属于马铃薯Y 病毒属()的单链正义RNA 病毒,可侵染大蒜、洋葱等多种经济作物,严重危害葱属植物的产量和品质(许蕊,2012;王永志 等,2018)。OYDV 于1929 年首次在美国爱荷华州的洋葱中被发现(Melhus et al.,1929)。国内于2018 年在吉林省分蘖洋葱(又称珠葱、毛葱或分蘖葱头)中首次发现该病毒(Su et al.,2018)。OYDV 主要通过蚜虫传播,也可以汁液摩擦接种传播,还在少数地方品种中存在种子传播(Kumar et al.,2011;Katis et al.,2012)。OYDV 感染葱属植物后,存在于感病植株的根、叶和鳞茎等各个部位(李金娟 等,2011),表现为植株矮化,叶片伴随局部不规则发黄,后期整个叶片发黄和皱缩等症状(Winiarczyk et al.,2014)。珠葱和大蒜主要以鳞茎进行无性繁殖,长期的无性繁殖使病毒逐代传递和积累,尤其是OYDV 危害较大,导致种性退化,给当地种植户造成了严重的经济损失(董玉惠 等,2019;苏雪娇 等,2021)。
目前没有防治病毒病的有效药剂,建立精准高效的病毒检测技术是防治的重要前提。目前常用的OYDV 检测方法主要有血清学法和分子生物学法(高昌勇和尚宏芹,2004)。酶联免疫吸附法(ELISA)是目前常用的血清学检测方法之一(王永志 等,2018),但该方法耗时较长,灵敏度较低,易误检(王鹏 等,2013;陶源和吴兴泉,2017)。而分子生物学法可以弥补以上缺点,OYDV 的分子生物学检测技术主要包括常规RT-PCR 检测法(郭炎 等,2019)和逆转录环介导等温扩增法(RTLAMP)(Tiberini et al.,2019a)等,但上述两种方法不能对病毒进行定量分析。而实时荧光RT-PCR方法具有高灵敏度和可定量等优点,已成为植物病毒检测的重要技术手段之一(丁天波 等,2018)。本试验根据OYDV 外壳蛋白(coat protein,)基因保守序列设计特异性引物,通过优化反应体系和反应条件,建立OYDV 实时荧光RT-PCR 检测方法,以期为OYDV 的监测预警和葱属植物病毒病防治提供技术手段。
1 材料与方法
1.1 材料
2020 年6 月初在吉林省珠葱和大蒜种植区采用五点取样法随机采集90 份疑似OYDV 感病样品,其中珠葱45 份,大蒜45 份,编号后置于液氮中速冻,之后于-80 ℃冰箱保存备用。
1.2 主要试剂及仪器
主要试剂:TRIzol 购自Invitrogen 公司,快速质粒小提试剂盒购自天根生化科技(北京)有限公司,琼脂糖凝胶回收试剂盒购自Axygen 公司,MagicSYBR Mixture 试剂盒购自北京康为世纪有限公司,1st Strand cDNA Synthesis Kit、pMD18-T Vector Cloning Kit、DNA Marker 和DH5α感受态细胞均购自大连宝生物公司(TaKaRa)。
主要仪器:QuantStudio6 Flex 实时荧光定量PCR 仪购自美国ABI 公司,高速冷冻台式离心机(CT15RE 型)购自日本日立公司,基因扩增仪(ETC-811 型)购自东胜创新生物技术有限公司,电泳仪(DYY-11 型)购自北京市六一仪器厂,凝胶成像仪购自美国WEALTET 公司。
1.3 引物设计与合成
根据GenBank 中登录的OYDV基因保守序列设计一对特异性引物,扩增目的片段长度为79 bp。上游引物OYDV-F:5′-GCACGTTACGCATTC GACTT-3′,下游引物OYDV-R:5′-GCCTTCAT CTGCATGTGTG-3′,引物由吉林省库美生物科技有限公司合成。
1.4 OYDV 实时荧光RT-PCR 检测方法的建立
1.4.1 质粒标准品的制备 采用TRIzol 法提取OYDV 染病叶片总RNA,-80 ℃冰箱中保存。根据1st Strand cDNA Synthesis Kit 说明书合成cDNA第一链,并以其为模板,使用OYDV-F/R 引物进行常规RT-PCR 扩增。20 μL PCR 反应体系:上下游引物(10 μmol·L)各0.5 μL,Premix Ex10 μL,模板cDNA 1 μL,加ddHO 补足20 μL;扩增程序:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火20 s,72 ℃延伸10 s,30 个循环;72 ℃延伸10 min。采用2%琼脂糖凝胶电泳对PCR 产物进行验证。
将初步验证正确的PCR 产物经胶回收纯化,连接至pMD18-T 载体并转化DH5 α 感受态细胞,筛选并提取阳性克隆质粒送至吉林省库美生物科技有限公司进行测序。利用核酸蛋白浓度测定仪测定重组质粒浓度,根据公式:拷贝数=(质粒浓度 × 10× 6.02 × 10)/(质粒总长度 × 660)计算阳性重组质粒拷贝数,按10 倍梯度稀释质粒,-20 ℃保存。
1.4.2 反应条件优化 以阳性质粒标准品为模板,依次对引物浓度、退火温度等进行优化。20 μL 反应体系:2× MagicSYBR Mixture 10 μL,上、下游引物分别设0.1、0.2、0.3、0.4、0.5 μmol·L共5个引物浓度,ROX Reference Dye 0.2 μL,DNA 模板2 μL,ddHO 补齐至20 μL。扩增条件:95 ℃预变性30 s;95 ℃变性5 s,退火/延伸30 s(分别设58、60、62 ℃共3 个退火温度),40 个循环。熔解曲线:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,以熔解曲线峰单一且循环阈值(Ct 值)最小为标准,确定最佳反应体系和反应条件。
1.4.3 标准曲线建立 以终浓度为2.0 × 10~2.0 × 10copies·μL的阳性质粒标准品为模板,每个浓度重复3 次,利用优化后的反应条件进行实时荧光RT-PCR 扩增,建立标准曲线。
1.4.4 特异性试验 应用建立的实时荧光RT-PCR方法对青葱X 病毒(Shallot virus X,SVX)和葱潜隐病毒(Shallot latent virus,SLV)进行检测,同时设浓度为2.0 × 10copies·μL的标准品为阳性对照,以ddHO为阴性对照,验证该方法的特异性。
1.4.5 敏感性试验 以终浓度为2.0~2.0 × 10copies·μL的阳性质粒标准品为模板分别进行实时荧光RT-PCR 和常规RT-PCR 扩增,比较两种方法的灵敏度。
1.4.6 重复性试验 以终浓度为2.0 × 10~2.0 × 10copies·μL的阳性质粒标准品为模板分别进行组内和组间重复性试验,每个梯度设3 个重复,评价其重复性。
1.5 田间样品检测
以田间采集的90 份珠葱和大蒜待测样品cDNA为模板分别进行常规RT-PCR 和实时荧光RT-PCR 检测,同时以健康植株为阴性对照,比较两种方法的检测结果。
2 结果与分析
2.1 质粒标准品的制备
以感染OYDV 的珠葱叶片总RNA 反转录合成的cDNA为模板扩增OYDV基因部分片段,结果显示,引物OYDV-F/R 能扩增出79 bp 的目的片段,与预期大小相符(图1)。将目的片段回收纯化,连接于pMD18-T 载体上,提取质粒,经测序分析和BLAST 比对,确定所获得的序列为OYDV基因片段。利用核酸蛋白浓度测定仪测定重组质粒浓度为66.7 ng·μL,根据公式计算阳性重组质粒拷贝数为2.0 × 10copies·μL。
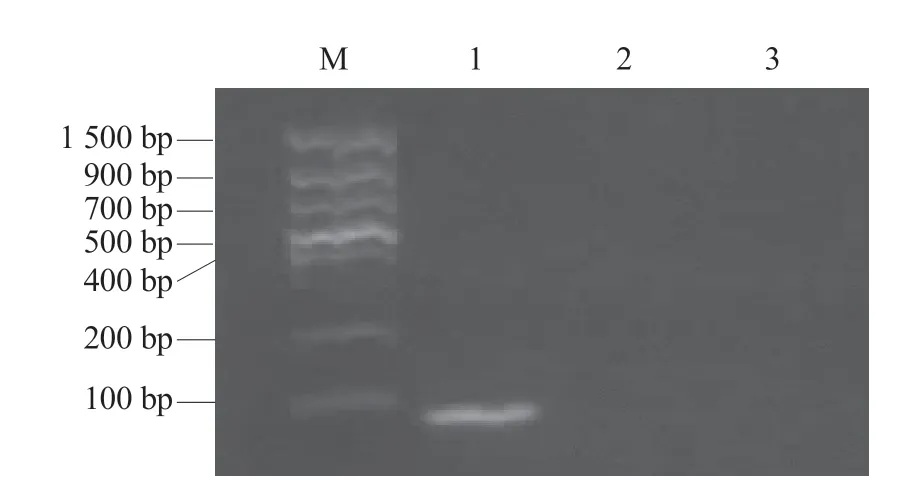
图1 RT-PCR 扩增OYDV 目的片段
2.2 OYDV 实时荧光RT-PCR 检测方法的建立
2.2.1 反应条件优化 当引物终浓度为0.2 μmol·L,退火温度为60 ℃时,熔解曲线峰单一且Ct 值最小,因此,经反应条件优化得到最佳反应体系:2× MagicSYBR Mixture 10 μL,上、下游引物(10 μmol·L)分别为0.4 μL,ROX Reference Dye 0.2 μL,DNA 模板2 μL,ddHO 7 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40 个循环。
2.2.2 标准曲线建立 以终浓度为2.0 × 10~2.0 × 10copies·μL的质粒标准品为模板,进行实时荧光RT-PCR 扩增,得到Ct 值与标准品拷贝数的对数所构建的标准曲线(图2)。结果显示,Ct 值与模板拷贝数的对数呈良好的线性关系,=-3.424+41.21,扩增效率(E)为95.921%,相关系数(R)为0.996。

图2 OYDV 实时荧光RT-PCR 标准曲线
2.2.3 特异性试验 利用建立的实时荧光RT-PCR检测方法,以SVX 或SLV 侵染珠葱的cDNA为模板,检测结果显示(图3),仅OYDV 出现特异性扩增,而SVX、SLV 及阴性对照均未出现特异性扩增,表明该方法具有较高的特异性。

图3 OYDV 实时荧光RT-PCR 特异性分析
2.2.4 敏感性试验 以终浓度为2.0~2.0 × 10copies·μL的质粒标准品为模板分别进行实时荧光RT-PCR 和常规RT-PCR 扩增。结果显示:在Ct 值<35 范围内实时荧光RT-PCR 的检出下限为2.0 × 10copies·μL(图4-A),而常规RT-PCR的检出下限为2.0 × 10copies·μL(图4-B)。表明本试验建立的实时荧光RT-PCR 检测OYDV 的灵敏度比常规RT-PCR 大约高1 000 倍。
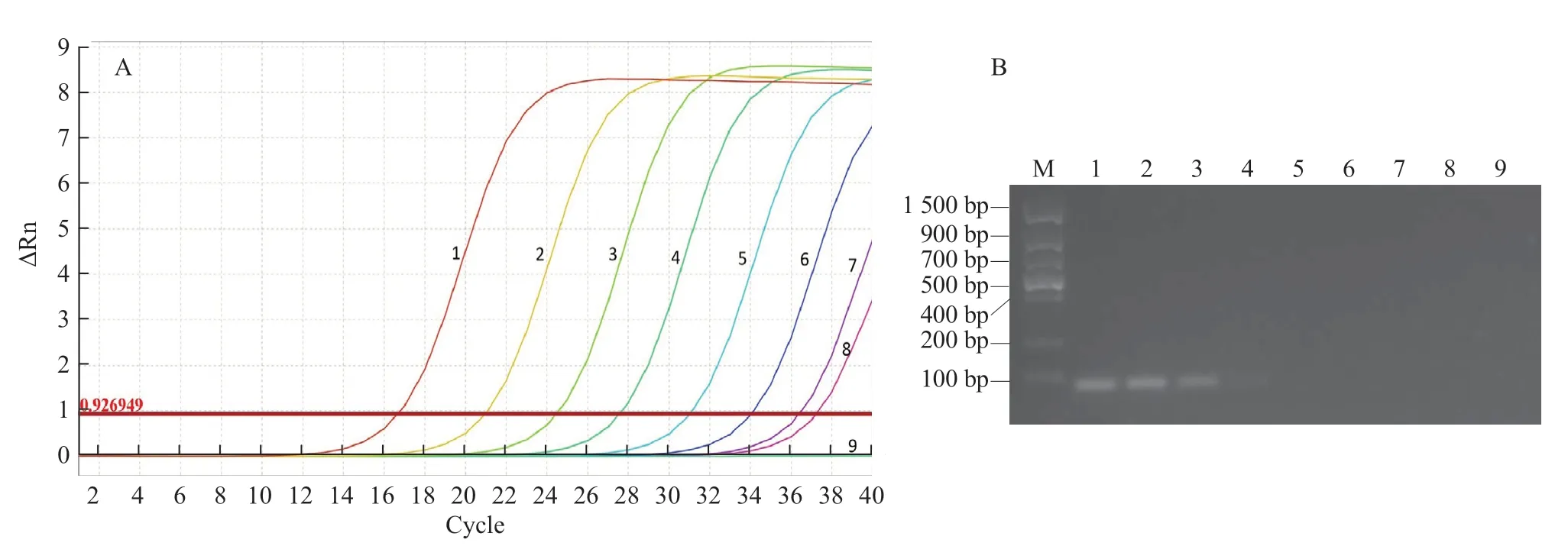
图4 OYDV 实时荧光RT-PCR 和常规RT-PCR 敏感性分析
2.2.5 重复性试验 将不同稀释度标准品2.0 × 10~2.0 × 10copies·μL进行实时荧光RTPCR扩增,结果显示(表1),组内变异系数在0.17%~0.41%,组间变异系数在0.31%~1.84%之间,均小于2%,表明该方法具有良好的重复性。
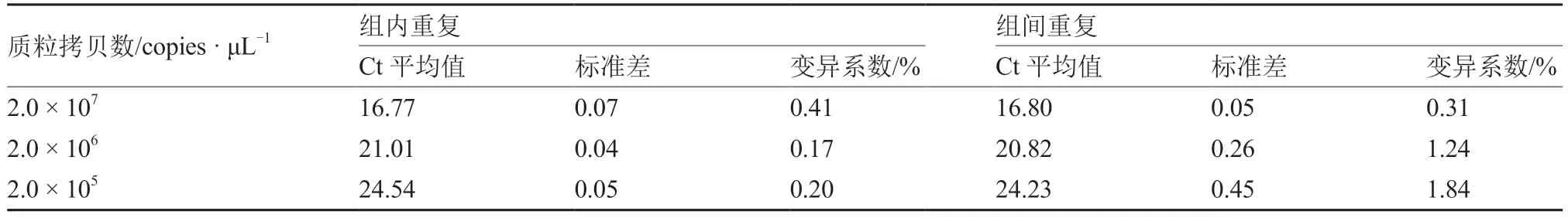
表1 OYDV 实时荧光RT-PCR 重复性试验
2.3 田间样品检测
利用常规RT-PCR 和本试验建立的实时荧光RT-PCR 方法对采集的各45 份疑似OYDV 感病珠葱和大蒜样品进行检测,常规RT-PCR 检测结果表明:珠葱和大蒜阳性样品分别为16 份和42 份,阳性检出率分别为35.56%和93.33%。实时荧光RTPCR 检测结果显示:珠葱和大蒜阳性样品分别为34 份和45 份,检出率分别为75.56%和100.00%,较常规RT-PCR 分别高40.00、6.67 百分点。
3 讨论与结论
洋葱黄矮病毒是导致葱属植物病毒病发生的主要病毒之一,在我国东北、华中和西北等地区均有发生,给当地种植户造成严重经济损失(孙新艳 等,2016;李甜甜 等,2017;李小宇 等,2019)。在种植过程中,OYDV 在鳞茎中不断积累,严重影响鳞茎的营养成分和储藏特性,干扰葱属植物的代谢途径(Tiberini et al.,2019b)。由于该病毒主要通过多种蚜虫以非持久性方式进行传播,具有较高的传播流行风险(Drake et al.,1993),因此,在田间需加强媒介昆虫的防控,及时清理田间杂草和拔除感病植株,防止病毒的蔓延。
病毒检测对病毒流行病学研究及脱毒种苗繁育具有重要意义。在植物的整个生长周期,病毒在植物的不同组织部位及不同生长阶段含量不同,在病毒含量极低时进行检测容易出现假阴性(Conci et al.,2002),因此,需要确定最佳采样部位和检测时间。OYDV 感染洋葱后,叶片中的病毒含量始终高于鳞茎(Sevik,2012),因此本试验选取珠葱和大蒜叶片作为检测材料,进行OYDV 实时荧光RT-PCR 扩增,阳性检出率高于常规RT-PCR,适用于葱属植物脱毒苗脱毒效果的检测。葱属植物通常感染OYDV 等多种病毒,目前已建立针对洋葱和大蒜寄主的OYDV 实时荧光RT-PCR 检测方法(陈辉麟,2014;Tiberini et al.,2019b),本试验针对珠葱寄主,进一步完善了利用实时荧光RTPCR 法检测不同寄主感染OYDV 的情况,但建立的实时荧光RT-PCR 方法主要针对单一病毒,有待进一步建立多重实时荧光RT-PCR 检测体系,缩短检测时间,提高检测效率。
OYDV 常与其他病毒复合侵染葱属植物,如OYDV 与SLV 复合侵染大蒜和珠葱(Majumder &Joshi,2008;刘建青 等,2021),与葱属X 病毒属病毒复合侵染洋葱(Kumar et al.,2010)。两种病毒复合侵染同一寄主时,它们之间可能发生干扰或协生作用,不同的作用方式将会对寄主植物症状、媒介昆虫与植物相互作用产生不同的影响(李舒,2016)。本试验建立的OYDV 实时荧光RT-PCR 方法不仅为田间珠葱和大蒜病毒定性检测提供了技术手段,还可用于监测OYDV 在珠葱和大蒜的不同组织部位的积累量、检测寄主植物的抗性和研究不同感染阶段病毒-媒介昆虫-寄主植物的互作机制,有利于寻找更有效的抗病毒途径,对于当地珠葱和大蒜生产及产业发展具有重要意义。
——一道江苏高考题的奥秘解读和拓展

