姜黄素通过AKT/HIF-1α/VEGF信号通路在体外抑制脉络膜新生血管的机制
陈水龄,亢泽峰,褚文丽,郝雪莲,陶方方,张明明,李书娇
0引言
脉络膜新生血管(choroidal neovascularization,CNV)是年龄相关性黄斑病变(age-related macular degeneration,ARMD)、病理性近视(pathological myopia,PM)及中心性渗出性脉络膜视网膜病变(central exudative choroidal retinopathy,CEC)等多种眼底疾病的病理表现。CNV的形成是多细胞与多因子共同作用的结果,血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知促进CNV形成的重要的因子之一。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)相关信号通路是参与调控这些细胞与因子活性的重要信号通路[1]。目前,中药单体在抗新生血管方面的研究较多,尤其是在抗肿瘤新生血管方面,也为眼科新生血管类疾病的研究提供了思路。姜黄素(Curcumin)是从姜科植物姜黄、郁金、莪术提取的一种多酚类化合物,也是姜黄发挥药理作用的主要成分,体内外实验研究证实其药理作用广泛[2-3],主要有抗炎、抗氧化、抗新生血管及抗肿瘤等[4-5],但在CNV方面的研究较少。本研究探讨姜黄素在体外抑制CNV的作用机制,为CNV的治疗提供思路。
1材料和方法
1.1材料
1.1.1细胞来源人视网膜色素上皮(ARPE-19)细胞购自中国典型培养物保藏中心(CCTCC);人脐静脉内皮细胞(HUVEC)购自美国ScienCell公司。
1.1.2主要试剂氯化钴(CoCl2)和姜黄素(美国Sigma),DMEM/F12培养液(美国Hyclon),ECM培养基(美国Cell Signaling Technology),胎牛血清(美国Gibco),Matrigel基质胶(美国BD),CCK-8试剂盒(日本同仁)。RNA试剂盒(北京康为世纪生物科技有限公司)。一抗:anti-AKT和anti-p-AKT(美国CST),anti-HIF-1α和anti-VEGF-A(美国Abcam)。
1.2方法
1.2.1CCK-8法筛选造模试剂CoCl2和实验药物姜黄素及阳性对照药雷珠单抗的浓度将对数生长期ARPE-19细胞接种于96孔板培养24h;分别加入浓度为0、50、100、200、400及800μmol/L的CoCl2溶液分别培养6、12、24和48h后,每孔加入CCK-8溶液20μL,培养4h后检测各孔在450nm的吸光度值(OD值)。以正常组细胞活性为1,各实验组细胞活性=(实验组平均OD值-空白孔平均OD值)/(正常组平均OD值-空白孔平均OD值),每组3个复孔。同样的方法加入浓度为0、6.25、12.5、25、50、100及200μmol/L姜黄素分别培养6、12、24和48h;浓度为0、5、10、20、40和80μg/mL雷珠单抗培养24h。
1.2.2CCK-8法检测各实验组ARPE-19细胞的活性将对数生长期ARPE-19细胞接种于96孔板中培养24h,根据分组给予不同干预,正常组:ARPE-19;模型组:ARPE-19+CoCl2;雷珠单抗组:ARPE-19+CoCl2+雷珠单抗;姜黄素低剂量组:ARPE-19+CoCl2+姜黄素低剂量;姜黄素中剂量组:ARPE-19+CoCl2+姜黄素中剂量;姜黄素高剂量组:ARPE-19+CoCl2+姜黄素高剂量组。培养24h后加入CCK-8溶液20μL,培养4h后检测各孔在450nm的吸光度值(OD值)。以正常组细胞活性为1,各实验组细胞活性=(实验组平均OD值-空白孔平均OD值)/(正常组平均OD值-空白孔平均OD值)。
1.2.3RT-qPCR检测各组细胞AKT和HIF-1α及VEGFmRNA的表达制备各组ARPE-19细胞样本,按照Trizol说明书提取总RNA,逆转录合成cDNA。qPCR设置反应条件:95℃×10min→95℃×15s→60℃×1min,35~40个循环,进行目的基因扩增,以GAPDH为内参,得到目的基因表达的相对定量值,进行统计学分析。其中引物由上海生工生物工程有限公司设计与合成,具体序列如下:GAPDH-F:GGAGATTACTGCCCTGGCTCCTA,GAPDH-R:GACTCATCGTACTCCTGCTTGCT,AKT-F:ACTGTCATCGAACGCACCTT,AKT-R:CTCCTCCTCCTCCTGCTTCT,HIF-1α-F:ACCTATGACCTGCTTGGTG,HIF-1α-R:GGCTGTGTCGACTGAGGAA,VEGF-F:GAGTACATCTTCAAGCCATCCT,VEGF-R:TGCTCTATCTTTCTTTGGTCTGC。
1.2.4Westernblot检测各组细胞AKT、p-AKT、HIF-1α和VEGF蛋白的表达采用Western blot法检测CoCl2(100μmol/L)对ARPE-19细胞AKT、p-AKT、HIF-1α和VEGF蛋白表达的影响。制备细胞样本,提取总蛋白,BCA法计算蛋白浓度,制备蛋白SDS-PAGE胶,聚丙烯酰胺凝胶电泳,转膜(湿转),抗体孵育(其中一抗稀释比例为AKT 1∶1000,p-AKT 1∶2000,HIF-1α 1∶500,VEGF 1∶1000),曝光显影,测定条带灰度值,以β-actin条带的光密度值校正,得到目的蛋白的相对表达量。
1.2.5CCK-8法检测缺氧条件下ARPE-19细胞姜黄素条件培养液对HUVEC细胞活性的影响根据1.2.2制备缺氧条件下ARPE-19细胞不同组条件培养液,CCK-8法检测各组条件培养液对HUVEC细胞活性的影响(具体方法同1.2.1)。
1.2.6细胞划痕实验检测各组条件培养液对HUVEC细胞水平迁移的影响待HUVEC细胞生长至80%融合时,调整细胞浓度至每毫升1×105个,接种于24孔板中待细胞生长融合成单层细胞后,用10μL微量加样枪头垂直于板底行“一”字形划痕,PBS冲洗,镜下拍摄0h和不同条件培养液干预24h后的照片(40×),重复3次。测量并计算各组迁移率,迁移率=(S0-St)/S0×100%(S0:原始裸区面积,St:各时间点裸区面积)。
1.2.7Transwell小室法检测各组条件培养液对HUVEC细胞垂直迁移和侵袭的影响Transwell小室检测细胞迁移和侵袭的不同在于侵袭实验需要加入Matrigel基质胶。调整HUVEC细胞至每毫升1×105个,在Transwell的下室,根据分组给予不同条件培养液;在Transwell的上室加入HUVEC细胞悬液。加样后培养24h,吸尽小室内液体,擦去小室内未迁移的细胞,多聚甲醛固定,结晶紫染色,晾干。倒置显微镜下取上下左右中间5个视野拍照(100×),相对垂直迁移率=实验组/正常组,相对侵袭率=实验组/正常组。
1.2.8Matrigel基质胶法检测各组条件培养液对HUVEC细胞管腔形成的影响96孔板中用预冷的枪头在每孔加入Matrigel基质胶培养2h,使胶凝固。同时消化HUVEC细胞,调整至每毫升2×105个,根据分组给予不同条件培养液和HUVEC细胞悬液,接种于96孔板中培养6h。倒置显微镜下取上下左右中间5个不同视野进行拍照(100×),相对管腔形成率=实验组/正常组。
统计学分析:采用GraphPad Prism 6.0软件进行统计学分析,计量资料用均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用Dunnett-t检验,以P<0.05为差异具有统计学意义。
2结果
2.1不同浓度CoCl2对ARPE-19细胞活性的影响随着浓度的增加,细胞活性呈现先增长后抑制,当CoCl2浓度≥200μmol/L时,ARPE-19细胞的数量显著减少,差异有统计学意义(P<0.05),镜下可见细胞皱缩稀疏。因此,我们选择CoCl2浓度为100μmol/L,干预24h进行后续实验研究,见表1。

表1 不同浓度CoCl2对ARPE-19细胞活性的影响
2.2不同浓度姜黄素对ARPE-19细胞活性的影响姜黄素浓度在0~100μmol/L时,对细胞活性没有影响,镜下观察细胞形态未见变化。当浓度为200μmol/L时,细胞活性明显降低,差异有统计学意义(P<0.05),镜下观察细胞皱缩,数量减少。因此,我们选择姜黄素浓度为6.25、25、100μmol/L为低、中、高剂量进行后续相关实验研究,见表2。

表2 不同浓度姜黄素对ARPE-19细胞活性的影响
2.3不同浓度雷珠单抗对CoCl2诱导的ARPE-19细胞活性的影响当雷珠单抗浓度为20μg/mL时,ARPE-19细胞的活性较CoCl2组显著降低,差异有统计学意义(P<0.05),与正常组比较差异无统计学意义(P>0.05);当浓度>20μg/mL时,ARPE-19细胞的活性较CoCl2组和正常组均降低,差异均有统计学意义(P<0.05)。因此,我们选择雷珠单抗浓度为20μg/mL进行后续相关实验研究,见表3。

表3 不同浓度雷珠单抗对CoCl2诱导的ARPE-19细胞活性的影响
2.4各组间AKT和HIF-1α及VEGFmRNA相对表达量AKT、HIF-1α和VEGF mRNA相对表达量模型组均高于正常组,差异均有统计学意义(P<0.05);雷珠单抗组均低于模型组,差异均有统计学意义(P<0.05);姜黄素低、中剂量与模型组比较差异均无统计学意义(P>0.05);姜黄素高剂量组较模型组降低,差异有统计学意义(P<0.05);与雷珠单抗组比较差异无统计学意义(P>0.05),见表4。

表4 各组间AKT和HIF-1α及VEGF mRNA相对表达量
2.5各组间AKT和HIF-1α及VEGF蛋白相对表达量各组间AKT蛋白比较差异无统计学意义(P>0.05),p-AKT、HIF-1α和VEGF蛋白相对表达量模型组均高于正常组,差异均有统计学意义(P<0.05),雷珠单抗组均低于模型组,差异均有统计学意义(P<0.05)。p-AKT和HIF-1α蛋白相对表达量姜黄素低、中剂量与模型组比较差异均无统计学意义(P>0.05),姜黄素高剂量组较模型组降低,差异均有统计学意义(P<0.05),与雷珠单抗组比较差异无统计学意义(P>0.05)。VEGF蛋白相对表达量姜黄素低剂量组与模型组比较差异均无统计学意义(P>0.05),姜黄素中、高剂量组较模型组降低,差异均有统计学意义(P<0.05),与雷珠单抗组比较差异无统计学意义(P>0.05),见图1,表5。

表5 各组间AKT和HIF-1α及VEGF蛋白相对表达量

图1 各组间AKT和HIF-1α及VEGF蛋白相对表达量 A:正常组;B:模型组;C:雷珠单抗组;D:姜黄素低剂量组;E:姜黄素中剂量组;F:姜黄素高剂量组。
2.6ARPE-19细胞各组条件培养液对HUVEC细胞活性的影响ARPE-19细胞各组条件培养液对HUVEC细胞活性的影响比较差异无统计学意义(P>0.05),见表6。
2.7ARPE-19细胞各组条件培养液对HUVEC细胞水平迁移的影响ARPE-19细胞各组条件培养液对HUVEC细胞水平迁移的影响比较差异有统计学意义(P<0.05)。与正常组相比模型组HUVEC细胞水平迁移显著增加,差异有统计学意义(P<0.05);与模型组相比雷珠单抗组水平迁移较少,差异有统计学意义(P<0.05);姜黄素条件培养液低、中、高剂量组水平迁移较模型组明显减少,差异有统计学意义(P<0.05),其中,高剂量组与雷珠单抗组比较差异无统计学意义(P>0.05),见图2,表6。

图2 ARPE-19细胞各组条件培养液对HUVEC细胞水平迁移的影响 A:正常组;B:模型组;C:雷珠单抗组;D:姜黄素低剂量组;E:姜黄素中剂量组;F:姜黄素高剂量组。
2.8ARPE-19细胞各组条件培养液对HUVEC细胞垂直迁移的影响ARPE-19细胞各组条件培养液对HUVEC细胞垂直迁移的影响比较差异有统计学意义(P<0.05)。与正常组相比模型组HUVEC细胞垂直迁移显著增加,差异有统计学意义(P<0.05);与模型组相比雷珠单抗组垂直迁移较少,差异有统计学意义(P<0.05);姜黄素条件培养液低、中剂量组细胞垂直迁移与模型组相比差异无统计学意义(P>0.05),姜黄素条件培养液高剂量组垂直迁移较模型组明显减少,差异有统计学意义(P<0.05),与雷珠单抗组比较差异无统计学意义(P>0.05),见图3,表6。

图3 ARPE-19细胞各组条件培养液对HUVEC细胞垂直迁移的影响 A:正常组;B:模型组;C:雷珠单抗组;D:姜黄素低剂量组;E:姜黄素中剂量组;F:姜黄素高剂量组。
2.9ARPE-19细胞各组条件培养液对HUVEC细胞侵袭的影响ARPE-19细胞各组条件培养液对HUVEC细胞侵袭的影响比较差异有统计学意义(P<0.05)。与正常组相比模型组HUVEC细胞侵袭显著增加,差异有统计学意义(P<0.05);与模型组相比雷珠单抗组侵袭显著减少,差异有统计学意义(P<0.05);姜黄素条件培养液低、中剂量组细胞侵袭与模型组相比差异无统计学意义(P>0.05),姜黄素条件培养液高剂量组侵袭较模型组显著减少,差异有统计学意义(P<0.05),与雷珠单抗组比较差异无统计学意义(P>0.05),见图4,表6。
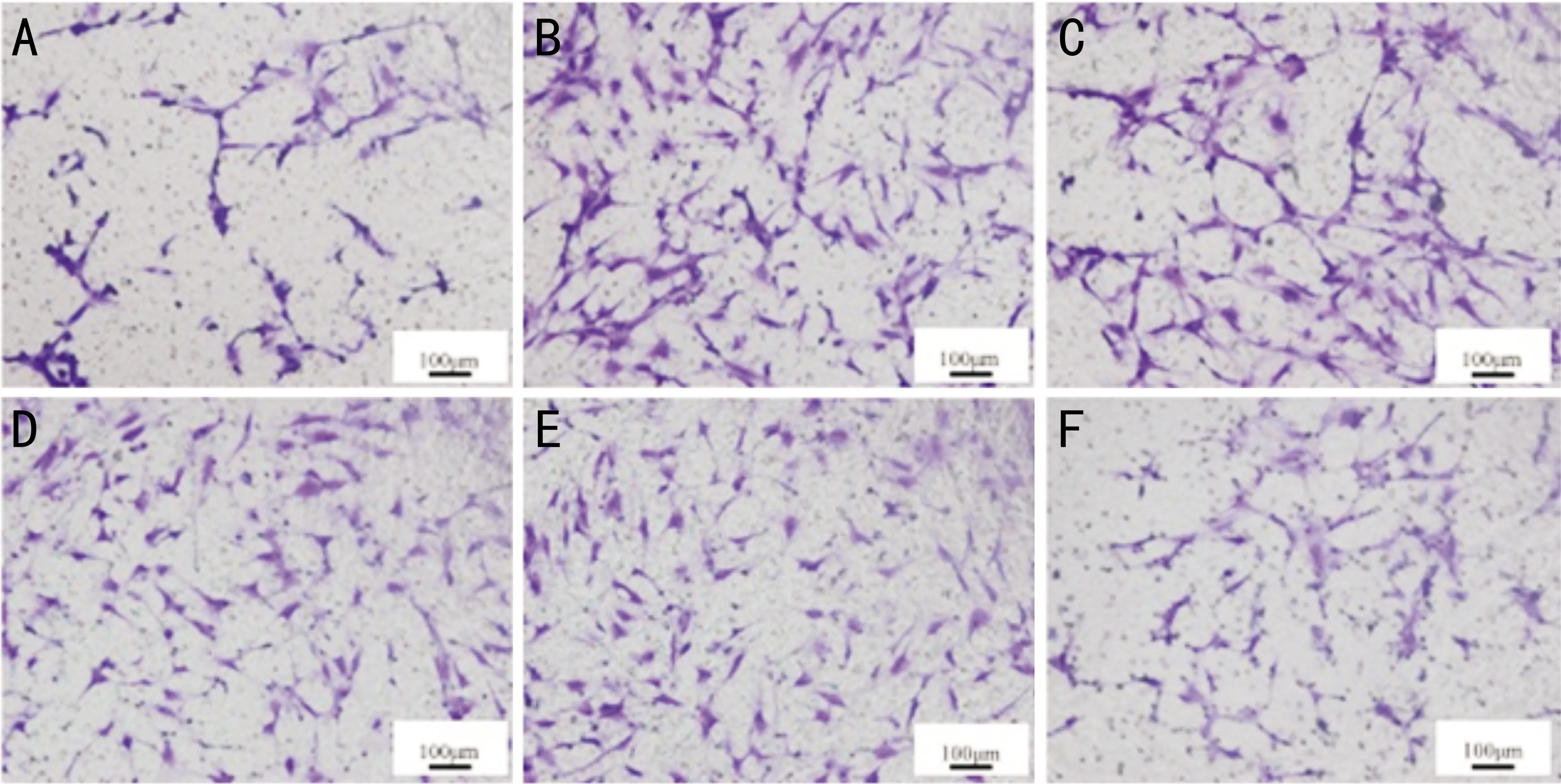
图4 ARPE-19细胞各组条件培养液对HUVEC细胞侵袭的影响 A:正常组;B:模型组;C:雷珠单抗组;D:姜黄素低剂量组;E:姜黄素中剂量组;F:姜黄素高剂量组。
2.10ARPE-19细胞各组条件培养液对HUVEC细胞管腔形成的影响ARPE-19细胞各组条件培养液对HUVEC细胞管腔形成的影响比较差异有统计学意义(P<0.05)。与正常组比较模型组HUVEC细胞管腔形成明显增加,差异有统计学意义(P<0.05);与模型组比较雷珠单抗组管腔形成显著较少,差异有统计学意义(P<0.05);与模型组比较姜黄素条件培养液低剂量组管腔形成未见明显变化,中、高剂量组管腔形成显著减少,差异有统计学意义(P<0.05),其中高剂量组管腔形成与雷珠单抗组比较差异无统计学意义(P>0.05),见图5,表6。

表6 ARPE-19细胞各组条件培养液对HUVEC细胞的影响

图5 ARPE-19细胞各组条件培养液对HUVEC细胞管腔形成的影响 A:正常组;B:模型组;C:雷珠单抗组;D:姜黄素低剂量组;E:姜黄素中剂量组;F:姜黄素高剂量组。
3讨论
多种细胞成分参与了CNV的形成,其中RPE细胞是CNV的主要细胞成分之一,CNV病变早期就存在RPE细胞的萎缩或功能减退。RPE是视网膜神经上皮层和脉络膜之间含有色素的单层细胞,它与视网膜光感受器细胞层、Bruch 膜和脉络膜毛细血管共同组成光感受器细胞-RPE-Bruch膜-脉络膜毛细血管复合体,在视网膜生理病理中发挥重要作用[6],与眼底新生血管性疾病的发生发展密切相关[7-8]。在缺氧状态下,RPE 细胞异常分泌VEGF等促血管生长因子,Bruch膜损伤,CNV形成,视网膜光感受器细胞因缺乏脉络膜的营养供应而凋亡。内皮细胞作为组织与血液的第一道屏障,也是最先感受缺氧的细胞之一。在CNV疾病的发生发展过程中,RPE细胞缺氧、内皮细胞受损及功能障碍是其中的关键因素,对内皮细胞的保护可阻止其进一步恶化,达到治疗疾病的目的。
缺氧诱导VEGF的表达是CNV发病机制中的重要环节。HIF-1α是细胞内氧平衡的关键调节因子,在缺氧诱导的血管生成、肿瘤发生、炎性反应以及细胞自噬等方面都起关键作用,它的激活可作为组织和细胞缺氧的直接反映与重要标志。本研究显示,CoCl2在100μmol/L浓度时可以促进细胞中HIF-1α mRNA和蛋白的表达,这说明我们的ARPE-19细胞体外缺氧模型的建立是成功的,与以往文献报道类似[9-10],其机制与AKT信号通路有关。近年来大量的体内外实验研究证实姜黄素药理作用广泛[2,11],主要有抗炎、抗氧化、抗新生血管[3,5]及抗肿瘤等[12-13],且无明显毒副作用。姜黄素在眼科相关的研究较多,包括抑制角膜新生血管形成[13];抑制翼状胬肉成纤维细胞增生;抑制青光眼小梁切除术后滤过道瘢痕化;防治增殖性玻璃体视网膜病变[14-15];抑制人[16]和动物[17-18]视网膜色素上皮细胞增殖[19];延缓实验动物早期[20]糖尿病视网膜病变[21];减少[22-23]视网膜缺血再灌注损伤[24];神经节细胞损伤的保护[25-26]及治疗眼部肿瘤等[27]多方面。
正常情况下,眼部组织中VEGF表达水平很低;但在缺血、缺氧、炎症等应激情况下[28-29],VEGF的表达水平会显著增高,继而诱发新生血管形成。目前眼科临床使用的各种抗VEGF类药物通过抑制VEGF与受体结合从而抑制CNV生长及血管渗漏,改善或维持患者的视力。本研究显示100μmol/L的姜黄素可减少ARPE-19细胞中AKT、HIF-1α和VEGF mRNA及蛋白的表达,可见姜黄素对CoCl2诱导ARPE-19细胞缺氧具有保护作用,但需要达到一定剂量。体外血管形成实验可分为细胞增殖实验、水平迁移实验[30-31]、垂直迁移实验[32-35],细胞侵袭实验[36],管腔形成实验,以及器官水平的人胎盘血管段培养模型和大鼠动脉环模型。目前通常所说的血管形成实验是指细胞的管腔形成实验,它可从侧面反映毛细血管的早期形成过程,是体外检测内皮细胞功能的指标。血管形成过程中内皮细胞会形成细胞条索,然后形成管腔。在特定条件下如基质胶、胶原等培养时可见到管腔形成[37-38]。本研究显示姜黄素条件培养液低、中、高剂量组可降低细胞水平迁移;中、高剂量组可减少细胞管腔形成;高剂量组还可降低细胞垂直迁移及降低细胞侵袭。
综上所述,本研究结果表明姜黄素可在细胞水平抑制新生血管的形成,其机制可能与AKT/HIF-1α/VEGF信号通路有关。但鉴于姜黄素药理作用复杂,且体外培养的细胞成分单一,其形态、功能和体内均有一定的差别,因此,进一步完善体内实验,证实其在抑制新生血管中的作用将为临床应用奠定坚实基础。

