IL-10在青光眼引流物材料植入术后瘢痕组织中的动态表达
张康玉,蒋正轩,陶黎明,鲍 宁,李 凯,刘 勇
0引言
青光眼是一类以眼内压的相对或绝对升高引起视神经损害及视功能不可逆损伤为特征的眼科常见疾病,以发病率高、病情复杂、术后并发症较多及手术成功率较低为主要特点[1]。而难治性青光眼是一组病因多样、病情复杂、治疗棘手的疾病,青光眼引流物最初的引入即是为治疗难治性青光眼,目前该方法仍是难治性青光眼主要的治疗手段[2],然而手术成功率仍相对较低,青光眼引流阀植入术后早期和晚期成功率分别约80%和50%[3],其主要原因为术后阀体周围严重的炎症及免疫反应,成纤维细胞和胶原纤维增生包裹,致引流不畅,眼内压再次升高[4]。术后炎症反应在术后瘢痕形成过程中起到重要作用,而相关研究显示白细胞介素(IL)类炎症因子在术后炎症细胞浸润、组织损伤及修复过程中发挥着重要作用[5]。已有研究显示IL-10不仅具有炎症抑制和免疫调节作用[6-7],亦具有抑制矽肺、炎性肠道疾病及肝纤维化的作用[8-10],而在青光眼引流物植入术后纤维化过程中的作用研究较少。因此本研究通过不同的引流物材料植入及抗纤维化药物的应用,拟在球结膜下形成不同的瘢痕组织,检测并比较术后各组织中不同时间段IL-10的表达水平,揭示其对青光眼引流物植入术后炎症及纤维化的影响,为探讨其在青光眼引流物植入术后瘢痕化的作用提供实验依据。
1材料和方法
1.1材料购置标准新西兰大白兔75只(约2.5kg)并饲养于安徽医科大学动物实验室。表面涂裹聚一氯对二苯(Parylene C)的聚甲基丙烯酸甲酯(PMMA)材料由美国加州大学提供,丝裂霉素C(MMC)、硅胶块由安徽医科大学第二附属医院提供。主要试剂:ELISA试剂盒(Elabscience公司),RNA提取试剂盒(Magen公司、R4130-03),逆转录试剂(Vazyme公司、R222-01),实时荧光定量PCR(RT-PCR)试剂盒(Vazyme公司、SYBR Green Master Mix),兔抗兔IL-10多克隆抗体(北京Bioss,bs-0698R),辣根过氧化酶标记山羊抗兔IgG(H+L)二抗(北京中杉金桥公司,ZB-2301)。主要仪器设备:光学显微镜、石蜡切片机、RT-PCR仪(Aglient Technologies公司、型号:Stratagen Mx3000P)、分光光度计(Thermo公司、型号:NANODROP 2000c)、逆转录仪(MJ Research公司、型号:PTC-100)、酶标仪(Cloud-Clone公司、型号:SMR16.1)、荧光显微镜(日本Olympus公司)[11]。本研究经安徽医科大学生物医学伦理委员会审批通过。
1.2方法
1.2.1实验动物分组及造模采用随机数字表法将75只新西兰大白兔分为3组、每组25只:PMMA组、硅胶-MMC组及硅胶组。选择左眼为手术眼,术前3d术眼点抗生素眼液,每天4次,预防感染。术前行全身麻醉(戊巴比妥钠注射液耳缘静脉给药、40mg/kg),缝线悬吊开睑,聚维酮碘冲洗结膜囊,以穹窿为基底部作球结膜瓣,向上充分分离并植入5mm×5mm引流物材料块(PMMA组在球结膜下植入聚一氯对二苯涂层包裹的PMMA块;硅胶-MMC组于球结膜下植入硅胶块,同时注射0.4mg/mL的丝裂霉素C 1mL;硅胶组于球结膜下植入硅胶块),间断缝合球结膜瓣,结膜囊涂左氧氟沙星眼膏。分别于术后第1、3d,1、2、3、4、8wk,全身麻醉下取前房水;于第1、2、3、4、8wk,过量麻醉致死后取出植入物周边结缔组织(包括部分黏连巩膜),切割均分、称重、清洗(9%氯化钠注射液),分别置于冰箱(-80℃)和多聚甲醛溶液(10%)中保存。
1.2.2ELISA检测房水中IL-10蛋白的含量收集兔前房水,采用ELISA试剂盒检测房水中IL-10蛋白的含量,具体步骤按照试剂盒说明书进行操作。酶标仪测定吸光度(A)值,分别绘制三组蛋白标准曲线,计算相对质量浓度。为了确保结果的可靠性,每个样本均进行3次检测后取平均值。
1.2.3RT-PCR检测结缔组织中IL-10mRNA相对表达量根据RNA提取、逆转录及SYBR Green Master Mix试剂盒操作说明,首先提取总RNA,测定其质量及浓度,再合成cDNA,荧光定量测定。为确保测定结果的可靠性,在荧光定量测定过程中,对每个样本均进行3次检测后取平均值,采用2-ΔΔCt(ΔCt=sample-control)法计算IL-10 mRNA相对表达量。RT-PCR引物由通用生物公司在线设计及合成。内参GAPDH前引物:AGCTGGTCATCAACGGGAAG,后引物:GGTTCACGCCCATCACAAAC;IL-10前引物:GAACCACAGTCCAGCCATCA,后引物:CTCCACTGCCTTGCTCTTGTT。
1.2.4石蜡切片的制备将多聚甲醛溶液固定的组织经梯度乙醇充分脱水,二甲苯及无水乙醇透明,浸蜡包埋,连续切片(厚度5μm),载玻标记、烘干保存。
1.2.5HE染色法取1.2.4石蜡切片,复温,二甲苯、乙醇浸泡脱蜡,苏木精-伊红(HE)染色法染色,封片保存。高倍显微镜(400×)下观察切片组织、拍摄照片、计数成纤维细胞数。
1.2.6免疫组织化学染色取1.2.4石蜡切片,常规脱蜡、高压修复抗原,加对应一抗、生物素化二抗、链霉素工作液,显色并封片保存。高倍显微镜(400×)下观察并拍照。以组织中出现棕褐色染色为阳性。通过Image Pro Plus 6.0图像分析系统采集、分析处理图像,计数平均吸光度(A)值,测定3个视野,取平均值。
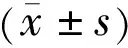
2结果
2.1HE染色观察成纤维细胞增生和炎症细胞浸润情况高倍镜(400×)下观察术后成纤维细胞增生明显的结缔组织(图1)。第1wk,硅胶-MMC组、PMMA组和硅胶组组织中均存在细胞核增大、深染、分裂相增多、炎症细胞浸润的现象,但硅胶组较其他两组更显著。第2wk,各组组织中炎症细胞浸润均较第1wk时减轻,成纤维细胞增生,硅胶组炎症细胞最多,硅胶-MMC组炎症细胞最少。与第2wk相比,第3wk各组组织中成纤维细胞增多,炎症细胞明显减少,其中硅胶组仍然最多,硅胶-MMC组最少。与第3wk相比,第4wk各组组织中成纤维细胞明显增多,胶原纤维增生,而炎症细胞明显减少,硅胶组较PMMA组及硅胶-MMC组可见更为紊乱的成纤维细胞、密集交错分布的胶原纤维,仍伴有明显炎症细胞浸润,硅胶-MMC组仍为最少。第8wk,各组组织中均可见较致密的胶原纤维交错呈旋涡状或波纹状等多样性紊乱排列,硅胶组仍有少量炎症细胞浸润,其他两组无明显炎症细胞。

图1 HE染色观察成纤维细胞增生和炎症细胞浸润情况 蓝色箭头:炎症细胞;红色箭头:成纤维细胞。
2.2免疫组织化学染色观察IL-10蛋白表达情况高倍镜(400×)下观察可见术后PMMA组、硅胶-MMC组和硅胶组结缔组织中均存在大量的呈棕褐色染色的IL-10蛋白,围绕巩膜表面增生的成纤维细胞分布(图2)。第1wk,IL-10在三组组织中的表达均明显增多,硅胶组最显著,硅胶-MMC组最少(F=19.791,P<0.001);第2wk,IL-10在三组组织中的表达均较第1wk减少,硅胶-MMC组最少,硅胶组仍最多(F=20.047,P<0.001);第3wk,IL-10在三组组织中的表达均较第2wk减少,硅胶组较其他两组稍高,而PMMA组与硅胶-MMC组无明显差异(F=7.521,P=0.008);第4wk,IL-10在三组组织中的表达均较第3wk有所增加,硅胶组高于其他两组,PMMA组与硅胶-MMC组亦无明显差异(F=6.826,P=0.010);第8wk,IL-10在三组组织中的表达较第4wk均明显增多,增生细胞仍围绕胶原纤维分布,硅胶组表达最多,瘢痕组织较少的硅胶-MMC组表达最少(F=12.382,P=0.001),见图3。
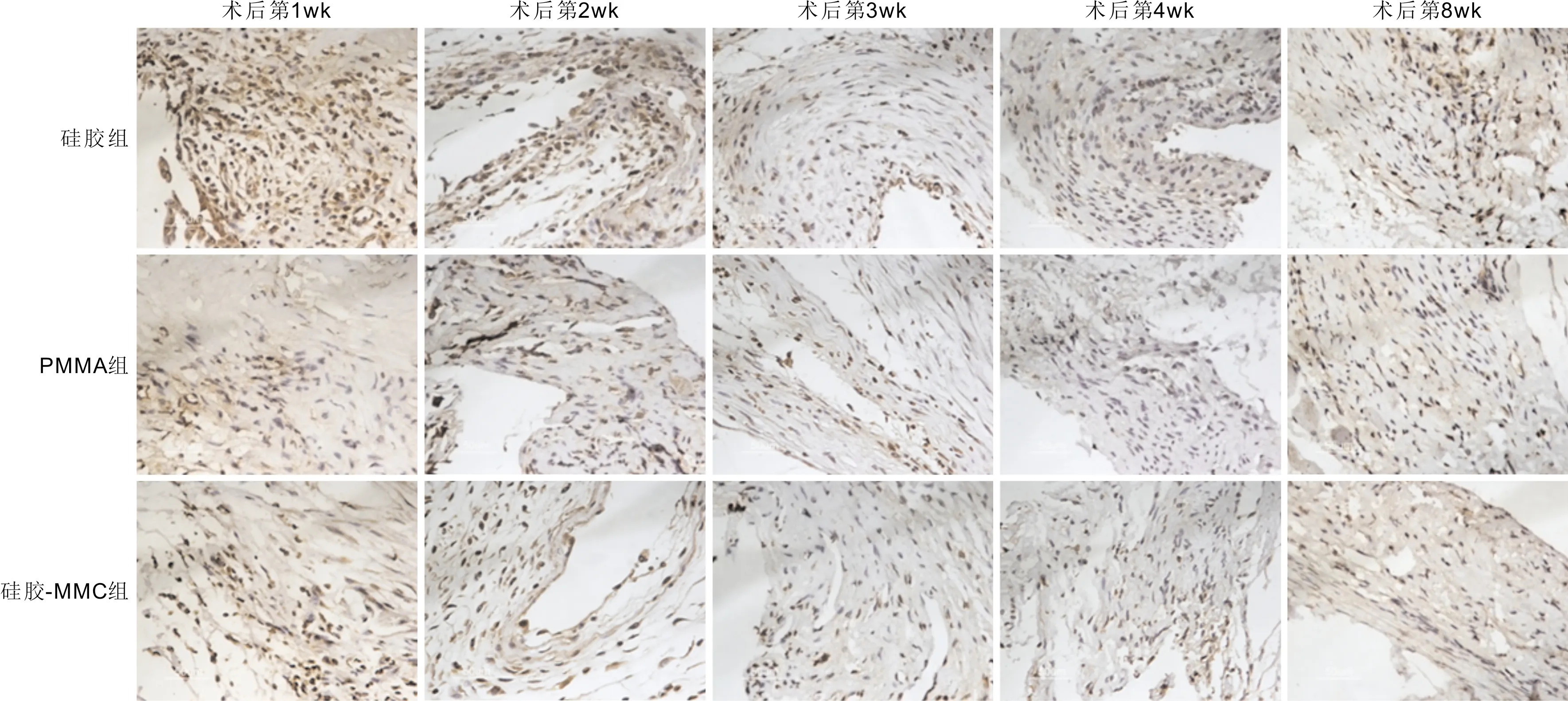
图2 免疫组织化学染色观察IL-10蛋白表达情况。

图3 三组IL-10蛋白表达水平比较 aP<0.05 vs 硅胶组;cP<0.05 vs PMMA组。
2.3ELISA检测房水中IL-10的表达术后三组房水中IL-10的表达呈现先增高再降低的趋势,第3d达高峰。术后第1d~3wk,硅胶组房水中IL-10表达均明显高于PMMA组与硅胶-MMC组,且术后第1~3d硅胶-MMC组房水中IL-10表达高于PMMA组;术后第1wk,PMMA组房水中IL-10表达高于硅胶-MMC组;术后第2~3wk,PMMA组与硅胶-MMC组房水中IL-10的表达无明显差异;术后第4~8wk,三组房水中IL-10的表达均无明显差异(F第1d=11.091,P第1d=0.002;F第3d=20.701,P第3d<0.001;F第1wk=28.039,P第1wk<0.001;F第2wk=13.818,P第2wk=0.001;F第3wk=8.141,P第3wk=0.006;F第4wk=2.208,P第4wk=0.153;F第8wk=2.759,P第8wk=0.103),见图4。
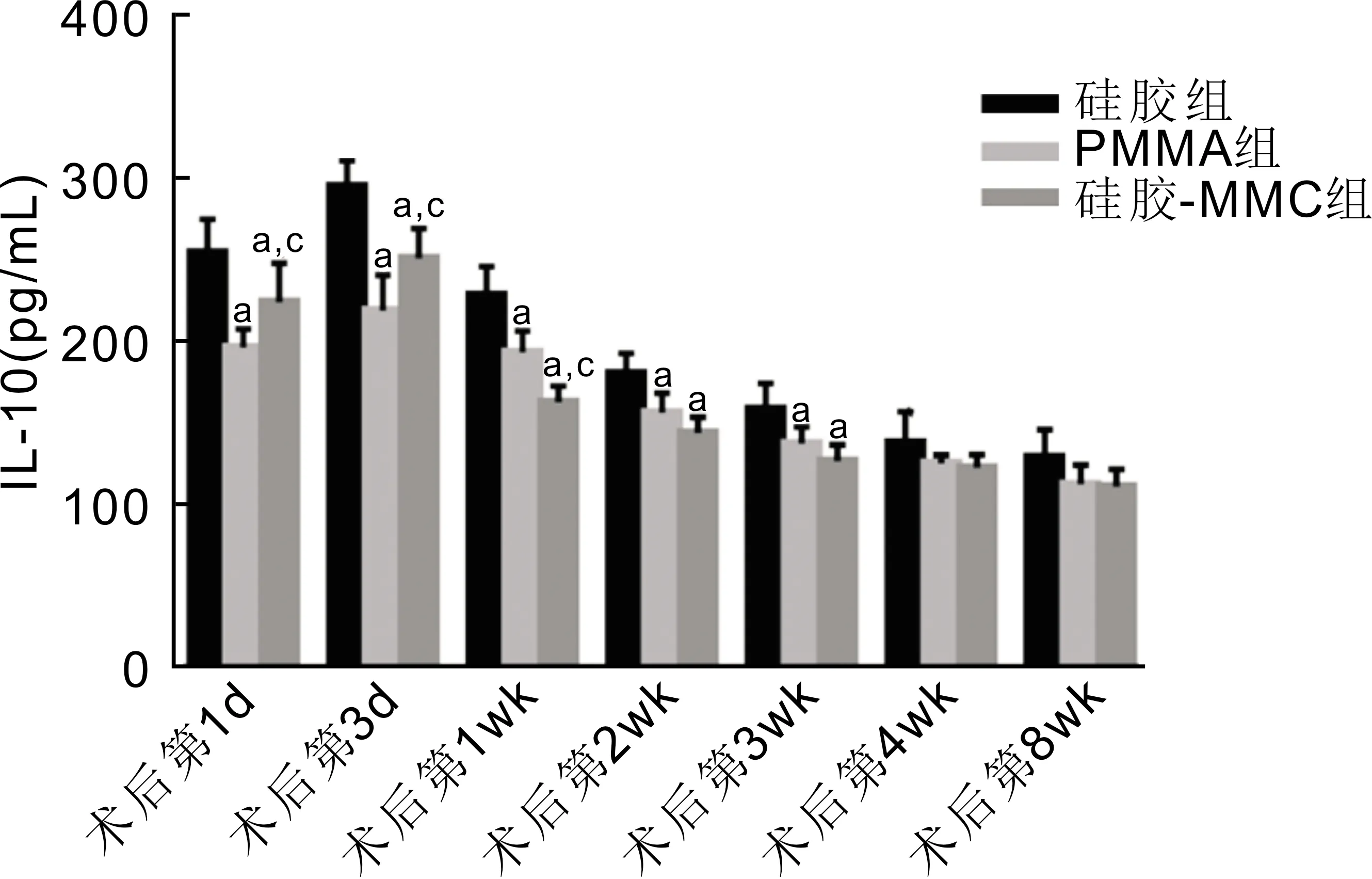
图4 三组房水中IL-10的表达 aP<0.05 vs 硅胶组;cP<0.05 vs PMMA组。
2.4RT-PCR检测结缔组织中IL-10mRNA的表达术后三组结缔组织中IL-10 mRNA表达均明显增高,但硅胶组增高最明显,与PMMA组、硅胶-MMC组比较均有差异;术后第1、2、8wk,PMMA组与硅胶-MMC组IL-10 mRNA表达亦有差异(F第1wk=17.757,P第1wk<0.001;F第2wk=26.941,P第2wk<0.001;F第3wk=6.283,P第3wk=0.014;F第4wk=14.418,P第4wk=0.001;F第8wk=41.615,P第8wk<0.001),见图5。
图5 三组IL-10 mRNA相对表达量 aP<0.05 vs 硅胶组;cP<0.05 vs PMMA组。
2.5IL-10表达水平与成纤维细胞数的相关性分析术后第4、8wk,高倍显微镜(400×)下,单位面积HE染色切片中成纤维细胞数与免疫组织化学染色中IL-10的表达水平均呈正相关(r=0.712、0.695,均P<0.05),见图6。

图6 三组组织中IL-10表达水平与成纤维细胞数的相关性分析 A:术后第4wk;B:术后第8wk。
3讨论
青光眼是致视神经不可逆性损伤的眼病,以眼球胀痛、视力下降及特征性视野缺损为主要表现;高发病率[12-13]、视功能损伤不可逆性、难治性等为主要特征;控制眼内压仍是目前主要的治疗方法[3]。难治性青光眼是最复杂的一组青光眼疾病,包括外伤性青光眼、角膜移植术后继发性青光眼、无晶状体或人工晶状体植入术后青光眼、新生血管性青光眼、多次手术失败的青光眼等。青光眼引流物植入术是抗青光眼的有效治疗方法,亦是难治性青光眼的首选手术方法[2];青光眼引流物材料以硅胶、PMMA较为多见,作为异物,植入球壁后易诱发机体炎症反应、免疫排异反应及成纤维细胞增生,导致瘢痕组织包裹植入物、引流受阻,手术失败。因此检测青光眼引流物植入术后瘢痕化组织中抑炎因子IL-10的表达及探讨其对瘢痕化形成的影响有着极其重要的意义。
不同材料的青光眼引流物具有不同的组织相容性,植入后可引起不同的炎症及免疫反应[14],MMC为链霉素中提取的抗代谢药物,具有抗纤维组织增生作用,在临床已广泛应用[15]。Parylene C是一种惰性的高分子材料,因具有良好的生物相容性及化学稳定性,涂抹于青光眼引流物外层可以有效降低术后局部组织的炎症反应及成纤维细胞增生[11]。本研究选择不同的材料植入兔球结膜下,再选择性注射MMC,预计术后各组球结膜下形成不同的瘢痕。HE染色显示,硅胶组术后早期的炎症反应及晚期瘢痕化水平最高;因MMC药物的刺激作用,术后早期硅胶-MMC组的炎症反应高于PMMA组,但至术后第1wk,PMMA组炎症因子的表达较硅胶-MMC组高,PMMA组的成纤维细胞增生及晚期瘢痕化水平亦较硅胶-MMC组高。提示本研究中各组不同时期形成不同的炎症反应及瘢痕化组织。
IL-10是在炎症反应中发挥抑制作用的因子,是由辅助性T2(Th2)细胞产生,具有抑制辅助性T1(Th1)细胞分泌作用,由嗜酸性粒细胞、巨噬细胞、T细胞、B细胞、树突细胞、肥大细胞、NK细胞等分泌,具有抗炎、抗免疫、抗纤维化及促进修复等作用的多功能细胞因子[16-17]。IL-10的炎症抑制作用在大量研究中得以证明,其可以抑制单核细胞、巨噬细胞,抑制肿瘤坏死因子-α(TNF-α)、IL-1β、IL-6、IL-8、粒细胞集落刺激因子(G-CSF)等促炎因子的释放,同时诱导炎症因子的自噬作用[18];亦可抑制T细胞增生和其细胞因子的产生,如可以抑制CD4+细胞分化所必需的IL-23、IL-12等因子的分泌[7,19];而且通过降低组织相容性复合体(MHC)和黏附分子的表达抑制排异反应抗原,干扰抗原传递,抑制免疫反应[20]。
IL-10对成纤维细胞增生及瘢痕化的作用也有大量研究,但具体作用目前尚不统一。Kathju等[21]研究显示IL-10可以通过抑制炎症及免疫反应,同时分解增生的细胞基质,抑制成纤维细胞增生及瘢痕形成。IL-10在尘肺的形成中具有抑制肺炎症反应的作用,而晚期因对淋巴细胞的抑制作用,具有促进肺泡纤维化的增生作用[22]。Xie等[23]对瘢痕增生的研究发现,创伤后IL-10的高表达不仅具有抑制促炎因子(IL-1β、TNF-α、IL-6等)的分泌,减轻炎症反应及抑制细胞外间质细胞增生的作用,同时可以抑制生长因子[转化生长因子-β(TGF-β)、血小板衍生生长因子(PDGF)等]的释放,维持细胞外基质合成和降解的平衡,抑制瘢痕形成。本研究显示,IL-10 mRNA及蛋白的表达在术后早期炎症反应明显时增加,炎症反应减轻时降低,在瘢痕化最明显的硅胶组表达最高,在瘢痕化最轻的硅胶-MMC组表达最低;免疫组织化学染色结果显示,IL-10主要集中在增生的成纤维细胞周围;在术后第4~8wk,炎症反应减轻而胶原纤维增生明显时,IL-10的表达不减反增。上述结果表明抑炎因子IL-10不仅在术后早期炎症反应严重时增加,抑制炎症作用,而且在术后晚期成纤维细胞及胶原纤维增生时增加,抑制其增生作用。
综上所述,IL-10在青光眼引流物材料植入术后早期炎症反应明显时表达增高,炎症反应减轻时减少,晚期胶原纤维增生时再次升高,提示IL-10可能在青光眼引流物植入术后早期有抑制炎症的作用,晚期有抑制胶原纤维增生,减轻瘢痕化的作用。

