猫瘟热病毒血凝抑制与血清中和抗体滴度关系研究
张 峻,肖春燕
(1.上海应用技术大学,上海 201418;2.成都信息工程大学物流学院,四川 成都 610103)
猫泛白细胞减少症病毒(FPV,同猫瘟热病毒)是一种单链 DNA病毒,是原细小病毒属中食肉动物原细小病毒中的一种[1]。FPV同犬细小病毒(CPV)和水貂肠炎病毒均能够导致家猫及野猫因急性肠胃炎和骨髓抑制等急性致死症状而死亡[2]。FPV可通过猫口腔和鼻腔侵入动物体内,对咽喉淋巴等组织造成感染,并通过血液循环系统致病动物全身[3],因此血液中是否存在抗FPV抗体对预防及治疗猫瘟热十分重要。对家猫和野猫接种抗FPV疫苗是预防此疾病的重要手段。目前我国针对猫泛白细胞减少症使用的疫苗多为硕腾三联灭活疫苗(妙三多)和英特威三联微毒疫苗[4],接种这类疫苗后可能存在因疫苗自身因素、动物应激程度、母源抗体以及人为因素等无法形成抗体导致疫苗接种失败[5]。因此,我们可以把测量血液抗FPV抗体滴度作为评估FPV感染免疫状态的方法。血清中和(SN)实验是目前血清学实验中标准较高的一种,因其测得的SN抗体与动物机体感染保护能力密切相关,所以SN特异性病毒血清学实验与其他检测方法相比准确性最高[6]。因SN实验成本过高且耗时过长,目前临床上多利用血凝抑制(HI)实验作为SN实验的简单替代方法,但是FPV抗体检测的准确性低于SN实验[7]。根据目前的研究发现,针对抗CPV抗体的HI和SN实验在抗体滴度数据上相关度较低,但是针对抗FPV抗体的HI和SN实验在抗体滴度比较上的研究较少,因此本实验的主要目的是利用HI实验结果作为FPV保护性抗体效价指标的准确性研究。本实验的结论是通过HI实验提取抗FPV抗体,将结果呈现阴性或弱阳性滴度的猫血清进行SN实验,对2种实验中呈现的抗体滴度结果进行比较研究后得出。
1 实验材料
实验样本是2020年3月至2021年3月通过成都市和重庆市两地宠物医院收集到的806只已接种过FPV疫苗(未区分疫苗品牌)、临床表现健康的家猫血清样本。
病料是2020年3月从重庆市宠物医院1只因感染猫瘟热而出现腹泻症状的家猫体内分离并培养出的FPV-Som4菌株。
2 实验方法
2.1 血凝抑制实验准备
利用HI实验传统方法稍做修改,进行抗FPV抗体滴度检测。将25 mL经过猪红细胞和高岭土处理的热灭活血清样本,在96孔V型底微孔板中用磷酸盐缓冲盐水溶液(PBSS,pH 6.7)以1∶10的比例进行2倍稀释,同时加入等体积FPV-Som4菌株。1 h后将浓度为0.5%的猪红细胞添加到每个板孔中。再经过4℃12 h培养后,得出的抗体滴度即为血凝抑制完全后的最高血清稀释度。
2.2 实验过程
因FPV感染的培养细胞病变作用弱,难以进行SN实验中抗体效价终值的判断,所以还需要对HI实验中各孔感染情况进行检测。在整个实验中,抗体效价是利用96孔组织培养微孔板进行测定分析的。利用一式4份50 μL体积的样本血清从1∶10的比例稀释2倍后,每孔加入100 μL半数组织培养感染剂量(TCID50)的FPV-Som4菌株。再进行1 h培养后将猫肾细胞加入病毒-血清培养液中继续培养5 d,将获得的培养液加入与培养液等体积、浓度为0.5%的猪红细胞96孔V型底微孔板中,即可测定抗体效价。本次实验测定的抗体效价为血凝抑制达50%时的最高血清稀释度。
3 实验结果与分析
3.1 HI实验及SN实验结果数据
利用HI实验测定这806份血清样本时发现,其中有67份(8.3%)样本未检测出FPV抗体(测试滴度<1∶10),15 份样本 HI抗体滴度为 1∶10,26 份样本HI抗体滴度为 1∶20,53 份样本 HI抗体滴度为 1∶40。针对实验结果为阴性及弱阳性的样本再次进行SN实验,获得的实验数据如表1所示。其中,在HI实验结果为阴性的67份样本中有43份 (64.2%)样本利用SN 实验测定存在 FPV 抗体(测试滴度>1∶10)。HI实验测得的抗体呈阴性的样本利用SN实验进行再测试后,滴度范围在<1∶10至 1∶160之间,计算出的几何平均数(GM)为 1∶20.38。

表1 HI检测为阴性及弱阳性样本SN再测试数据表
将 HI实验测得的抗体滴度分别为 1∶10、1∶20及1∶40的所有样本重新进行SN实验后,测得的SN抗体滴度数据分布如图1所示。其中,SN实验测得的抗体滴度范围在 1∶13 至 1∶200 时几何平均数为 1∶67.51,抗体滴度范围在 1∶80至 1∶650时几何平均数为 1∶273.89,抗体滴度范围在1∶120至1∶1500时几何平均数为1∶547.51。以往的文献显示,利用HI实验测定抗体滴度的保护阈值设定为1∶20是最高的,但是本次研究发现,实验存在 52.2%(35/67)HI抗体滴度<1∶10 的样本及20%(3/15)HI抗体滴度为1∶10的样本低于该阈值。
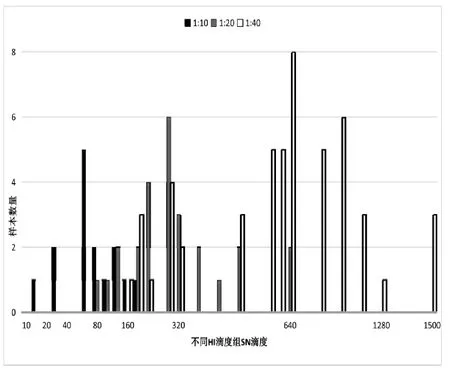
图1 抗体弱阳性检测对比图
3.2 数据处理及分析
根据HI实验抗体滴度数据算出各滴度组中SN实验抗体滴度倒数对数值的平均值及标准差分别为1.886±0.774(<1∶10)、1.836±0.314(1∶10)、1.874±0.180(1∶20)和 1.709±0.159(1∶40),利用平均值及标准差计算出的变异系数 (CV) 值分别为 41.04%(<1∶10)、17.10%(1∶10)、9.61%(1∶20)和 9.30%(1∶40)。将 SN 实验测得的滴度平均值作为X值,对应的HI实验滴度组作为Y值利用皮尔森相关系数公式:
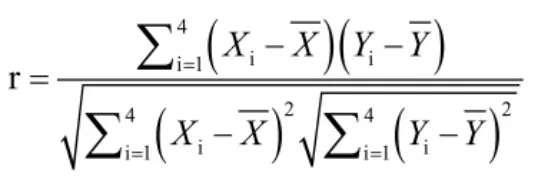
经公式计算r结果为0.747。将整体计算结果结合对应变异系数,各HI实验测得滴度组分布情况直观展现如图2所示。因皮尔森相关系数值为0.747,比较接近1,说明2种实验在抗体效价之间的相关性较高。但是根据变异系数显示,当利用HI实验测得的抗体滴度<1∶10时,样本存在一定程度变异(41.04%)。在后续实验中对近期接种过疫苗的动物个体进行性别、品种和年龄抽样时,并未发现与实验总体分析结果有差异。

图2 滴度组相关性示意图
在以往针对CPV的研究中发现,其中和表位及血凝素位在VP2抗原上处于不同位置[8],说明利用HI实验并不一定能够有效反映出中和能力。目前的研究并未发现FPV也有这样的特性,但是因FPV与CPV属于相同种属的病毒,其可能具有相似的形态学特征。针对本次研究,在进行HI实验及SN实验时,抗体滴度的皮尔森相关系数值为0.747,证明两者在抗体效价间的相关性较高,但是利用HI实验测得滴度<1∶10时SN实验抗体滴度的变异系数较高,显示两者间存在一定的不一致。另外,在64.2%的样本中利用HI实验测试结果为阴性的样本在经过SN实验后检测到存在FPV抗体,证明利用HI实验测试抗体敏感度较SN实验低,这与之前的相关研究一致,可能是因实验本身性质及FPV病毒性特性导致的。就目前的文献来看,少有研究FPV不同疫苗间的反应率。但是根据部分文献显示,存在部分动物个体在16周后定时接种3次及以上疫苗后利用HI实验检测并未发现FPV抗体,可能因动物个体或部分品牌疫苗效能不足导致抗体经HI实验测得结果有差异。因此,针对部分已完成FPV疫苗接种但利用HI实验无法测得存在抗体的个体可利用SN实验进行重新测定,以保证抗体检测的准确性。
综上所述,本研究的结论是利用SN实验测得的对FPV疫苗效果,尤其是在HI测定抗体滴度结果为阴性及弱阳性猫中的准确性优于HI实验测定。
4 结论与展望
根据实验结果,建议用1∶20至1∶40的滴度作为FPV保护性HI抗体滴度阈值。但就目前现有文献及相关研究而言,针对设定这类阈值的参考基础尚不明确,因此本实验对FPV保护性HI滴度阈值的测量是基于将SN抗体滴度阈值设定在1∶10至1∶32的实验感染结果范围内进行的。SN抗体滴度为1∶32是实验中显示SN抗体阈值中最高的,即在所有HI抗体滴度为1∶20或更高比例的猫个体中是最高的。因此,在将HI抗体效价作为指标评价FPV保护能力时,将阈值设定为1∶20可能是最为合适的。
在本次实验过程中,为了避免因母源抗体对测试结果造成影响,在样本选择过程中我们均选择了7月龄以上的猫,因此所有检测到的抗FPV抗体均是主动免疫的产物。但是实验结果显示,利用HI方法进行测试无法检测到抗体数量占比较高。因本实验原理的局限性所致,利用HI测试可能无法检测到此类病毒感染而产生的抗体,同时尽管两种测试间的不一致可能仅是因HI测试的灵敏性低造成的,但是结果不能排除本实验中存在一定的动物个体已经感染了FPV,在使用HI测试时需要考虑这种可能。
因本文的目的是为了比较HI与SN之间的差距,未对不同品牌FPV疫苗性能进行评估,因此在未来相关研究工作中可根据同一疫苗接种动物进行。同时因CPV与FPV病毒属性的相似性,也可在未来对CPV进行HI准确性研究。

