JNK信号通路在氧化应激诱导的小鼠施万细胞自噬过程中的调控机制*
张晓莉, 裴雨洋, 于天水
JNK信号通路在氧化应激诱导的小鼠施万细胞自噬过程中的调控机制*
张晓莉, 裴雨洋▲, 于天水△
[证据科学教育部重点实验室(中国政法大学),司法文明协同创新中心,北京 100088]
探讨c-Jun氨基末端激酶(JNK)信号通路在氧化应激(OS)诱导的施万细胞自噬中的作用及相关机制。体外常规培养小鼠坐骨神经施万细胞,利用缺糖缺氧后复糖复氧建立施万细胞OS模型,并对已经OS的小鼠施万细胞施加JNK抑制剂SP600125。将细胞分为正常对照组、OS组、OS+DMSO组、OS+SP600125 (2 d)组、OS+SP600125 (4 d)组和OS+SP600125 (6 d)组(=5)。采用RT-qPCR、细胞免疫荧光染色和Western blot检测JNK1/2、叉头框蛋白O1/3(FoxO1/3)、自噬相关蛋白7/8(Atg7/8)和微管相关蛋白1轻链3-I/II(LC3-I/II)的mRNA和蛋白表达水平。OS后小鼠施万细胞中JNK1/2和FoxO1/3表达显著增加(<0.05),Atg7/8和LC3-II的表达水平亦显著升高(<0.05),LC3-I则反之。随着JNK抑制剂SP600125作用时间的延长,小鼠施万细胞中自噬相关蛋白(Atg7、Atg8和LC3-II)与FoxO1/3表达趋势一致,均呈时间规律性下降。JNK可能通过激活其下游FoxO1/3,促进自噬相关蛋白表达,从而导致OS后小鼠施万细胞发生自噬。
c-Jun氨基末端激酶;叉头框蛋白O;氧化应激;施万细胞;自噬
冠心病患者心脏结构上会发生的一系列病理生理改变,如心肌细胞坏死、凋亡、自噬(autophagy)、炎症细胞浸润、心肌纤维化及瘢痕、心室壁变薄及扩张等,称为心肌重构(myocardial remodeling)[1]。但近年来研究发现,心肌梗死后不仅发生心肌重构,支配该区域的交感神经也会出现类似病理变化,即交感神经重构(sympathetic nerve remodeling),表现为去神经支配、交感神经芽生(sympathetic nerve sprouting)及交感神经分布密度增高(sympathetic hyperinnervation)[1]。但是心肌梗死后发生交感神经重构的分子机制尚不完全清楚。目前可以肯定的是心肌梗死会引起氧化应激(oxidative stress, OS)反应,使支配该区域的交感神经施万细胞通过自噬清除髓鞘碎片,由此决定着交感神经芽生的进程。本研究采用缺糖缺氧/复糖复氧诱导小鼠施万细胞OS,模拟体内心肌梗死后交感神经的状态,探讨c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路在OS诱导的小鼠施万细胞自噬过程中的作用机制。
材料和方法
1 主要实验试剂
兔抗叉头框蛋白O1(forkhead box protein O1, FoxO1)抗体(ab52857)和兔抗FoxO3抗体(ab47285)均购自Abcam;小鼠抗GAPDH抗体(60004-1-Ig)、小鼠抗JNK1抗体(66210-1-Ig)、兔抗JNK2抗体(51153-1-AP)、小鼠抗自噬相关蛋白7(autophagy-related protein 7, Atg7)抗体(67341-1-Ig)、兔抗Atg8抗体(11010-1-AP)、兔抗微管相关蛋白1轻链3-I(microtubule-associated protein 1 light chain 3-I, LC3-I)抗体(18722-1-AP)、Cy3标记的山羊抗小鼠IgG(SA00009-1)、Cy3标记的山羊抗兔IgG(SA00009-2)和FITC标记的山羊抗兔IgG(SA00003-2)均购自Proteintech;兔抗LC3-II抗体(3868)购自Cell Signaling Technology;辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗兔IgG(ZB-2301)和HRP标记的山羊抗小鼠IgG(ZB-2305)均购自北京中杉金桥生物技术有限公司;JNK抑制剂SP600125(HY-12041)购自MedChemExpress;BCA蛋白定量试剂盒(KGPBCA)购自南京凯基;Hoechst 33258(C1017)和RIPA强效裂解液(P0013B)均购自上海碧云天;ECL发光液(ECL-0011)购自北京鼎国生物技术有限公司;PVDF膜(HATF00010)购自Millipore;蛋白预染Marker(26616)、逆转录试剂盒(#K1622)和SYBR Green PCR试剂盒(F-415XL)均购自Thermo。
2 主要实验仪器
细胞培养箱(Thermo);荧光倒置显微镜(型号IX71,OLYMPUS);超净工作台(型号SW-CJ-1FD,苏州安泰科技有限公司);电泳仪(型号Mini Protean 3 Cell,Bio-Rad);电转仪(型号PS-9,大连竞迈科技有限公司);酶标仪(型号MK3,Thermo);脱色摇床(型号TS-1000,Qilinbeier);一体式化学发光成像系统(ChemiScope 5300,上海勤翔科学仪器有限公司);台式高速冷冻离心机(型号3K15,Sigma);PRISM®7500 Real-Time PCR System(ABI)。
3 主要方法
3.1细胞株小鼠施万细胞系是前期本实验室从清洁级(SPF)新生3日龄ICR小鼠(购自北京维通利华实验动物技术有限公司)的坐骨神经中分离、纯化及传代培养所获得。前期本实验室根据不同条件下活性氧(reactive oxygen species, ROS)及细胞存活率检测结果,成功建立体外缺糖缺氧/复糖复氧诱导小鼠施万细胞OS模型。
3.2分组将小鼠施万细胞分为正常对照(control)组、OS组、OS+DMSO组、OS+SP600125 (2 d)组、OS+SP600125 (4 d)组和OS+SP600125 (6 d)组(=5)。
3.3细胞培养首先制作OS模型,方法如下:小鼠施万细胞(5×105)铺板于6孔板中培养8 d;用无糖培养液洗2次,将细胞培养液换为无糖培养液,放入缺氧培养箱中(95% N2、5% CO2),37 ℃培养3 h;再吸弃培养液,每孔加入DMEM培养液2 mL;放入37 ℃、5% CO2培养箱内继续培养24 h。再对上述已经OS的细胞用JNK抑制剂SP600125(20 μmol/L)分别培养2 d(处理1次)、4 d(处理2次)和6 d(处理3次)。具体方法为每隔2天换液一次,换液时弃去原先培养液,加入新鲜的培养液,同时继续加入SP600125(20 μmol/L)。正常对照组用有糖培养液洗2次,并换为有糖培养液,在正常气体条件下培养相应时间。
3.4RT-qPCR检测以逆转录所得cDNA为模板在96孔板内进行PCR扩增。以GAPDH基因为内参照,按照SYBR Green PCR试剂盒要求配制20 μL反应体系:ddH2O 7.0 μL,SYBR Green qPCR Master Mix (2×) 10.0 μL,上、下游引物各1.0 μL,cDNA溶液1.0 μL。PCR扩增条件:94 ℃ 20 s,55 ℃ 20 s,72 ℃ 20 s,共40个循环。由PRISM®7500 Real-Time PCR System自动采集给出目的基因和内参照的Ct值,mRNA表达量采用2-ΔΔCt进行计算。所有引物均由上海生工公司通过Primer Premier 5.0软件设计并合成,序列见表1。

表1 RT-qPCR引物序列
F: forward; R: reverse.
3.5细胞免疫荧光染色将各组细胞PBS漂洗1次后,4%多聚甲醛固定30 min,0.1% Triton室温下处理15 min,PBS洗2次,5% FBS室温下封闭15 min;加入Ⅰ抗(JNK2和LC3-I抗体,1∶50;JNK1、FoxO1、Atg7和Atg8抗体,1∶100;FoxO3和LC3-II抗体,1∶200),4 ℃孵育过夜;PBS洗3次,加入Cy3标记的山羊抗小鼠IgG、Cy3标记的山羊抗兔IgG或FITC标记的山羊抗兔IgG(均1∶100),37 ℃孵育1 h;室温避光孵育核染色(Hoechst 33258)15 min;荧光显微镜下观察。
3.6Western blot检测(1)蛋白定量:首先绘制标准曲线;在酶标板中加入2.5 μL待测蛋白和17.5 μL PBS,加入200 μL BCA工作液,把酶标板放在振荡器上振荡30 s,37 ℃放置30 min,然后在562 nm下测定吸光度;根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白浓度(g/L),根据样品浓度确定上样量。(2)蛋白样品的制备:在提取的蛋白中加入5× SDS上样缓冲液,混合均匀后,放入沸水中水浴5 min,使蛋白变性,12 000 r/min离心5 min,所得蛋白样品直接上样检测或置于-80 ℃保存。(3)制备聚丙烯酰胺凝胶:根据待检测蛋白分析量大小确定分离胶浓度。将玻璃板清洗干净,晾干后将玻璃板对齐插入夹子中卡紧,将12%分离胶沿玻璃板缓慢注入,然后在胶面上注入适量的水,待胶凝固后将水倒出,用滤纸将剩下的水吸净,沿玻璃板注入5%浓缩胶将剩余空间灌满,插入梳子,将凝胶连同模具一起放入4 ℃冰箱冷却,待胶凝固后将梳子拔出。(4)上样:装好电泳装置,倒入电泳缓冲液,用移液器分别将Marker和25 μg蛋白注入样品孔。(5)电泳:浓缩胶恒定电压80 V、30 min;分离胶恒定电压120 V、60 min,至溴酚蓝接近胶底部时停止电泳,进行转膜。(6)切胶:将玻璃板轻轻撬开,以Marker为对照进行切胶。(7)转膜:将滤纸、PVDF膜剪成与凝胶尺寸大小相同,用甲醇浸泡PVDF膜15 s,使膜由白色变为半透明后放入超纯水中,静置2 min,将处理好的PVDF膜放入转膜缓冲液中平衡15 min,按海绵垫、滤纸、凝胶、PVDF膜、滤纸、海绵垫的顺序叠加在一起,用玻璃棒赶走各层之间的气泡,放入转膜槽中,倒入转移缓冲液。(8)封闭:将膜用TBST漂洗3次,每次5 min,再用5%脱脂奶粉37 ℃缓慢震荡2 h。(9)孵育Ⅰ抗:用封闭液稀释抗体至合适浓度(JNK1抗体,1∶3 000;JNK2抗体、FoxO1抗体、FoxO3抗体、LC3-I抗体和LC3-II抗体,1∶1 000;Atg7抗体,1∶5 000;Atg8抗体,1∶500),4 ℃过夜孵育。(10)孵育Ⅱ抗:TBST冲洗3次,每次1 min,将PVDF膜放入以1∶5000稀释的HRP标记的兔Ⅱ抗或鼠Ⅱ抗溶液中,37 ℃缓慢振荡孵育1 h,TBST冲洗3次,每次5 min。(11)显色:在膜上加入适量的ECL发光液,利用一体式化学发光仪拍摄照片。
4 统计学分析
采用SPSS 17.0软件进行统计分析。计量资料用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析。以<0.05为差异有统计学意义。
结果
1 OS促进小鼠施万细胞JNK1/2和FoxO1/3表达
RT-qPCR结果显示,小鼠施万细胞OS后JNK1、JNK2、FoxO1和FoxO3的mRNA表达水平均比正常对照组显著升高(<0.01),见图1。细胞免疫荧光染色结果显示,与正常对照组相比,小鼠施万细胞OS后JNK1、JNK2、FoxO1和FoxO3荧光强度均显著增强,见图2、3。Western blot结果显示,小鼠施万细胞OS后JNK1、JNK2、FoxO1和FoxO3蛋白灰度值与正常对照组相比均显著增高(<0.01),见图4。
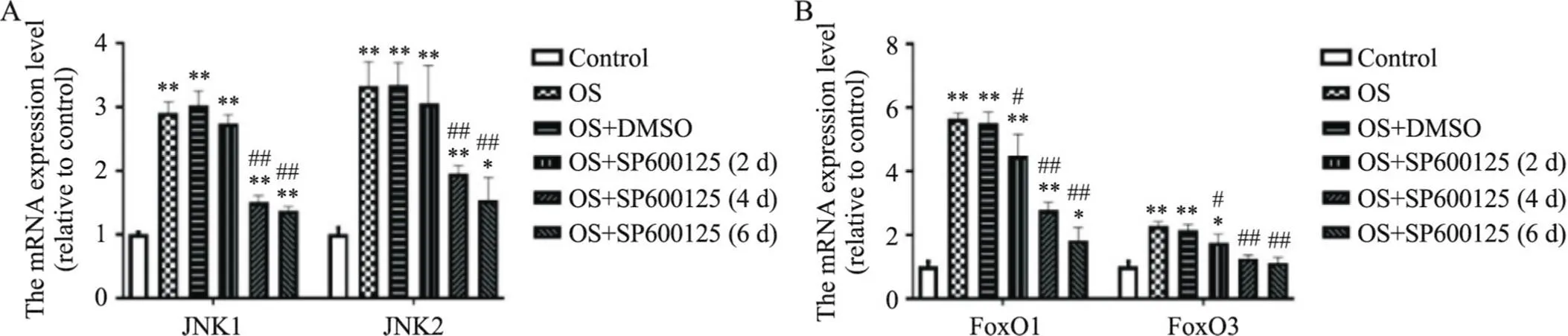
Figure 1. Effects of JNK inhibitor SP600125 on the mRNA expression of JNK1/2 (A) and FoxO1/3 (B) in Schwann cells after oxidative stress (OS). Mean±SD. n=5. *P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs OS group.
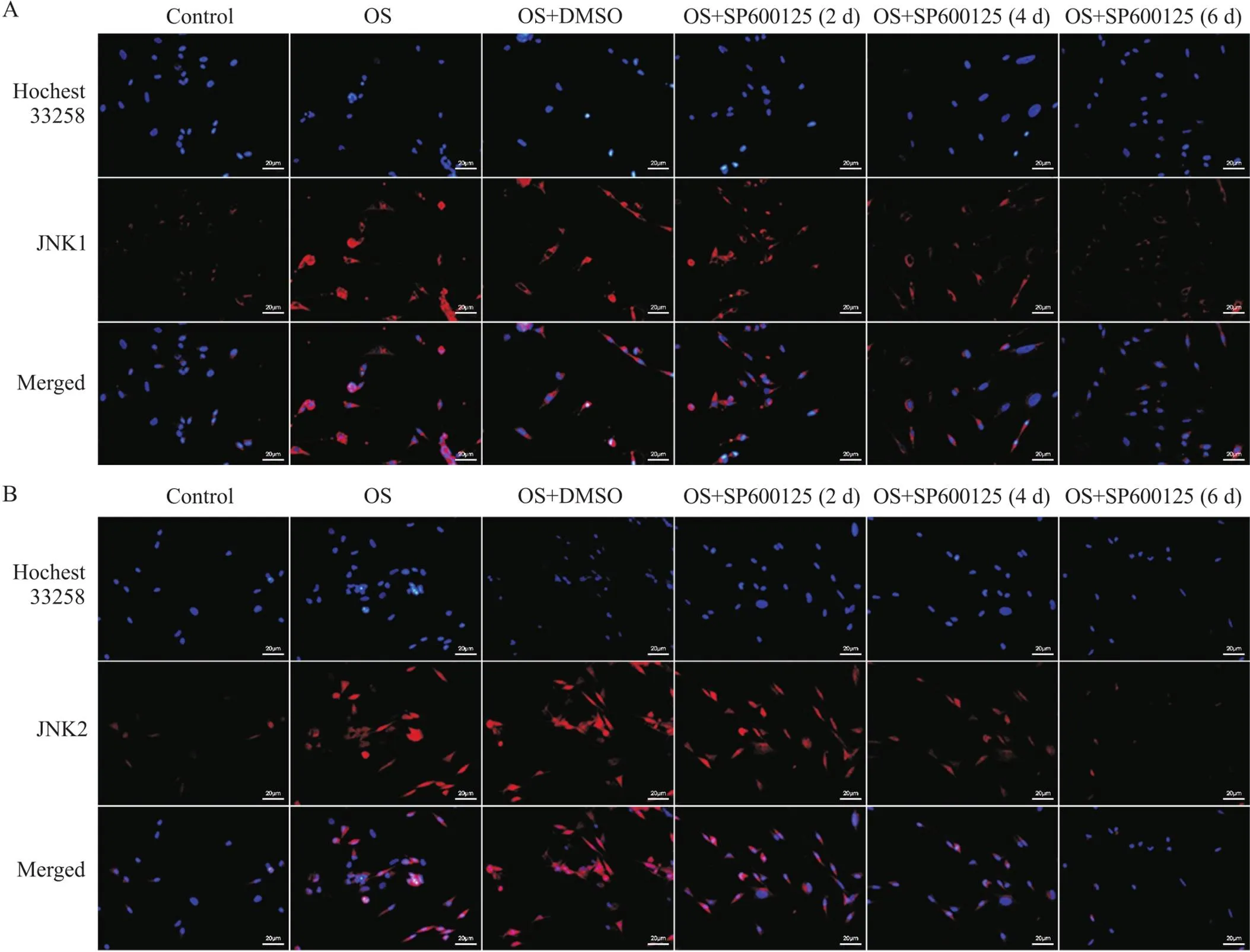
Figure 2. Immunofluorescence staining of JNK1 (A) and JNK2 (B). Scale bar=20 μm.
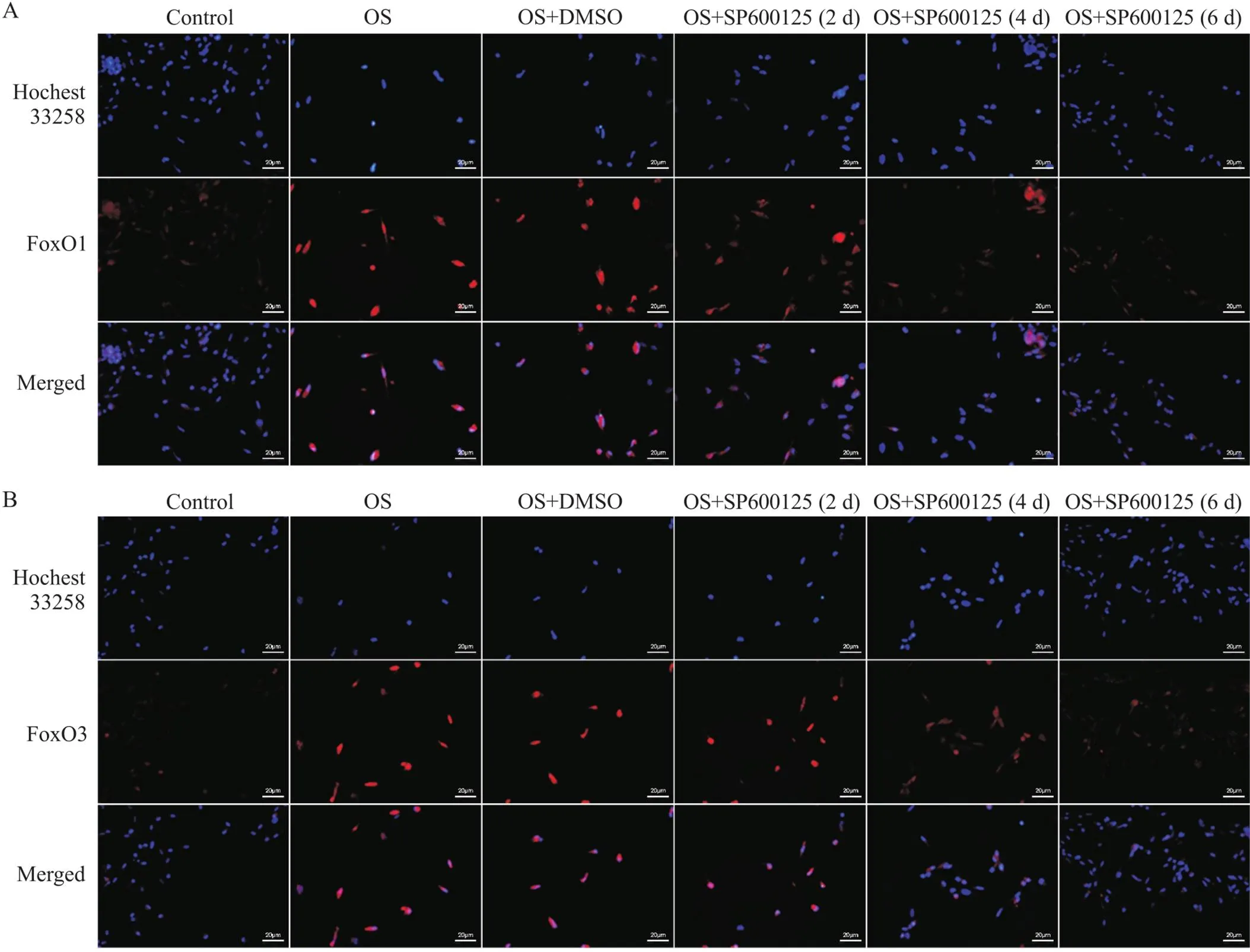
Figure 3. Immunofluorescence staining of FoxO1 (A) and FoxO3 (B). Scale bar=20 μm.
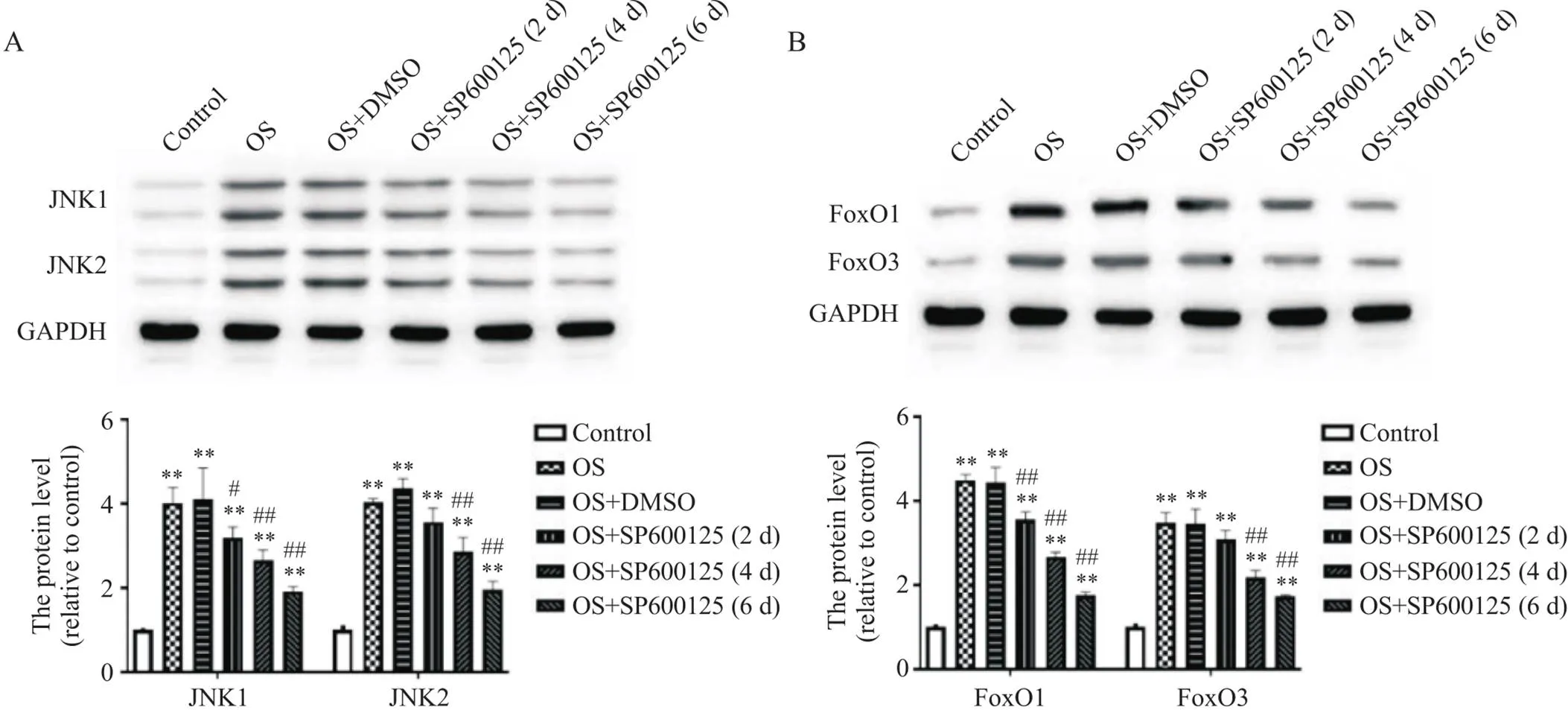
Figure 4. Effects of JNK inhibitor SP600125 on the protein expression of JNK1/2 (A) and FoxO1/3 (B) in Schwann cells after oxidative stress (OS). Mean±SD. n=5. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs OS group.
2 OS诱导小鼠施万细胞自噬增加
RT-qPCR结果显示,小鼠施万细胞OS后Atg7、Atg8和LC3-II的mRNA表达水平比正常对照组均显著升高(<0.01),见图5。细胞免疫荧光染色结果显示,与正常对照组相比,小鼠施万细胞OS后Atg7、Atg8和LC3-II荧光强度均显著增强,见图6、7。Western blot结果显示,小鼠施万细胞OS后Atg7、Atg8和LC3-II蛋白灰度值与正常对照组相比均显著升高(<0.01),见图8。然而,OS后LC3-I的mRNA和蛋白表达水平均显著降低,见图5~8。
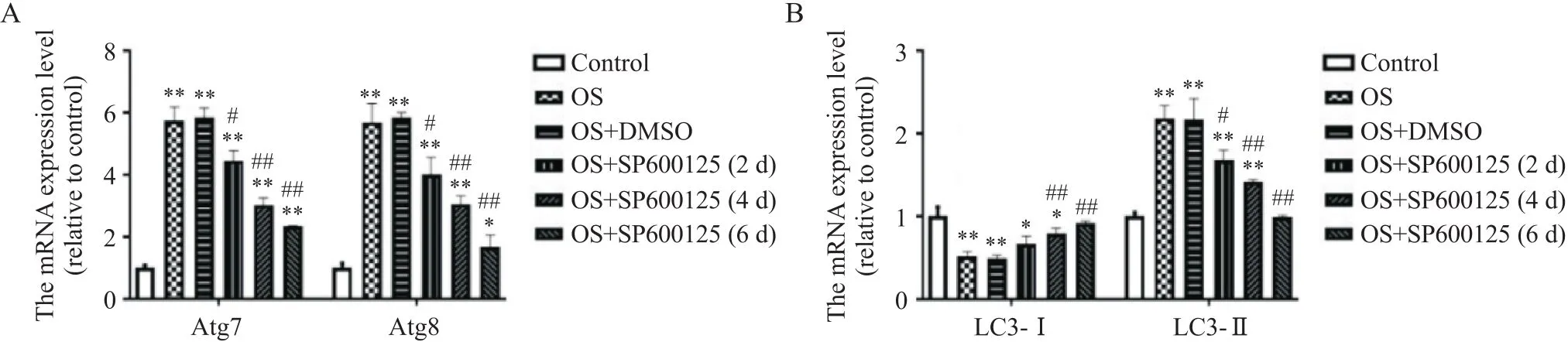
Figure 5. Effects of JNK inhibitor SP600125 on the mRNA expression of Atg7/8 (A) and LC3-I/II (B) in Schwann cells after oxidative stress (OS). Mean±SD. n=5. *P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs OS group.
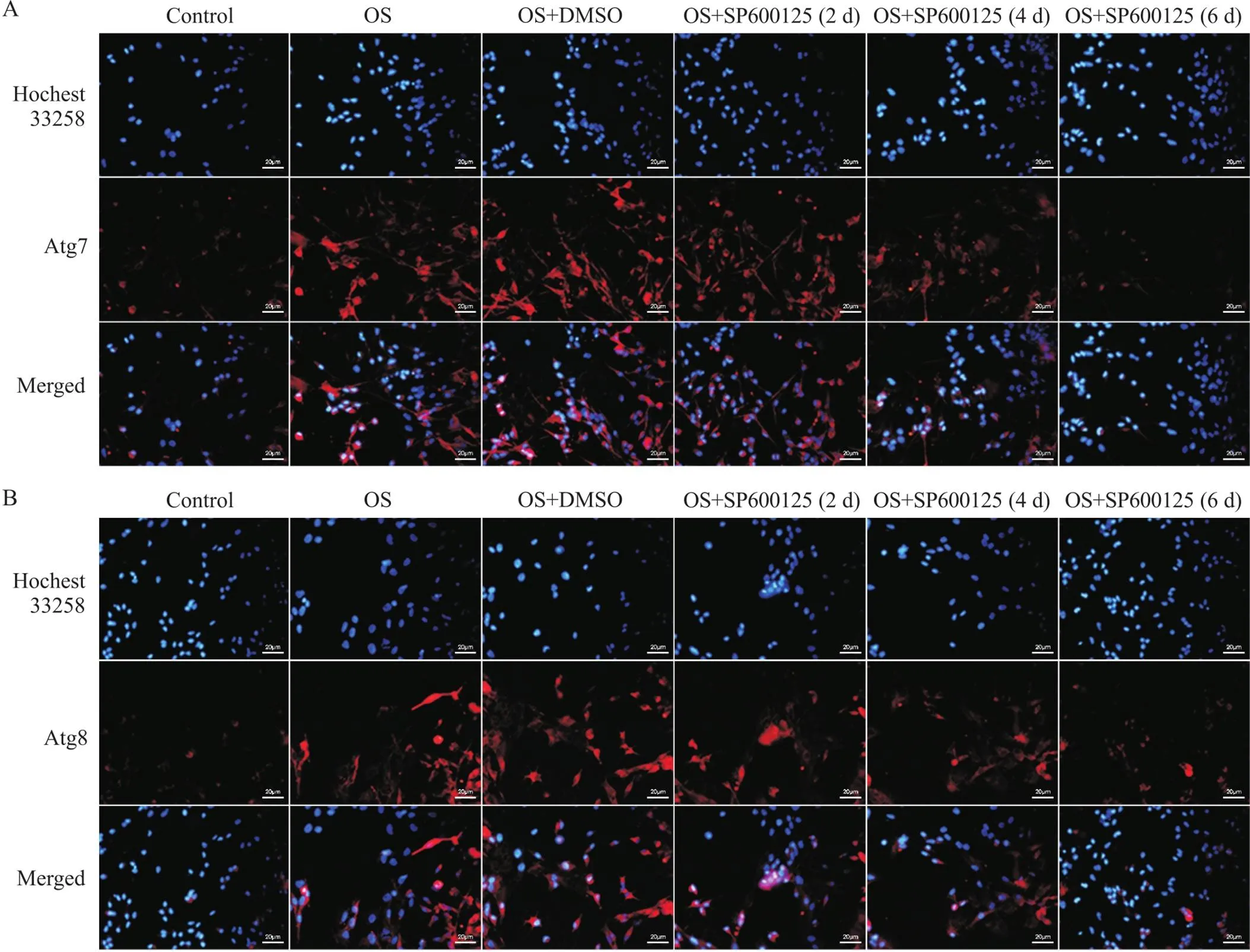
Figure 6. Immunofluorescence staining of Atg7 (A) and Atg8 (B). Scale bar=20 μm.
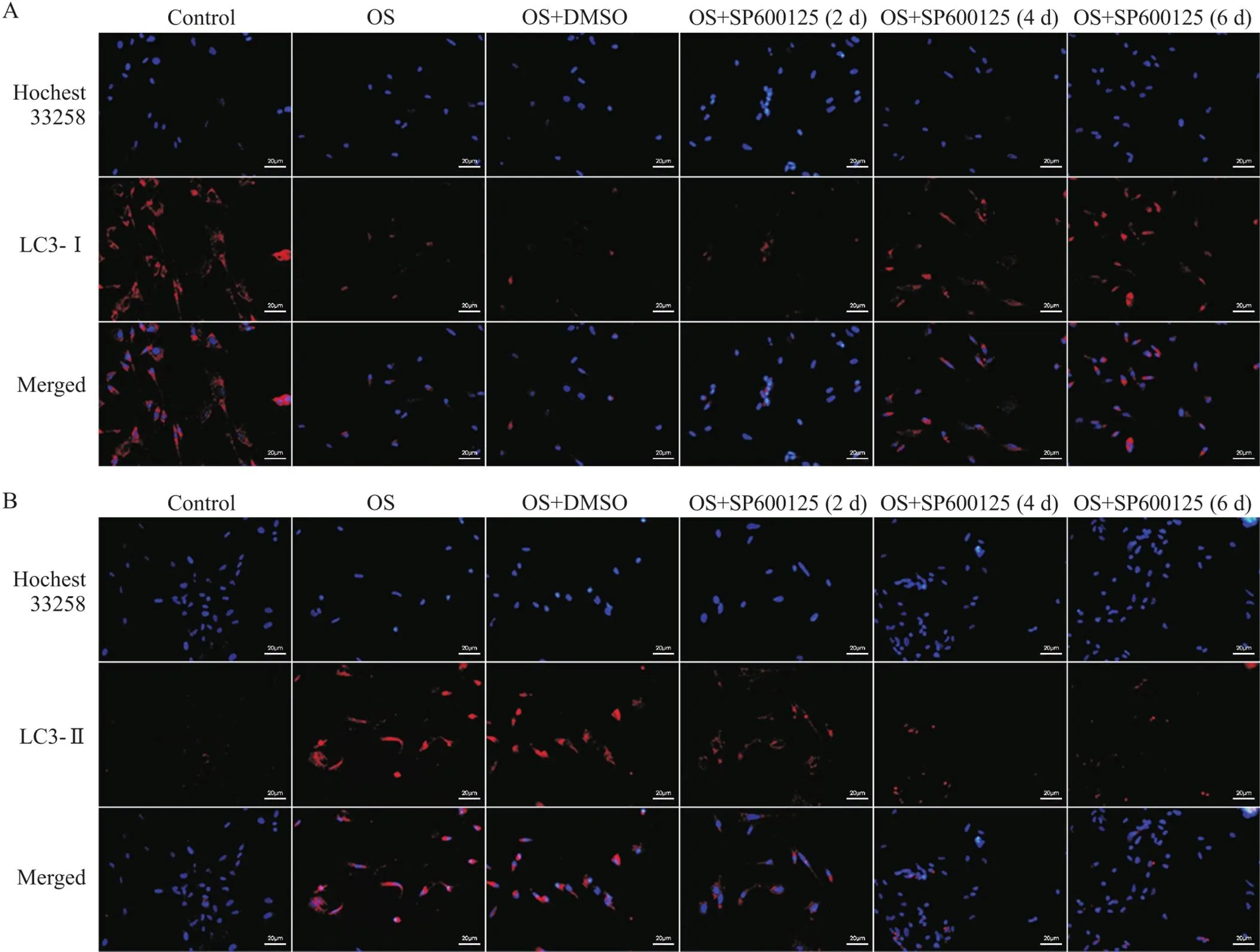
Figure 7. Immunofluorescence staining of LC3-I (A) and LC3-II (B). Scale bar=20 μm.
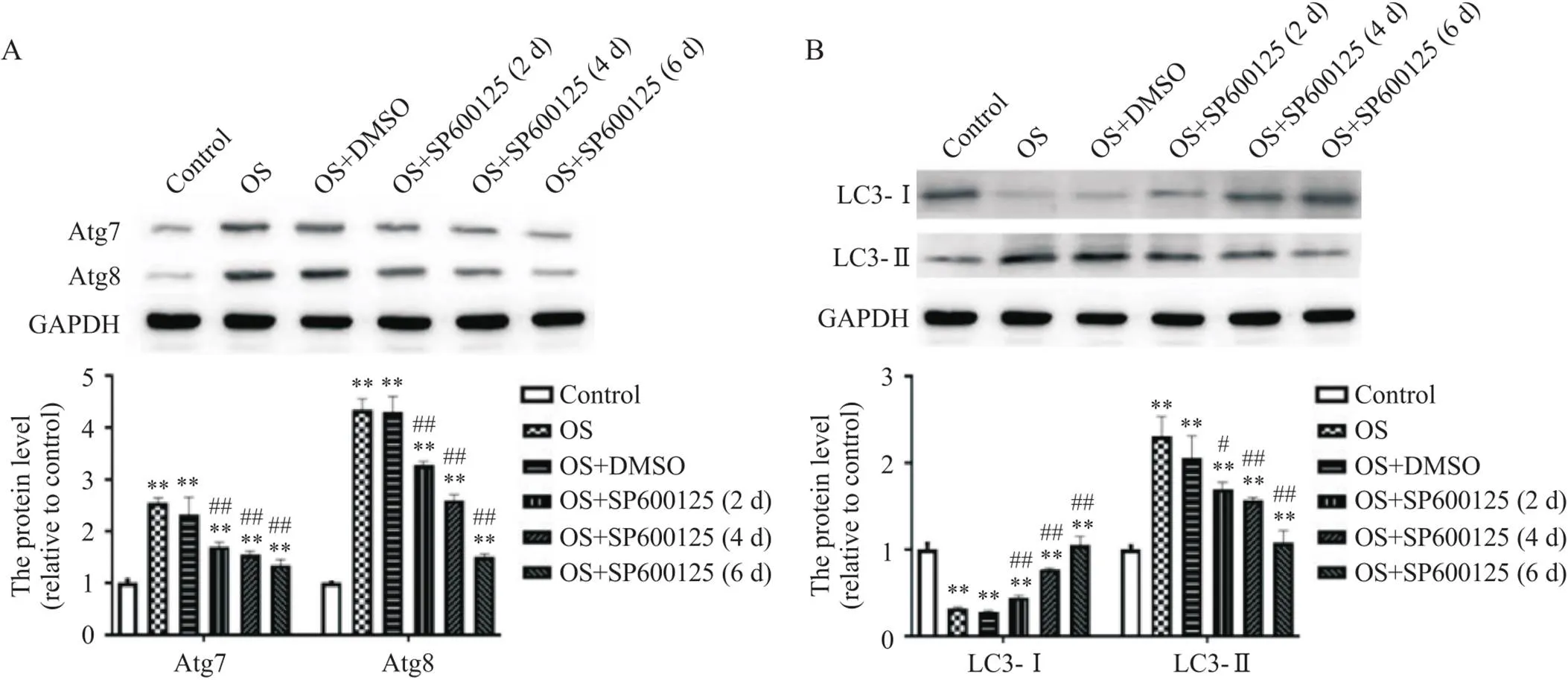
Figure 8. Effects of JNK inhibitor SP600125 on the protein expression of Atg7/8 (A) and LC3-I/II (B) in Schwann cells after oxidative stress (OS). Mean±SD. n=5. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs OS group.
3 JNK抑制剂SP600125降低OS后小鼠施万细胞自噬水平
随着JNK抑制剂SP600125作用时间的延长,小鼠施万细胞Atg7、Atg8和LC3-II的mRNA和蛋白水平逐渐下降(<0.05或<0.01),LC3-I的mRNA和蛋白水平逐渐升高(<0.01);SP600125处理6 d时,Atg7、Atg8和LC3-II的mRNA和蛋白水平达到最低值,而LC3-I的mRNA和蛋白水平则达到最高,见图5~8。
4 JNK抑制剂SP600125下调OS后小鼠施万细胞FoxO1/3表达
随着JNK抑制剂SP600125作用时间的延长,OS后小鼠施万细胞FoxO1/3的mRNA和蛋白表达规律与自噬相关蛋白(Atg7/8和LC3-II)一致,见图1、3、4。
讨论
JNK是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)的一个亚家族。JNK信号通路是一种对细胞内外应激的保守响应,如DNA损伤、葡萄糖剥夺、热应激、OS、炎症因子和生长因子等,均可激活组织细胞中的JNK信号通路[2-3]。
自噬(autophagy)是一种保守的细胞分解代谢途径。在正常情况下,自噬处于相当低的水平,但当机体处于应激状态时,体内细胞的自噬被激活,表现为自噬增强。当刺激程度过强时,进一步发展为自噬受损,可能导致神经细胞的损伤,对机体造成损害。本研究首先应用RT-qPCR、免疫荧光染色和Western blot检测自噬相关蛋白,发现OS可以促进Atg7、Atg8和LC3-II表达,而降低LC3-I水平,说明OS可以诱导小鼠施万细胞自噬;继续采用JNK抑制剂SP600125处理OS的小鼠施万细胞后发现,自噬相关蛋白(Atg7、Atg8和LC3-II)均呈时间依赖性下降,LC3-I则升高,表明了JNK对OS后小鼠施万细胞的自噬水平起到促进作用。研究发现,JNK有多种途径诱导细胞自噬,其中,调节转录水平可能性最大[4]。此外,本研究还发现OS不仅能增加小鼠施万细胞JNK1/2表达,还可促进JNK下游分子FoxO1/3的表达。FoxO转录因子家族能够调节多种靶基因的表达,从而参与细胞自噬活动,是目前公认重要的自噬调节因子[5-7]。该家族包含4位成员,分别为FoxO1(也称为FKHR)、FoxO3(也称为FKHRL1)、FoxO4(也称为AFX1)和FoxO6。由于后来发现FoxO2与FoxO3同源以及FoxO5仅在斑马鱼中表达,所以未将二者列为FoxO转录因子家族成员[8]。FoxOs通过调节蛋白质表达变化和翻译后修饰来调控不同的生理或病理过程[9]。FoxOs蛋白主要位于胞核内,有研究表明,胞核FoxOs通过促进基因的转录参与自噬调控,而胞质FoxOs可通过与胞质自噬相关蛋白(如Atg7)直接作用,调节自噬,该过程与FoxOs的转录调控作用无关[10-11]。近年来,对FoxOs的研究热度逐渐从肿瘤细胞转移到了神经细胞。FoxOs在很多中枢神经系统疾病中发挥重要的作用,如海马神经元损伤及认知障碍[12]等,但是在外周神经中的作用机制研究甚少。
为了进一步探讨OS后小鼠施万细胞内JNK对下游分子FoxOs的作用机制,我们采用JNK抑制剂SP600125处理OS小鼠施万细胞,发现OS的小鼠施万细胞FoxO1/3表达亦呈时间依赖性下降,变化规律与自噬相关蛋白(Atg7、Atg8和LC3-II)表达一致。这提示JNK可能激活了其下游FoxO1/3,活化的FoxOs进入细胞核内直接与基因的启动子结合,参与调控其转录[13-14];还能使FoxO下游靶物LC3-II蛋白表达增加,减少ROS产生[15]。
综上所述,本研究初步阐明了OS状态下小鼠施万细胞JNK1/2通过激活FoxO1/3,使自噬相关蛋白Atg7、Atg8及LC3-II上调,进而导致小鼠施万细胞自噬增加。这为JNK信号通路在心肌梗死后交感神经重构中的作用提供了理论基础。后续本实验组还将采用腺病毒过表达技术进一步验证JNK与FoxO1/3之间的关系。
[1]于天水, 葛鲁邹, 曹济民. 心肌梗死后交感神经重构的研究进展及其法医学意义[J]. 法医学杂志, 2019, 35(1):68-73.
Yu TS, Ge LZ, Cao JM. Research advances in sympathetic remodeling after myocardial infarction and its significance in forensic science[J]. J Forensic Med, 2019, 35(1):68-73.
[2] de Los Reyes Corrales T, Losada-Pérez M, Casas-Tintó S. JNK pathway in CNS pathologies[J]. Int J Mol Sci, 2021, 22(8):3883.
[3] Hammouda MB, Ford AE, Liu Y, et al. The JNK signaling pathway in inflammatory skin disorders and cancer [J]. Cells, 2020, 9(4):857.
[4] Quinn L, Coombe M, Mills K, et al. Buffy, aBcl-2 protein, has anti-apoptotic and cell cycle inhibitory functions[J]. EMBO J, 2003, 22(14):3568-3579.
[5] Maiese K. Forkhead transcription factors: formulating a FOXO target for cognitive loss[J]. Curr Neurovasc Res, 2017, 14(4):415-420.
[6] Dai B, Zhu F, Chen Y, et al. ASIC1a promotes acid-induced autophagy in rat articular chondrocytes through the AMPK/FoxO3a pathway[J]. Int J Mol Sci, 2017, 18(10):2125.
[7] Sun L, Zhao M, Liu M, et al. Suppression of FoxO3a attenuates neurobehavioral deficits after traumatic brain injury through inhibiting neuronal autophagy[J]. Behav Brain Res, 2018, 337:271-279.
[8] Matsuzaki T, Alvarez-Garcia O, Mokuda S, et al. FoxO transcription factors modulate autophagy and proteoglycan 4 in cartilage homeostasis and osteoarthritis[J]. Sci Transl Med, 2018, 10(428):eaan0746.
[9] Zhang X, Jiang L, Liu H. Forkhead box protein O1: functional diversity and post-translational modification, a new therapeutic target?[J]. Drug Des Devel Ther, 2021, 15:1851-1860.
[10] Cheng Z. The FoxO-autophagy axis in health and disease[J]. Trends Endocrinol Metab, 2019, 30(9):658-671.
[11] Farhan M, Silva M, Li S, et al. The role of FOXOs and autophagy in cancer and metastasis: implications in therapeutic development[J]. Med Res Rev, 2020, 40(6):2089- 2113.
[12] Pierone BC, Pereira CA, Garcez ML, et al. Stress and signaling pathways regulating autophagy: from behavioral models to psychiatric disorders[J]. Exp Neurol, 2020, 334:113485.
[13] Essers MA, Weijzen S, de Vries-Smits AM, et al. FOXO transcription factor activation by oxidative stress mediated by the small GTPase Ral and JNK[J]. EMBO J, 2004, 23(24):4802-4812.
[14] Zhang J, Ng S, Wang J, et al. Histone deacetylase inhibitors induce autophagy through FOXO1-dependent pathways[J]. Autophagy, 2015, 11(4):629-642.
[15] Sengupta A, Molkentin JD, Paik JH, et al. FoxO transcription factors promote cardiomyocyte survival upon induction of oxidative stress[J]. J Biol Chem, 2011, 286(9):7468-7478.
Role of JNK signaling pathway in autophagy of Schwann cells induced by oxidative stress
ZHANG Xiao-li, PEI Yu-yang▲, YU Tian-shui△
(,,,,100088,)
To investigate the role of c-Jun N-terminal kinase (JNK) signaling pathway in Schwann cell autophagy induced by oxidative stress (OS).Schwann cells from mouse sciatic nerves were used. The OS model was established by oxygen-glucose deprivation and reoxygenation, and the Schwann cells in OS group were treated with JNK inhibitor SP600125. The cells were divided into control group, OS group, OS+DMSO group, OS+SP600125 (2 d) group, OS+SP600125 (4 d) group and OS+SP600125 (6 d) group (=5 each). The mRNA and protein expression levels of JNK1/2, forkhead box protein O1/3 (FoxO1/3), autophagy-related protein 7/8 (Atg7/8) and microtubule-associated protein 1 light chain 3-I/II (LC3-I/II) were detected by RT-qPCR, immunofluorescence staining and Western blotRESULTS: The expression levels of JNK1/2, FoxO1/3, Atg7/8 and LC3-II in the Schwann cells were increased (<0.05), while the expression of LC3-I remarkably decreased during oxidative stress. SP600125, a JNK inhibitor, inhibited the expression of Atg7/8, LC3-II and FoxO1/3 in a time-dependent manner.The JNK-FoxO1/3 signaling pathway serves a critical role in the autophagy of Schwann cells after OS.
c-Jun N-terminal kinase; Forkhead box protein O; Oxidative stress; Schwann cells; Autophagy
R541.4; R363.2
A
10.3969/j.issn.1000-4718.2022.03.011
1000-4718(2022)03-0471-08
2022-01-06
2022-03-01
[基金项目]国家自然科学基金项目资助(No. 81971796);中央高校基本科研业务费专项资金资助;中国政法大学科研创新引导专项项目(No. 20ZFY34001)
Tel: 13811429667; E-mail: 30030005@qq.com
▲并列第一作者
(责任编辑:卢萍,罗森)

