司库奇尤单抗和依奇珠单抗的不良反应信号检测研究
刘小英,王浩,阳丽,陈力
(1.成都市新都区人民医院药剂科,成都 610500;2.四川大学华西第二医院药学部,成都 610041;3四川大学华西第二医院循证药学中心,成都 610041;4.四川大学华西第二医院出生缺陷与相关妇儿疾病教育部重点实验室,成都 610041)
白细胞介素17A(interleukin-17A,IL-17A)属于IL-17家族的一种,是一种参与正常炎症及免疫应答的天然细胞因子,在促进银屑病、银屑病关节炎和强直性脊柱炎等疾病的自身免疫反应中的炎症状态起重要作用。分子靶向药物司库奇尤单抗和依奇珠单抗均属于IL-17A抑制剂,分别于2015年和2016年被美国食品药品管理局(FDA)批准上市,主要用于治疗斑块状银屑病、银屑病关节炎、强直性脊柱炎、非放射性中轴型脊柱关节炎[1]。随着它们在国内外的广泛使用,其ADE报告也逐渐增多,但基于真实世界的不良反应数据分析对比两药不良反应的异同及特点笔者尚未见报道。本研究通过对FDA不良事件报告系统(FDA adverse event reporting system,FAERS)收集到的数据进行挖掘,分析库奇尤单抗和依奇珠单抗可疑的ADE信号,以期为临床安全合理用药提供参考。
1 资料与方法
1.1资料来源 下载FAERS中2017年第一季度至2020年第四季度共16个季度的数据,导入MySQL 进行分析,排除重复报告后,得到“首要怀疑药物”的相关报告,从中筛选出用药名称为司库奇尤单抗(SECUKINUMAB)或可善挺(COSENTYX)且为首要怀疑药物的PT,共270855个;筛选出用药名称为依奇珠单抗(IXEKIZUMAB)或拓姿(TALTZ)且为首要怀疑药物的PT,共25723 个。
1.2研究方法 国内外用于药物ADE 信号检测的数据挖掘方法主要是比例失衡法[2]。其原理是比较目标药物-事件的出现频率与背景频率的差异,当目标药物-事件组合(DEC)的出现频率明显高于整个数据库的背景频率并且达到了设定的阈值,就认为产生了一个信号(Signals)[3]。
比例失衡法主要包括报告比值比法(reporting odds ratio,ROR)、比例报告比值法(proportional reporting ratio,PRR)、综合标准法(medicines and healthcare products regulatory agency,MHRA)等[4]。由于ROR 法和PRR 法具有计算简单、能估计相对危险度、可减少由于对照组选择所带来的偏倚、计算结果一致性好等特点[5],因此本次研究使用了比例失衡法中的ROR[6]法和PRR[7]法。
1.3数据处理方法 由于本研究所用数据库 FAERS 采用的是国际医学用语字典(medical dictionary for regulatory activities,MedDRA)编码,因此本研究采用MedDRA中的首选系统器官分类(system organ class,SOC)和首选术语(preferred term,PT),对报告中的描述用语进行标准化后合并相同项,以免在后续进行统计时出现相同项目重复统计或报告数<3但合并后≥3的信号被遗漏的错误。
1.4数据计算方法 筛选出报告数≥3 的PT,根据ROR法和PRR法计算相应 ROR 值、PRR 值和95%的可信区间(95% Confidence Interval,95%CI)。PT数≥3,ROR及PRR的95%CI下限均>1作为有效信号生成条件,提示药物与目标ADE有统计学关联[8]。
1.5数据筛选 本文所用ROR和PRR的特点为计算简单;能估计相对危险度,减少由于对照组选择所带来的偏倚;计算结果一致性好。但由于这两种方法灵敏度较高,因此较容易出现假阳性信号。对于这样的局限性,本次研究采取的措施为:① 2种方法同时使用,选取2 种方法同时有信号的PT作为研究对象,以减少假阳性信号带来的偏差;②提高阈值,对有信号的PT进行二次筛选,提高阈值这种做法在国际上也是较常用的方法[9]。具体步骤为将筛选出的PT用ROR法和PRR法进行计算后,筛选出重合的信号,再将重合信号进行二次筛选,筛选方法为:将PT按95%CI下限降序排序后,筛选报告例数(a值)≥3,ROR值与PRR值均≥5的PT,并删除与原发疾病相关、用药与说明书推荐不符、用药错误、人为因素、产品问等干扰因素所致的ADE。
2 结果
2.1患者基本情况 2017年第一季度至2020年第四季度的首要怀疑药物为司库奇尤单抗的ADE报告270 855份,首要怀疑药物为依奇珠单抗的ADE报告25 723份。经计算得到有信号且符合二次筛选条件的ADE,其中司库奇尤单抗涉及患者7856例,依奇珠单抗4083例。两种药物的ADE报告中,可发现女性占大多数,患者主要为18岁及以上人群,而美国是报告数最多的国家,具体报告基本信息见表1。
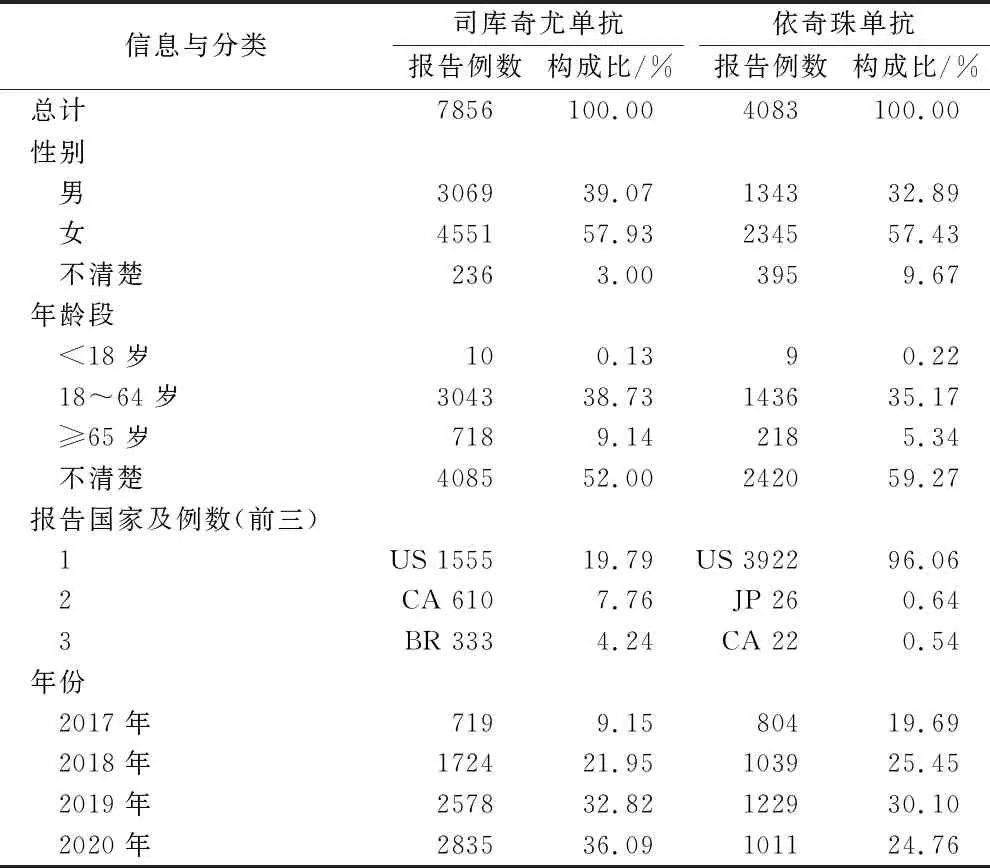
表1 2017年第一季度至2020第二季度两药不良事件报告基本信息 Tab.1 Basic information of ADE reports from the first quarter of 2017 to the second quarter of 2020
2.2ADE信号检测结果 经ROR 法和PRR 法计算,共得到司库奇尤单抗ADE 信号759 个,依奇珠单抗ADE 信号270 个,且信号重合。经过二次筛选,得到司库奇尤单抗ADE 信号152 个,依奇珠单抗ADE 信号69 个。按95%CI下限排序后,取前50的PT及相关计算值进行展示(表2)。
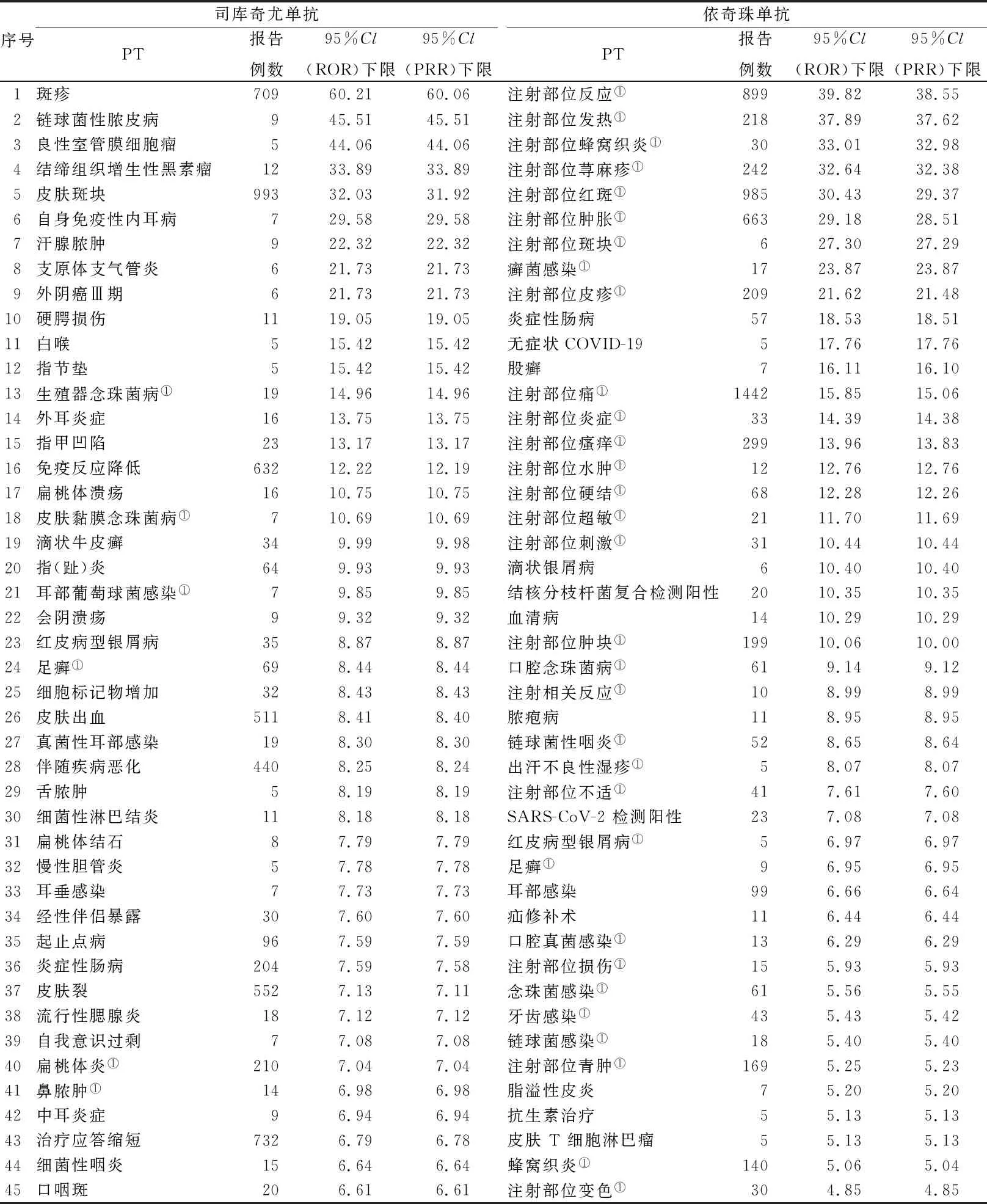
表2 报告数前50的ADE信号Tab.2 Top 50 ADE signals reported
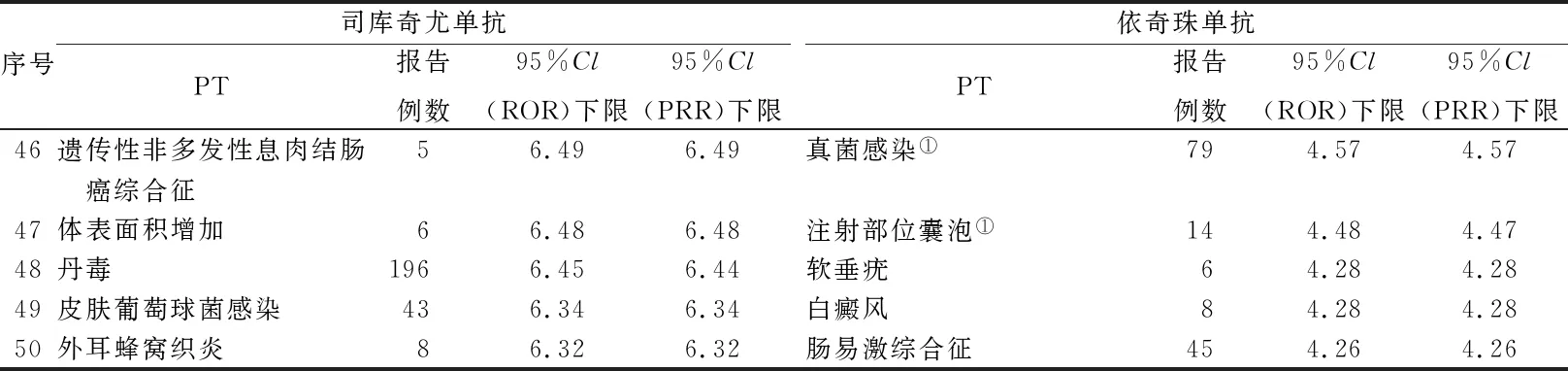
续表2 报告数前50的ADE信号Tab.2 Top 50 ADE signals reported
2.3两药ADE 信号对比情况 本次研究基于两药有相同的适应证,经二次筛选后将所得的ADE 信号进行统计按 Med- DRA 中的SOC 进行分类后显示,司库奇尤单抗涉及SOC共计20个,主要体现在皮肤及皮下组织类疾病、感染及侵染类疾病、全身性疾病及给药部位各种反应;依奇珠单抗涉及SOC共计11个,主要体现在全身性疾病及给药部位各种反应、感染及侵染类疾病等,详见表3。两药共计12 个重叠信号,其中感染及侵染类疾病有6 个信号,全身性疾病及给药部位各种反应有4个信号,胃肠系统疾病、耳迷路类疾病各1 个信号,详见表4。
3 讨论
3.1ADE 信号与说明书对比 ①说明书提到的ADE。本研究所得到的司库奇尤单抗和依奇珠单抗的ADE 信号与说明书记载基本一致,在感染及侵染类疾病类体现较为集中,主要表现为细菌或真菌感染,因IL-17A 主要由Th17细胞分泌,以IL-17RA/IL-17RC 或IL-17RA/IL-17RD异源二聚体为受体,参与抗细菌和真菌感染免疫以及多种自身免疫性疾病的发展[10]。这部分两者共同的ADE 很可能与该类药物的药理毒性作用相关,体现了本次研究的可信度。但也发现与药品说明书收录有不同之处,司库奇尤单抗在感染及侵袭类中报告例数由多到少依次为蜂窝织炎、耳部感染、真菌感染与说明书仅记载的上呼吸道感染(十分常见)、蜂窝织炎(偶见)存在较大差异,而说明书常见的恶心、口咽痛、口腔疱疹、流涕、腹泻在本次研究信号报告例数较少或强度前50位中未被发现;皮肤及皮下组织类疾病说明书描述为偶见或罕见,但在本次研究中确为较常见的ADE;依奇珠单抗说明书提到的常见ADE 如恶心、口咽痛,却未在本研究信号强度前50 位出现。
②新的ADE。信号强度前50位中司库奇尤单抗报告的新的不良反应较多(新的ADE信号占比88%),如司库奇尤单抗可能引起肌肉骨骼及结缔组织疾病、全身性疾病及给药部位反应、良性、恶性及性质不明的肿瘤均未收录于其说明书中。斑疹、皮肤斑块、免疫反应降低、皮肤出血这几个ADE 信号不但与司库奇尤单抗相关性较高,而且报告数较多。这提示临床使用司库奇尤单抗时应重视其对皮肤及皮下组织和免疫系统的损伤。依奇珠单抗不良反应与说明书记载基本一致,但也有少量新的不良反应出现(新的ADE信号占比32%)如炎症性肠病、耳部感染,提醒临床应关注说明书未记载的不良反应的发生。上述结果表明,药品上市前研究的局限性使部分不良反应未得到客观的认识,提示说明书应根据临床应用情况不断更新。
3.2两药对比 对比两药的ADE信号,从表3可以看出司库奇尤单抗的ADE报告中皮肤及皮下组织类疾病最常见,感染疾病类次之,而依奇珠单抗的ADE报告中给药部位反应最常见,感染疾病类次之。此外与依奇珠单抗相比,司库奇尤单抗除在两药共有的SOC有信号外还在眼、心脏、生殖系统和乳腺系统、各肌肉骨骼类疾病、精神类疾病、肝胆系统疾病有ADE信号发现。提示司库奇尤单抗ADE涉及范围更广,临床使用中应尤其注意偶见或罕见的不良反应与药物使用的关联性。从表2可以看出司库奇尤单抗信号强度前50 位严重的ADE主要体现在良性、恶性及性质不明的肿瘤,而依奇珠单抗前50位中严重的ADE主要为血清病、注射部位超敏反应、皮肤T细胞淋巴瘤。一项田志刚课题组发表在《美国国家科学院院刊》杂志上的研究发现,IL-17信号功能缺陷的小鼠体内含有更高比例和数量的终末成熟NK细胞。同时,这些小鼠由于体内NK细胞数量的变化表现出更强的抗肿瘤抗病毒的能力[11]。可见,IL-17A可通过抑制NK细胞成熟来抑制NK细胞的抗肿瘤和抗病毒活性,从而出现免疫抑制、促进肿瘤发生,转移和病毒感染。如司库奇尤单抗中有少量遗传性非多发性息肉结肠癌综合征(Lynch 综合征)的报告,Lynch综合征是指具有在DNA错配修复基因中的一个(致病性胚系突变的个人和家庭MLH1,MSH2,MSH6和PMS2)或EPCAM基因。该类人群携带的致病基因使他们患结直肠癌和子宫内膜癌的风险增加[12]。司库奇尤可能通过抑制NK细胞的抗肿瘤活性从而导致该类人群基因受到激发或表现出临床症状。提示在使用以上两种药物时,临床应进行是否有肿瘤高风险因素筛查。此外,两个药物同属于IL-17A抑制剂,其肿瘤的发生与该类药物的作用机制相关性较强,但从表3可以看出司库奇尤单抗出现良性、恶性及性质不明的肿瘤发生种类及数量更多,而依奇珠单抗在免疫介导的超敏反应较司库奇尤单抗更易发生。从表4可以看出两药在皮肤及皮下组织类疾病等5个SOC 有相同信号,但两药ADE信号强度存在差异,如足癣、毛囊炎、丹毒司库奇尤单抗略强于依奇珠单抗;而炎症性肠病、注射部位斑块依奇珠单抗远强于司库奇尤单抗,提示患有皮肤真菌感染类或其他皮肤疾病的患者宜选用依奇珠单抗,胃肠基础较差或有胃肠基础疾病的患者更宜选用司库奇尤单抗,临床应注意根据患者个体情况选择用药。

表3 不良事件信号与累及的系统和器官Tab.3 ADE signals and involved systems and organs

表4 司库奇尤单抗与依奇珠单抗的相同信号Tab.4 Same signals of secukinumab and ixekizumab
此外本次研究还发现司库奇尤单抗有如巨大儿、硬腭损伤、广泛性特发性骨质增生、严重意志力丧失、微血管冠状动脉疾病、SAPHO 综合征、米 - 费综合征、髋部畸形的严重ADE报告,该类不良反应虽然发生较少但可能导致患者住院或危及生命提示在使用过程中应密切监测,出现以上严重ADE时应立即停药,并做相应处理。
3.3局限性 研究药物上市后的ADE有助于确定潜在的安全问题,对于识别新的ADE及重新定义风险收益是不可或缺的部分,但此方法存在一定的局限性。首先,FAERS属于自发呈报系统,填报人员来自不同地区不同人群,素质参差不齐,存在数据缺失较多,数据不规范的情况。其次,药物上市时间短,无法观察到长期数据可能会导致信息偏差,影响全面长期评估的结果。另外在使用MedDRA术语集时,使用比PT更高级别的术语可能出现统计上不同的结果[13]。第三,本研究所用数据库中可能存在激发报告。例如,若监管部门公开提出了某个药物可能存在导致某个 ADE 的风险或发生了某些关于药物 ADE 的社会新闻,那么在一段时间内,关于该药物-事件组合的报告数可能会由于医务人员的关注而增多,从而影响信号检测的结果[14]。第四,虽然通过比例失衡法计算所得到的信号表示目标药物与目标ADE 在统计学上有关联性,但并不能代表目标药物与目标 ADE 在生物学上有因果联系[15]。其关联性还需进一步评估,如通过进行临床研究进一步观察证实等。
4 结束语
基于FAERS数据库对司库奇尤单抗和依奇珠单抗上市后的ADE信号进行挖掘和分析,两药所得ADE信号与已知的相关安全性信息基本一致,主要累及感染及侵染类疾病、全身性疾病及给药部位各种反应等方面。但也发现药品说明书有收录不全之处及两药ADE的不同之处。这在一定程度上弥补了药品上市前临床试验的不足,可为临床合理用药提供参考。

