器官移植受者体内他克莫司膜转运体的遗传药理学研究进展*
李沛霞,张蕊,刘亚妮,师少军,2
(1.华中科技大学同济医学院附属协和医院药学部,武汉 430022;2.武汉市江夏区第一人民医院/协和江南医院药学部,武汉 433000)
他克莫司(FK506)广泛应用于器官移植、皮肤病和自身性免疫性疾病的临床治疗中[1],其治疗窗窄,药动学表现出很强的个体差异,这种差异被归因于年龄、性别、遗传和药物相互作用等因素[2],其中遗传因素是影响其代谢个体差异的重要原因[3]。通过寻找基因与药物的相互作用,从而更好实施个体化给药,是目前的研究重点。基因检测技术的普及,使得对患者的基因分型变得容易,据此,实施个性化给药,可提高药物疗效,减少不良反应的发生[4]。遗传因素在他克莫司治疗的个体化差异中起着重要影响,在临床实践中,由于缺乏基因变异对他克莫司疗效影响的证据,根据患者的基因分型来进行剂量调整的策略未能实现,如何利用现有的药物遗传信息学来实现临床治疗的个体化是目前的研究重点[5]。
目前,在免疫抑制剂中,细胞色素P450(CYP)3A5和ABCB1的单核苷酸多态性备受关注,采用ML回归模型/人工神经网络(ANNs)与CYP3A5和ABCB1基因组信息相结合,可以有效地预测他克莫司的剂量与生物利用度,先进工具与基因组测序的结合,可以精确无创监测患者的剂量需求与状态[6]。CYP3A基因检测技术已在移植患者术后他克莫司的个性化治疗方案中得到应用,降低了不良反应的发生率,同时不影响其免疫抑制效果[7]。然而转运体的相关研究尚少,且存争议,因此研究外排转运体的基因多态性,对于他克莫司的临床治疗具有重要意义。
1 ABC转运体基因多态性
外排转运体为ATP结合盒转运体家族(ATP binding cassette transporters,ABC),由51个成员组成,包括P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multi-drug resistant associate protein,MRP)和乳腺癌耐药相关蛋白(breast cancer resistance protein,BCRP)[8],ABC转运体是大多数生物体,包括植物、细菌和哺乳动物在内的真核生物中最大的跨膜蛋白家族之一,它们执行许多与ATP水解相关的关键生理过程,ABC转运体具有特殊的药理学意义,与各种药物的跨膜转运有关,可以改变细胞内药物浓度,从而改变这些化合物的作用,此外它们的潜在结构也参与干扰(病理)生理过程。
1.1P-gp(ABCB1) ABCB1是编码外排转运体P-gp的主要基因,该基因多态性与移植器官P-gp活性降低有关,他克莫司是其底物之一,该基因的突变会影响他克莫司的吸收、分布和消除过程,减少他克莫司的外排,导致他克莫司血药浓度增加,出现蓄积等情况[9]。当前主要的研究位点包括外显子26 3435C>T、12 1236C>T和外显子21 2677G>T/A。
已有大量研究报道ABCB1基因多态性与他克莫司的疗效相关,影响他克莫司的药动学变量。在巴基斯坦肝移植中,ABCB1 3435C>T基因多态性与他克莫司血药浓度相关,CC型患者血药浓度与剂量比(C/D)值低于CT和TT型患者(P=0.02)[10]。在小儿肝移植中同样发现,ABCB1 3435C>T基因型会影响受者对他克莫司的代谢,CC型受者的代谢比CT和TT型受者快(P<0.05),在CYP3A5快代谢亚组中有着更加明显的差异[11]。PENG等[12]共纳入16项研究进行荟萃分析,ABCB1 3435 TT型的体质量调整剂量明显低于CC组,亚组分析显示T载体的他克莫司浓度/体质量调整日剂量值在1个月和6个月时显著高于CC组。在一项关于白人和黑人肾移植的研究中也证实ABCB1影响他克莫司的药动学变量,ABCB1 1236 C>T-2677 G>T/A-3435 C>T与他克莫司剂量、清除率、清除率/去脂体重、剂量标准化AUC0-12 h显著相关(P<0.001),ABCB1 3435T等位基因的存在显著降低了CYP3A5三个代谢复合物对他克莫司的清除率[13]。刘璐等[14]的Meta分析发现ABCB1 3435C>T基因多态性与他克莫司血药浓度/剂量存在相关性,肾移植术后1周、1个月和6个月,CT和TT型患者血药浓度显著高于CC型,TT型患者在移植术后3个月,血药浓度高于CT型患者(P<0.000 1)。而时程程[15]研究了肝移植供体发现,3个单核甘酸多态性(SNP)不同基因型的受体术后他克莫司初始血药浓度不存在显著差异,但在23例初始血药浓度存在显著差异的CYP3A5*3/*3基因型中发现,ABCB1与术后他克莫司的初始C/D值具有相关性,并在细胞水平证明ABCB1 mRNA表达与他克莫司初始C/D值显著相关,这可能是由于ABCB1启动子区的DNA甲基化从而调控ABCB1的表达,最终影响他克莫司血药浓度(P<0.05)。邢进远等[16]研究表明,在肾移植患者中,ABCB1 1236 CC型患者C/D值显著高于其他组(P<0.01)。鲁春云等[17]对肾移植受者进行了Meta分析,结果表明在ABCB1 G2677T/A基因型中,GG型患者血药浓度/校正剂量值显著低于GA+GT或TT+TA+AA型(P<0.000 01)。SODA等[18]在日本肾移植患者中发现ABCB1 G2677A患者表现出更大的剂量调整AUC(AUC/D)和更小的他克莫司剂量(P<0.01),但与其药动学参数无显著相关性。对印度北部肾移植受者的研究发现,只有G2677T/A纯合子突变体与他克莫司血药浓度显著相关(P<0.001),并且G2677T/A基因型CYP3A5*1*1和纯合子突变型TT+AA的组合他克莫司每日剂量需求最高,G2677T/A基因型CYP3A5*3*3与野生型GG组合的他克莫司每日剂量需求最低[19]。目前,关于ABCB1基因多态性研究还是较集中在3435C>T,上述研究结果表明其不同基因型对他克莫司血药浓度的影响具有显著性差异,从几项国内外研究中得到了较为一致的结果,CC型患者的C/D值显著低于CT与TT型,此前也有文献报道器官移植受者ABCB1 3435 C>T基因筛选有助于预防药物相互作用和促进他克莫司剂量调整[20],这表明临床有望通过ABCB1 3435 C>T多态性的鉴定,来缩短他克莫司剂量水平达到最佳状态的时间,提供个性化给药方案,基于目前研究的有限与不足,ABCB1基因多态性还暂时无法成为他克莫司临床治疗的一个生物标志物,应针对此进行更多统一、大样本、高质量的研究,从而得到更为可靠的研究结果,以用于临床实践。
此外,其多态性与不良反应的发生显著相关,一项回顾性研究中,发现ABCB1 C1236T和 C3435T不同基因型患者间发生肝功能异常的概率具有统计学意义,其中携带C1236T CC型、G2677T/A GG型和C3435T CC型的患者,发生肝功能异常的概率增加,ABCB1 CGC单倍型为主要单倍型,携带该单倍型的患者,发生肝功能异常的风险更大[21]。在1例16岁女性肾和肝移植患者中发现,供体的ABCB1 3435C>T基因多态性与大剂量的他克莫司一起参与了肾毒性[22]。ABCB1 3435C等位基因也被证实与肾移植后感染风险的降低有关[23]。研究术后服用他克莫司+霉酚酸酯+泼尼松免疫抑制剂治疗的肾移植患者发现ABCB1 C1236T多态性可能与患者医院感染发生相关(P<0.05)[24]。此外ABCB1 3435 C>T、2677G>T/A、1236C>T多态性分别与精神病、脓毒症等不良反应显著相关[10]。ABCB1基因多态性与不良反应的关系较为密切,未来临床也可通过检测该基因多态性,预测移植患者术后接受他克莫司的不良反应,防止移植后感染风险与不良反应的发生。此外也可以看出并不是单一的SNPs在影响他克莫司的疗效或不良反应,单倍型也起着重要作用。
P-gp通过影响药物在胃肠道的吸收和运输,从而影响药物的吸收与排泄,可能影响他克莫司的生物利用度,采用人工神经网络(artificial neural network,ANN)和logistic regression(LR)模型分别预测了他克莫司的生物利用度和移植后糖尿病风险,结果发现,ABCB1 1236C>T和2677G>T/A与他克莫司生物利用度呈负相关,此外CYP3A5*3与ABCB1 1236TT 或2677GG基因型结合时,发生了协同作用,增加生物利用度,CYP3A5*3与ABCB1 2677G>T/A之间的协同作用还是移植后糖尿病发生的决定因素[25]。胡楠等[26]研究了200例肾移植患者术后初期ABCB1基因多态性对他克莫司剂量、浓度与肾功能的影响,结果表明,在CYP3A5非表达组中,ABCB1 1236CT和TT型患者的他克莫司D与C/D差异有统计学意义(P<0.05),而在CYP3A5表达者中则无显著影响,同样在CYP3A5表达组中ABCB1 3435TT型患者他克莫司C和D显著低于CC和CT型患者,在CYP3A5表达组中,ABCB1 3435TT型患者他克莫司D显著低于CT型(P<0.05)。此外,CYP3A5非表达者中,ABCB1 3435TT型患者肌酐和胱抑素C水平显著高于CC和CT型患者(P<0.05)。CYP代谢酶仍是影响他克莫司个体差异的重要因素,需考虑其与转运体的相互作用,上述研究中,这种协同作用影响他克莫司的生物利用度、血药浓度和C/D值,对他克莫司在个体中的差异化也有了更好解释。
WOILLARD等[27]对接受他克莫司免疫治疗的330例和369例肾移植患者进行了回顾性分析,供体ABCB c.1199GA/AA基因型与队列中同种异体移植物丢失的风险有关,该多态性较为罕见,但与移植物丢失的某些机制有关。HU等[28]探究了165例肾移植受者基因多态性对他克莫司处置的影响,结果表明CYP3A5*3仍是影响他克莫司C/D值的主要因素,而ABCB1 61A>G被首次发现影响他克莫司的C/D值,ABCB1 61A>G突变显著降低他克莫司C/D值,且与CYP3A5*3间无相互作用。这些新位点的研究表明,除了3435C>T、1236C>T和2677G>T/A三种常见位点,也应将研究目标转移至其余位点上,探究其与他克莫司疗效及不良反应之间的相互关系,发掘成为生物标志物,为他克莫司的个性化给药方案提供支撑。ABCB1基因多态性对他克莫司疗效及不良反应的影响总结见表1。
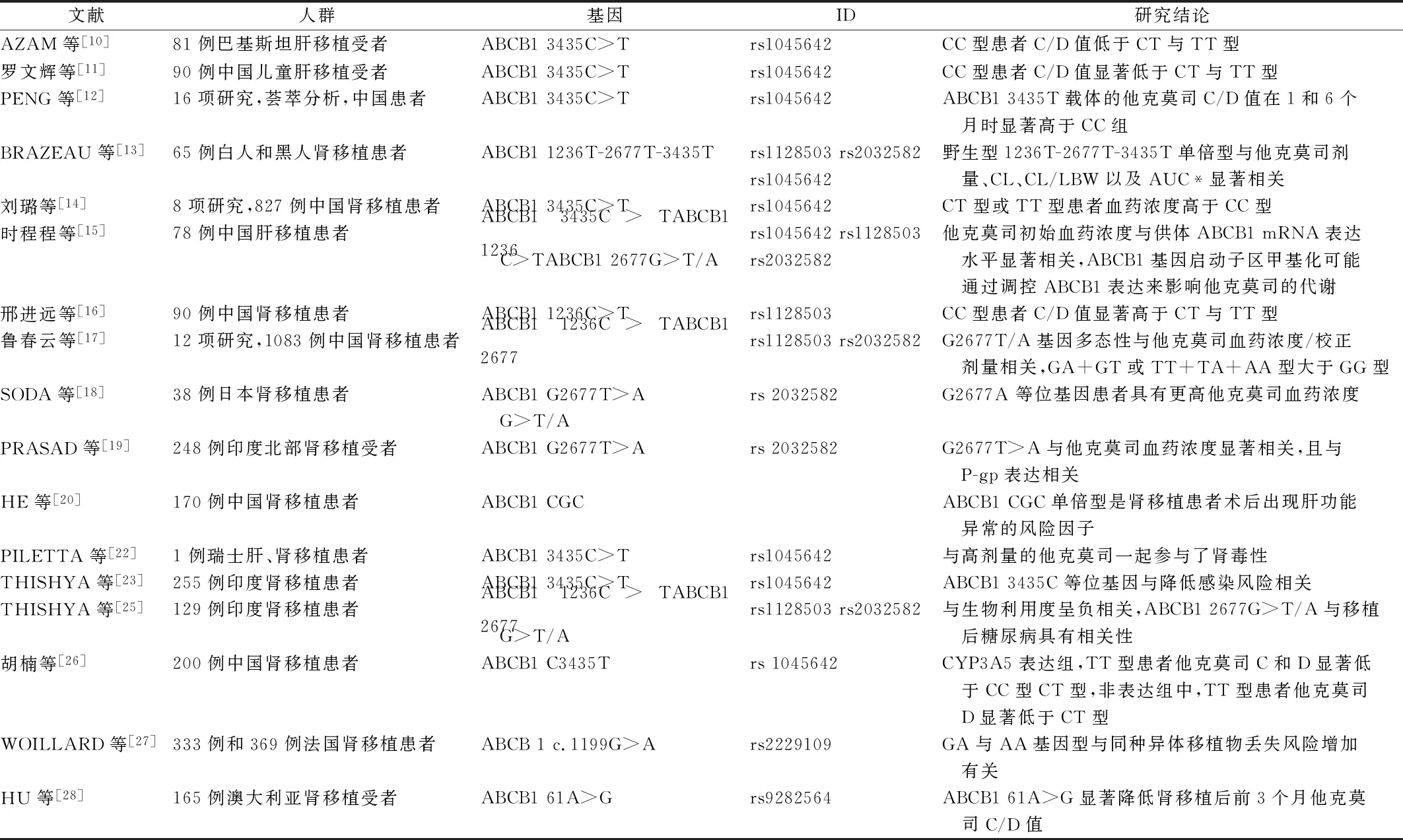
表1 ABCB1基因多态性对他克莫司疗效及不良反应的影响Tab.1 Effects of ABCB1 gene polymorphism on the efficacy and adverse reactions of tacrolimus
1.2MRP2(ABCC2)和MRP8(ABCC8) GENVIGIR等[29]统计分析了148例成年肾移植受者体内转运体编码基因的SNPs对他克莫司剂量、C/D和临床疗效的影响,结果发现ABCC2 c.3972T等位基因携带者比c.3972CC基因携带者表现出更高的C/D值。而VANHOVE 等[30]研究发现,ABCC2多态性对C/D的影响有限,仅在CYP3A5非表达者中具有统计意义。ABCC2 c.3972C>T在移植期间与2倍的死亡风险有关,而ABCC2 -24 C>T、c.3972C>T多态性与感染风险降低有关[23]。DAMON等[31]研究发现,转运体ABCC8可能参与他克莫司代谢。而ABCC8 T-3C基因也被发现与中国肾移植受者空腹血糖相关,可能参与他克莫司诱导的新发糖尿病[32]。综上,ABCC2基因多态性研究位点主要集中在c.3972T,影响他克莫司C/D值,对表观清除率也有影响,与移植后感染风险的降低也有关,而ABCC8基因主要与他克莫司代谢和移植后新发糖尿病有关,需要进行更多的研究来佐证这些发现。
2 摄取转运体(OATP)
OATP是溶质载体超家族(solute carrier family,SLC),由417个成员构成,包括有机阴离子转运多肽家族(OATPs)、有机阴离子转运体家族(OATs)、有机阳离子转运体(OCTs)、肉碱/有机阳离子转运体(OCTNs)和寡肽转运体(PEPTs)[33],促进各种底物在生物膜上的运输,在生理过程中发挥着重要作用,主要在肝脏、肾脏和小肠等器官表达。
OATP1B1主要在肝细胞基底的外侧膜表达,对肝脏摄取和清除多种药物底物和内源性化合物至关重要,其编码基因为SLCO1B1,他克莫司被证实是OATP1B1的底物之一[34]。该基因主要影响他克莫司的C/D值。WU等[35]探讨了肝移植术后早期SLCO1B1 rs2291075多态性与他克莫司C/D的关系,受体该基因的CT与TT携带者的C/D值接近,显著低于CC基因型携带者,在排除供体和受体CYP3A5 rs776746的干扰后,受体该基因型对亚组恢复期和稳定期他克莫司C/D值仍有显著影响,与此前相关学者的研究结果一致[36]。
3 锌转运体8(Zinc transporter 8,ZnT8)
ZnT8是一种锌离子转运蛋白,特异性表达于胰岛β细胞,其编码基因为SLC30A8,与调控胰岛素的合成与分泌密切相关[37]。器官移植术后糖尿病(posttransplantation diabetes mellitus,PTDM)多发,糖尿病也是他克莫司最主要的不良反应之一,二者似乎存在某种关联。KANG等[38]证实肾移植受者SLC30A8 rs13266634基因的W等位基因数量与PTDM风险降低显著相关。KIM等[39]研究表明,SLC30A8的rs13266634单核苷酸多态性与PTDM易感性相关。而在一项关于他克莫司治疗肾移植术后PTDM常见Ⅱ型糖尿病(T2DM)遗传危险因素的分析研究中发现[40],SLC30A8 rs1801282基因的SNPs增加了白种人患T2DM的风险。上述研究结果表明,ZnT8转运体SLC30A8基因的不同基因型与他克莫司用后糖尿病风险的增加与降低相关,为移植后他克莫司引起的新发糖尿病机制研究提供了思路。
4 浓度型核苷转运体(concentrative nucleoside transporters,CNT)
CNT负责尿苷和腺苷的跨膜转运,其编码基因为SLC28A3。DAMON等[31]对肾移植受者在移植后反复检查,发现SLC28A3基因的内含子变异rs10868152可能是他克莫司代谢的关键基因,通过预测模型解释了他克莫司每次剂量中高达70%的总变异性,但SLC28A3的直接转运机制还有待进一步研究。而LIU等[41]研究中国肝移植患者发现,SLC28A3 rs7853758可以预测他克莫司的药动学,受体SLC28A3 rs7853758和血红蛋白模型能预测第2,3,4周他克莫司的处置,并与其发生移植后新发高血压的风险密切相关。这些研究也提示了SCL28A3基因对他克莫司药动学特征的影响,但相关机制有待探讨。
5 结论与展望
笔者主要分析了P-gp、MRP、OATP、ZnT8和CNT3等一些与他克莫司药动学和药效学典型相关的转运体及其调控基因ABCB1、ABCC2、ABCC8、SLCO1B1、SLC30A8、SLC28A3。ABC转运体的基因多态性结果表明,他克莫司不同的剂量需求与ABCB1基因型密切相关,有理由认为ABCB1能成为识别他克莫司药代动力学或药效学的生物标志物,但近年来的相关研究结果并不是十分一致,导致ABCB1的基因分型还无法在临床实践中应用,进一步深入研究ABCB1的基因多态性,有望将其应用于临床,及时调整给药剂量并预测不良反应发生的风险,促进他克莫司的个性化给药。
目前的研究中还存在很多结论相悖的情况,原因分析如下:首先,可能不是单个的SNPs来影响药动学,大多数研究都只分析了单个SNPs的基因多态性,需考虑单倍型的联合效应。其次,存在研究规模较小、部分研究样本量少的情况,研究结果不具有很强说服力。此外,越来越多的研究表明,代谢酶与转运体间存在相互作用,如CYP3A-P-gp相互作用,这种作用增加了药物体内处置的复杂性,协同/相反作用,共同影响药物的疗效与毒性[42],所以还应考虑代谢酶的影响。种族的差异也是原因之一,不同种族群体的基因突变频率存在差异[43-44],在某些位点上,只评估了西方人群的影响,与亚洲人群可能存在差异,需要进一步在中国患者中进行遗传学研究,以得到明确结论。值得注意的是,很多的研究仍集中在器官移植的受体患者群,而供体的基因型也是影响药物处置的重要因素,例如在肝移植受者中,药物代谢主要器官是肝脏,药物在受体体内的代谢,同时受到供体肝脏相关基因的调控[45],供体基因多态性是免疫抑制剂肾毒性发生的重要影响因素[46]。
总之,ABCB1基因多态性对他克莫司的影响十分重要,下一步的研究重点是继续深究该基因多态性,在更多的中国患者群体中进行大规模和高质量的研究,探寻较为统一的结论,为其在器官移植受者中的个体化用药与临床实践提供可靠依据。

