胆汁酸膜受体TGR5在胆道疾病中的研究进展
陈思平,韩 丽,舒 鹏,代 鑫,程 龙
1 西南交通大学 医学院,成都 610031;2 西部战区总医院 全军普外中心,成都 610083
胆汁酸不仅作为清洁分子参与脂肪消化和疏水性化合物(如脂溶性维生素)吸收,也作为重要信号分子参与分泌、代谢、细胞增殖及分化、再生、纤维化和炎症等生理及病理生理过程[1]。胆汁酸发挥生物学作用不仅取决于其生化特性和浓度,更取决于其受体的表达及分布[2]。胆汁酸受体主要包括配体激活的核激素受体,如法尼酯 X受体和维生素D受体等,质膜结合的G蛋白偶联受体(G protein-coupled receptors,GPCR),如G蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor,GPBAR1,又称TGR5)、乙酰胆碱受体亚型3和鞘氨醇-1-磷酸受体2,以及其他胆汁酸感应分子如整合素和离子通道等。
近年来,TGR5作为最早被发现和证实的GPBAR,其在肝胆系统疾病发生发展中的作用和机制逐渐被学者所关注。新近研究显示,TGR5在多种胆道疾病中表达异常,且其表达水平与疾病的发生发展密切相关,可能成为预防和治疗相关疾病的新靶点。本文结合最新研究进展,总结胆汁酸受体TGR5在生理和病理条件下在胆道疾病发生发展中的作用和可能的机制。
1 TGR5的表达分布及生物学功能
1.1 TGR5的表达分布 TGR5是一种胆汁酸的跨膜G蛋白偶联受体,在人和小鼠体内广泛表达。从器官层面上看,TGR5主要在肝脏、胆囊、胃、肺脏和肠道中表达,在胎盘和脾脏中表达水平最高[3-4]。在人和啮齿动物肝脏中,TGR5主要存在于非实质细胞:肝窦内皮细胞,巨噬细胞(Kupffer细胞),大、小胆管的胆管上皮细胞(BEC)以及活化的肝星状细胞。最近有研究[5]发现肝细胞中也有TGR5表达,作为全身葡萄糖稳态的关键调节因子发挥作用。在胆囊中,TGR5在上皮细胞和平滑肌细胞中都有表达。除了高表达于上述器官组织中,TGR5也在胰腺β细胞、骨骼肌肉细胞、神经细胞和棕色脂肪细胞等细胞中表达。在胆道上皮细胞内,TGR5主要位于初级纤毛(从顶端质膜延伸到胆管或胆囊腔)、顶端质膜、核膜和细胞内囊泡结构。并且,其他细胞结构中也可能存在,Masyuk等[6]通过电子显微镜在大鼠胆汁中分离的外泌体上检测到TGR5。
1.2 TGR5生物学作用 胆汁酸是TGR5的内源性天然激动剂,游离型和结合型胆汁酸均能激活TGR5。体外研究[2,6]表明,未结合胆汁酸激活TGR5作用效力强弱的顺序依次是石胆酸>脱氧胆酸>鹅脱氧胆酸>胆酸。由于胆汁酸对TGR5的激动潜能取决于胆烷支架的疏水性以及共轭类型(效力:牛磺酸->甘氨酸->非共轭胆汁酸)[7],因此牛磺石胆酸(taurolithocholic acid,TLCA)是TGR5最有效的天然激动剂。除胆汁酸以外,TGR5还可被其他各种胆固醇代谢产物和类固醇激素激活,这可能是不同性别对TGR5信号的反应产生差异的原因[8]。
TGR5激活后可通过多种不同的信号通路(图1)发挥其生物学作用。(1)NF-κB信号通路:TGR5激活可以通过经典的TGR5-cAMP途径减少NF-κB依赖的炎症反应发生,抑制炎症因子分泌,从而发挥抗炎作用来影响疾病进程[9-14];通过TGR5-cAMP通路还可促进胆管上皮碳酸氢盐的分泌,发挥其保护胆管上皮免受胆汁酸毒性损伤的作用。(2)AKT信号通路:TGR5通过AKT-mTOR途径降低巨噬细胞趋化因子表达。mTOR是蛋白质翻译所必需的,主要以mTORC1和mTORC2的形式存在,它有助于促进细胞的存活和增殖。(3)ERK信号通路:TGR5通过激活活性氧(ROS)-酪氨酸激酶(cSrc)-EGFR-Erk1/2通路,进而促进细胞增殖[15-16]。(4)STAT3信号通路:最近研究[17]发现,TGR5通过JAK2/STAT3信号通路在非小细胞肺癌中促进细胞的生长和迁移。然而,Su等[13]却发现,TGR5通过抑制STAT3信号通路来拮抗肾癌细胞的增殖和迁移,提示TGR5可能通过不同的通路在不同的器官组织中发挥着不同的作用。而TGR5在胆道系统中的广泛表达,其可能通过相关信号通路在不同胆道系统疾病的发生与发展过程中扮演重要角色。
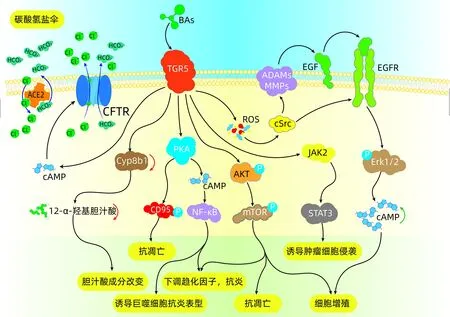
图1 TGR5相关通路示意图
2 TGR5与胆道系统生理及病理生理的关系
2.1 TGR5与胆汁酸代谢及循环 胆汁酸稳态的改变与很多疾病的发病机制密切相关。目前,越来越多的研究证实TGR5可通过调节胆汁酸的合成与分泌来维持胆汁酸的稳态。TGR5主要通过下调肝脏合成12-α-羟基胆汁酸所必需的合成酶CYP8b1的表达,减少12-α-羟基胆汁酸生成,从而在胆汁酸组成调节方面起重要作用。与此相符的是,Pathak等[18]发现TGR5受体激动剂6-α-乙基-23(S)-甲基-胆酸(6-EMCA,INT-777)作用于正常小鼠可以降低肝脏CYP8b1的表达。与野生型小鼠相比,TGR5-/-小鼠12-α羟基胆汁酸比例增加,疏水性胆汁酸增加[19],即牛磺胆酸增加,而3,4,5 -三甲氧基肉桂酸减少[19-20]。此外,Donepudi等[21]利用TGR5-/-小鼠模型研究显示,TGR5的表达缺失可引起胆汁酸合成替代途径的关键酶CYP7b1和CYP27a1水平降低。这些研究表明TGR5信号可以影响多种胆汁酸合成酶的表达水平,从而调节胆汁酸的合成代谢。
TGR5信号可影响胆管上皮重吸收胆汁中次级胆汁酸,进而调节胆汁酸的循环与分布。TGR5与钠依赖性胆汁酸转运体(ABST)共定位,一旦TGR5被激活,随后引起cAMP增加进而导致ABST插入顶膜,促进胆汁中胆汁酸被胆汁上皮细胞重吸收[22]。次级胆汁酸重吸收进入胆管上皮细胞后,可通过胆管周围血管丛回流至肝血窦而进入肝细胞,这一过程被称为“胆肝分流”,这种分流具有限制胆酸池的疏水性作用。此外,由于TGR5也表达于回肠黏膜上皮细胞,TGR5可同样通过ABST促进胆汁酸在回肠内的吸收,从而在胆汁酸“肠肝循环”中发挥重要作用。然而,TGR5在胆汁酸循环,尤其是“胆肝分流”中的确切信号分子机制和病理生理作用仍有待进一步探索。
胆汁酸正常的合成、分泌、重吸收维持着胆汁酸成分以及胆汁酸池大小的稳定,在正常机体活动中发挥着至关重要的作用。各种胆汁酸相关疾病的发生与发展,如肝炎、肝硬化、酒精性肝病、胆道结石等,都与胆汁酸稳态的改变密切相关。而TGR5可调节胆汁酸合成与分布,其在胆道系统疾病中的作用值得重视。
2.2 TGR5与胆管上皮黏液碳酸氢盐屏障 刺激TGR5的表达可通过促进胆汁中氯化物离子和碳酸氢盐的分泌,从而增强胆汁排泄[23-24]。胆管细胞和胆囊上皮细胞中配体通过与Gα(S)蛋白偶联而与TGR5结合,随后激活腺苷酸环化酶,触发cAMP升高,进而刺激囊性纤维化跨膜电导调节因子促进氯离子的分泌[22-23],并随后通过阴离子交换剂2(AE2)介导氯离子和碳酸氢盐在顶端质膜上的交换,促进碳酸氢根释放,导致富含碳酸氢盐与胆道上皮分泌的胆汁酸和胆碱黏蛋白可形成黏液碳酸氢盐保护膜(称为碳酸氢盐伞)(图1)。简而言之,TGR5受体通过AE2在胆管细胞的顶膜介导促胰液素刺激的胆汁碳酸氢盐的分泌,并调节细胞内pH的动态平衡,在保护胆管上皮细胞免受胆汁酸毒性损伤方面发挥着至关重要的作用。而碳酸氢盐的分泌缺陷,可导致胆管内胆汁酸质子化,质子化的胆汁酸可通过弥散作用进入胆管上皮细胞内,从而引起细胞的毒性损伤。
可见,碳酸氢盐伞是胆道上皮的重要保护屏障,胆道上皮细胞可以通过这一物理-化学屏障免受毒性胆汁酸的损害。TGR5表达的降低会引起氯离子和碳酸氢盐的分泌减少,导致屏障破坏,丧失保护功能,促进了胆道损伤相关疾病的发生与发展。但TGR5在碳酸氢盐伞形成及发挥作用中的具体机制目前仍不清楚,有待进一步研究。
2.3 TGR5与胆道上皮细胞增殖与凋亡 除了形成细胞保护屏障,TGR5的激活还与胆管细胞增殖密切相关。Reich等[16]在小鼠胆管细胞中发现TGR5通过激活ROS-Src-EGFR-Erk1/2通路,进而促进细胞增殖。然而,有研究者[6]发现,TGR5在纤毛细胞和非纤毛细胞中,发挥的细胞增殖相关功能截然相反。在纤毛细胞中,TGR5激活后与抑制性Gα(Ⅰ)蛋白共定位,引起细胞内cAMP水平降低,抑制细胞增殖;相反,在非纤毛细胞中,TGR5激活与刺激性Gα(S)蛋白共定位,增加了细胞内cAMP水平,诱导细胞增殖。除了促进分泌和影响增殖,TGR5的激活还可以促发抗凋亡信号,减少毒性胆汁酸及CD95死亡受体激活后引起的小鼠胆管细胞和胆管癌(CCA)细胞的凋亡[16]。
TGR5在不同的细胞可以通过不同的信号调节胆管细胞的正常增殖与凋亡,当这些信号机制发生紊乱时就可能引起胆道疾病的发生与发展。缺乏TGR5的情况下,在胆汁淤积疾病中的胆管细胞增殖反应会减弱,肝内和肝外胆管就会出现更多的细胞损伤;然而,TGR5的过度表达或受体的持续刺激可促进胆管细胞的增殖,导致多囊肝病发生,甚至CCA的进展。
3 TGR5与胆道疾病
3.1 TGR5与胆管炎性疾病 TGR5对全身及肝脏炎症起负向调节的作用。在Kupffer细胞[25]、单核细胞和巨噬细胞中,刺激TGR5表达可以减少趋化因子和细胞因子的表达和分泌,降低细胞吞噬功能,促进细胞产生持续的抗炎巨噬细胞表型,从而发挥强大的抗炎作用。研究[9]发现,与正常小鼠相比,TGR5-/-小鼠的炎症浸润增加,肝细胞凋亡增强。在Kupffer细胞中,用胆汁酸或合成激动剂刺激TGR5表达可抑制促炎细胞因子的表达和分泌[9,25-26]。以上研究表明,TGR5水平的降低可能减弱对细胞的炎症保护作用,更容易发生胆汁酸诱导的胆管细胞损伤。TGR5低表达可能使胆管细胞对胆汁酸毒性和胆汁淤积损伤更加敏感,例如同时进行胆汁酸强化饮食(胆酸,0.5%~1%,持续5~7 d)或胆总管结扎,与野生型小鼠相比,TGR5-/-小鼠适应性肝细胞和胆管细胞增殖反应减弱,出现更严重的淤胆性肝损伤[19,21-22]。但是,TGR5的靶向缺失却在很大程度上减弱了经胆汁酸喂养或胆总管结扎处理引起的胆管增生[16]。
原发性硬化性胆管炎(PSC)是一种自身免疫相关的慢性进行性淤胆性肝病,表现为肝内外胆管的炎症、纤维化甚至胆管消失,可最终导致胆汁性肝硬化、门静脉高压、肝衰竭等终末期肝病。通过全基因组关联研究发现,在PSC和溃疡性结肠炎(UC)患者中发现了一个位于染色体2q35区域的疾病易感基因,该基因序列中包含TGR5基因[27-28],这一发现提示TGR5可能与PSC和UC发病相关。然而,Franke等[27]对PSC患者和健康对照组重新测序,发现非同义突变在TGR5基因编码区中很罕见,认为其可能在PSC发病机制中并没有重要作用。但是,该研究也发现了TGR5基因非编码的第1个外显子(Rs11554825)中常见的单核苷酸多态性,该多态性与PSC和UC显著相关[23,27-28]。有人认为该外显子的单核苷酸多态性降低了TGR5 mRNA的表达。所以,PSC的发病机制可能与TGR5水平降低密切相关。在PSC患者和作为PSC动物模型的Abcb4(Mdr2)基因敲除小鼠的肝脏胆管细胞中,TGR5 mRNA和蛋白水平降低支持了这一假设[23,29]。近期Reich等[30]研究证实,PSC 患者和Abcb4-/-小鼠BEC中TGR5水平的降低通过促进反应性BEC表型的形成,加重了胆道损伤,从而导致硬化性胆管炎的发病。
TGR5的低水平表达影响胆汁合成和分泌,促进胆管细胞的增殖和凋亡以及降低对胆管细胞的炎症保护作用。因此,TGR5激动剂可能在治疗以胆管炎症为主要特征的淤胆性肝病中具有重要的潜在价值。但是,TGR5激动剂全身性使用会引起不必要的靶向副作用,如心率改变[31]、血压变化[32]和胆囊相关效应[24,33]等。其中最主要副作用可能就是抑制胆囊排空,导致胆结石形成和胆汁淤积。所以,进一步开发高效的TGR5激动剂相关药物以及如何安全有效的使用值得继续深入探究。
3.2 TGR5与CCA CCA是一种胆道上皮来源的低分化恶性肿瘤,近年来发生率不断增加且预后不良。据文献报道,胆盐可能不是直接促进CCA的发生,而是通过诱导胆管增生、促进肝脏炎症以及下调法尼酯 X受体等途径来间接促进CCA的发生和发展。
研究发现,TGR5在CCA细胞中过表达。Reich等[6]通过在蛋白水平上验证发现,人CCA组织TGR5表达水平是周围非肿瘤组织的胆管细胞的3倍。同样,肝内胆管癌细胞中TGR5 mRNA表达显著升高,在肝外,肝门周围的CCA组织中甚至更高[16,34]。因此,学者们猜想CCA组织中TGR5的高表达可能与CCA进展相关。
TGR5是胆汁酸诱导的体内外胆管细胞增殖的重要介质。虽然TGR5可以保护胆管细胞免受死亡受体介导的凋亡,这些机制可能在胆汁淤积条件下保护胆管细胞免受胆汁酸的毒性作用,但是也可能引起发生恶性转化的胆管细胞的增殖和凋亡抵抗,从而促进CCA的进展。
TGR5在CCA细胞系(EGI-1和TFK-1)[35]中表达,使用TGR5配体(TLCA或合成激动剂)处理这2种细胞可见TGR5激活后通过促进ROS-cSrc-MMP-EGFR-ERK1/2信号通路来触发细胞增殖[16],并促进了CCA细胞系的细胞迁移和侵袭。与上述实验结果一致,使用合成的TGR5激动剂或TLCA处理TGR5基因敲除的细胞,CCA细胞增殖减弱[16]。胆汁酸和TGR5在CCA进展中的作用也得到了进一步支持。由此可见,TGR5可能促进CCA细胞的增殖、侵袭和转移,从而影响CCA的发生发展。因此,TGR5抑制剂等相关药物的开发有望成为CCA治疗的新途径。
3.3 TGR5与胆囊结石 胆囊结石是最常见的胆石症,可引起急性胆囊炎、继发性胆总管结石、胆源性胰腺炎等并发症,且与胆囊癌发生相关。TGR5在胆囊上皮和平滑肌细胞中均有表达,与胆囊充盈和胆囊结石形成密切相关。TGR5信号激活后,主要通过激活cAMP-PKA通路,进而打开ATP敏感性钾通道引起胆囊平滑肌细胞超极化而松弛,导致胆囊收缩抑制和胆囊充盈增加[36]。多项研究[24,34,37]发现,TGR5-/-小鼠与野生型小鼠相比,胆汁分泌减弱以及平滑肌细胞松弛受损,其胆囊体积减小和胆汁流量减少。与此一致的是,给予野生型小鼠TGR5激动剂可以增加野生型小鼠的胆汁流量和胆囊体积[5,24,34,36-37]。在这一过程中意外发现,尽管TGR5基因敲除小鼠的胆囊松弛受损,但当喂食致石饮食时,该类小鼠却可以防止胆固醇晶体和胆结石的形成[24,38]。上述实验表明,TGR5表达及活性增加可能会导致胆囊收缩力减退而促进胆囊结石形成,TGR5表达降低或缺失可致胆囊松弛受损而防止胆囊结石形成,然而,其具体分子机制尚待进一步研究。
3.4 TGR5与其他胆道相关疾病 胆管细胞源性肝囊肿是多囊性肝病的主要病理特点,表明胆管细胞的病理生理改变在多囊性肝病发生发展中起着关键作用。TGR5刺激囊性胆管细胞产生cAMP,而cAMP可以触发囊状胆管细胞的增殖和分泌[39-40]。下调TGR5表达,可以减弱细胞增殖反应和囊壁生长[41]。因此,抑制TGR5表达及功能可能是一种潜在治疗多囊肝的有效策略。
4 小结与展望
TGR5广泛表达于机体各种器官及组织,被胆汁酸激活后,在物质与能力代谢方面发挥着重要作用。在胆道系统中,TGR5通过多种信号途径参与了胆汁酸的代谢与循环、胆管上皮的保护、胆管细胞的增殖与凋亡等生理过程。在病理情况下,当TGR5表达及活性发生改变时,可促进胆道系统炎症性疾病的发生与发展,并参与肿瘤的增殖及侵袭转移,同时也在胆石症及多囊性肝病的发生和进展过程中发挥重要作用。
然而,尽管学者已认识到TGR5在胆道疾病发生发展中发挥着重要作用,但其具体作用途径及分子机制尚不清楚。进一步探索TGR5在胆道炎症性疾病发生发展过程中发挥抗炎与促炎双向调节作用的分子机制是十分必要的,可为研发胆道炎症性疾病(如PSC、原发性胆汁性胆管炎等)新型治疗策略提供重要线索。同时,研究TGR5在CCA细胞侵袭转移中的作用与机制,可有助于阐明CCA生物学特性及分子机制,从而为研发CCA靶向治疗药物提供证据。此外,研发安全、有效的新型TGR5激动剂和抑制剂是将TGR5作为靶目标应用于胆道疾病治疗的重要前提。
综上所述,TGR5与胆道疾病发生与发展密切相关。提示调控胆道系统疾病TGR5的表达及活性可能是治疗胆道系统疾病的有效策略。进一步研究TGR5参与胆道疾病发生发展的途径及机制,并研发其安全、有效的激动剂和拮抗剂,对于胆道系统相关疾病的治疗具有潜在的重要价值。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:陈思平负责课题设计,拟定写作思路并撰写论文;韩丽、舒鹏、代鑫参与收集数据,修改论文;程龙负责指导撰写文章并最后定稿。

