转录因子GATA结合蛋白3对哮喘易感基因ADAM33表达的影响
芮菲菲, 杜娟, 郝忠分, 马世奇, 王雯, 束进
(江苏大学第四附属医院儿科, 江苏 镇江 212001)
随着分子生物学和分子遗传学发展,近来证实哮喘是一种多基因遗传病[1]。在众多哮喘易感基因中,第一个通过定位克隆鉴定发现与哮喘有关的易感基因为解整合素-金属蛋白酶33(a disintegrin and metalloproteinase 33,ADAM33)[2],其位于人类染色体20p13,含有22个外显子和21个内含子,编码膜锚定酶去整合素和金属蛋白酶结构域蛋白33,影响参与气道重塑的生长因子和细胞因子活性[3],从而诱导哮喘发作。
研究发现,GATA结合蛋白3(GATA binding protein 3,GATA3)在哮喘患者的支气管肺泡灌洗液及外周血单个核细胞中呈高表达[4]。全基因组关联分析发现,GATA3单核苷酸多态性位点rs10905284是哮喘发病的重要危险因素[5]。由此可见,GATA3表达与哮喘的发生发展密切相关。GATA3可作为调节T细胞分化为Th2细胞的关键转录因子,其表达上调激活气道和小气道黏膜Th2细胞,引起一系列细胞炎性因子(IL-4、IL-5、IL-9及IL-13)释放[6],从而导致哮喘发作。ADAM33与血清IL-4、IL-1含量呈正相关,其表达可能受Th2型细胞因子调控[7],进而诱导哮喘的发生发展。由此推测,转录因子GATA3可能通过与ADAM33启动子结合影响ADAM33表达从而引起哮喘发作。因此本研究以人HEK293T、BEAS-2B细胞为研究对象,探讨GATA3对ADAM33转录调控的影响。
1 材料与方法
1.1 细胞和主要试剂
人肾脏HEK293T细胞和人正常肺上皮BEAS-2B细胞购自美国典型培养物保藏中心;DMEM高糖培养基、胎牛血清(美国Gibco公司);KpnⅠ和BglⅡ酶(美国NEB公司);双荧光素酶试剂盒(美国Promega公司);DNA高保真酶、DNA DL5000及DL2000标准参照物、实时荧光定量PCR试剂盒(日本TaKaRa公司);T4DNA连接酶、GenGreen核酸染料(美国Thermo Fisher公司);感受态大肠埃希菌DH5α、PCR引物、转染试剂Lipofectamine 3000、pcDNA-GATA3质粒及pcDNA3.1质粒、RNA 提 取 试 剂Trizol均为美国Invitrogen公司产品;琼脂糖粉(西班牙Biowest公司);胶回收试剂盒、质粒提取试剂盒(美国Omega公司)。
1.2 细胞培养
将人HEK293T、BEAS-2B细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的高糖DMEM,于37 ℃、5% CO2培养箱进行培养。
1.3 重组报告质粒的构建与鉴定
以GenBank数据库中的人ADAM33基因(转录本2,NM-153202)mRNA序列为模板,用Primer 5.0设计特异性引物,在上、下游引物5′端分别加入KpnⅠ和BglⅡ酶切位点,酶切位点前加保护碱基,上游引物分别为P1:5′-CGGGGTACCGCCTGGCCAAG-ACCAGGAGTTTGAG-3′;P2:5′-CGGGGTACCAGA-ATCGCTTGAACCAGGGAGTCGG-3′;P3:5′-CGGGGTACCCGGCCTTTGCCCACCGCCTCATCCC-3′;P4:5′-CGGGGTACCGGAGTGGCGACCCGGCTCCCCCATG-3′;P5:5′-CGGGGTACCGGAGGCGGGAGCGAGGGCGG-GCGGT-3′;下划线部分为KpnⅠ酶切位点;共用下游引物:5′-GGAAGATCTGCTGGATTGCGGCCGACCCGTGCC-3′(下划线部分为BglⅡ酶切位点)。以BEAS-2B细胞的DNA为模板,行PCR扩增,反应体系:DNA聚合酶 0.5 μL,5×缓冲液5 μL,dNTP混合物2 μL,cDNA 0.5 μL,上游引物0.5 μL,下游引物0.5 μL,双蒸水16 μL,共25 μL。扩增条件:98 ℃ 10 s,60 ℃ 15 s,68 ℃ 1 min,30个循环;4 ℃保存。扩增产物进行电泳;回收目的片段条带并进行纯化;将纯化产物及报告基因质粒pGL3-Basic行KpnⅠ和BglⅡ双酶切、电泳、纯化;用T4DNA连接酶将纯化的目的基因与pGL3-Basic载体连接,并转化至感受态大肠埃希菌DH5α,培养过夜;选取若干个菌落加到培养基中混匀,取适量菌液为模板,PCR扩增后电泳,将出现目的条带的菌液送至测序公司进行测序,再将测序正确的菌液取适量振荡培养过夜后进行质粒的小量制备,构建P1、P2、P3、P4、P5等不同长度的ADAM33质粒。
1.4 重组质粒中ADAM33基因启动子活性鉴定
将人HEK293T、BEAS-2B细胞按构建的ADAM33质粒分为P1、P2、P3、P4、P5组及pGL3-Basic组。将细胞按每孔1.5×104个细胞密度接种于96孔板,每组3个复孔,培养24 h,用转染试剂Lipofectamine 3000对其进行转染。先配制a液:5 μL无血清培养基+0.2 μL Lipofectamine 3000;再配制b液:5 μL无血清培养基+100 ng不同的ADAM33质粒(P1、P2、P3、P4、P5)或100 ng pGL3-Basic质粒+4 ng pRL-TK质粒(为海肾荧光素酶报告载体,含有SV 40增强子,该质粒起内参作用)+0.2 μL转染试剂;然后,将a液与b液混匀,室温放置5 min;最后,将混合液滴至孔内孵育24 h;弃培养基,PBS洗涤;每孔分别加入细胞裂解液,摇床振荡20 min将细胞充分裂解。按双荧光素酶活性检测试剂盒说明书对每孔进行加样并充分混匀,然后测定荧光素酶活性(A值)和海肾荧光素酶活性(B值),计算荧光活性比值(A/B)分析重组质粒启动子活性。重复3次实验。
1.5 双荧光素酶报告基因法检测不同转染细胞中ADAM33启动子活性
将HEK293T、BEAS-2B细胞分别分为pcDNA-GATA3组和pcDNA3.1对照组,分别转染GATA3过表达质粒和空白对照质粒。当细胞融合达60%左右时,按每孔1.5×104个细胞密度接种于96孔板,每组3个复孔,用转染试剂Lipofectamine 3000转染HEK293T、BEAS-2B细胞,转染方法及荧光素酶活性检测同“1.4”,实验重复3次。
1.6 实时荧光定量PCR检测ADAM33 mRNA表达
取“1.5”分组细胞,当BEAS-2B细胞融合60%左右时,按每孔1.5×105个细胞密度接种于12孔板,用转染试剂Lipofectamine 3000对BEAS-2B细胞进行转染。转染方法同“1.4”。
用Trizol试剂提取转染后BEAS-2B细胞总RNA,并逆转录为cDNA。逆转录反应体系:5×PrimeScript RT Master 2 μL,RNA样品和无RNA酶双蒸水8 μL,总反应体系为10 μL。逆转录反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。实时荧光定量PCR反应体系:8.2 μL DEPC水、10 μL SYBR Premix ExTaqⅡ和上、下游引物各0.4 μL、1 μL cDNA;扩增条件:95 ℃预变性3 min,95 ℃变性5 s,56 ℃退火30 s,循环42次;熔解:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。ADAM33mRNA引物序列:上游为5′-CTGGGTCCTGGATGGACAAC-3′,下游为5′-CAGCAGCCTGTGGTTCTTCT-3′。以GAPDH为内参基因,对实验结果数据进行分析:mRNA相对表达量=2-ΔΔCt;ΔCt=Ct目的基因-Ct内参基因;ΔΔCt=ΔCt实验组-ΔCt对照组。设对照组mRNA相对表达量为1,实验重复3次。
1.7 统计学分析

2 结果
2.1 ADAM33基因5′侧翼区重组质粒的构建
以BEAS-2B细胞基因组的DNA为模板经PCR扩增ADAM335′侧翼区的基因序列,电泳结果显示有特异性条带出现,长度约为1 953 bp,与预测片段长度相符(图1A)。重组质粒经双酶切、电泳出现2条条带(图1B),其中一条约为4 818 bp,另一条约为1 953 bp,表明目的片段已插入pGL3-Basic载体。重组质粒经测序后行Blast比对,结果显示,其与GenBank中登记的ADAM33基因序列相同,表明含ADAM33基因启动子的质粒构建成功。重组的5′侧翼区不同长度的ADAM33截短质粒经双酶切,电泳出现2条条带,一条约为4 818 bp,另一条分别约为1 953 bp、853 bp、363 bp、174 bp、97 bp(图1C)。将选用的GenBank数据库中ADAM33mRNA序列5′末端为转录起始位点定义为+1,构建的质粒分别命名为P1:pGL3-1880/+73;P2:pGL3-780/+73;P3:pGL3-290/+73;P4:pGL3-101/+73;P5:pGL3-24/+73。经外送测序及Blast比对,证实重组的不同长度的启动子质粒序列与GenBank中登记的ADAM33基因序列相同。
2.2 ADAM33基因启动子的活性鉴定
结果显示,与pGL3-Basic组相比,HEK293T、BEAS-2B细胞中P1、P2、P3、P4、P5重组质粒荧光素酶活性明显增高(P<0.05或P<0.01),其中,启动子活性最高的均为P3质粒。当启动子质粒进一步缺失至-24 bp时(P5),与pGL3-290/+73质粒(P3)相比,启动子活性在HEK293T细胞和BEAS-2B 细胞中均降低,呈现大幅度下降(图2),说明在-290 bp~-24 bp区域存在重要的正性调控元件。由此表明,ADAM33核心启动子序列位于-290 bp~+73 bp。
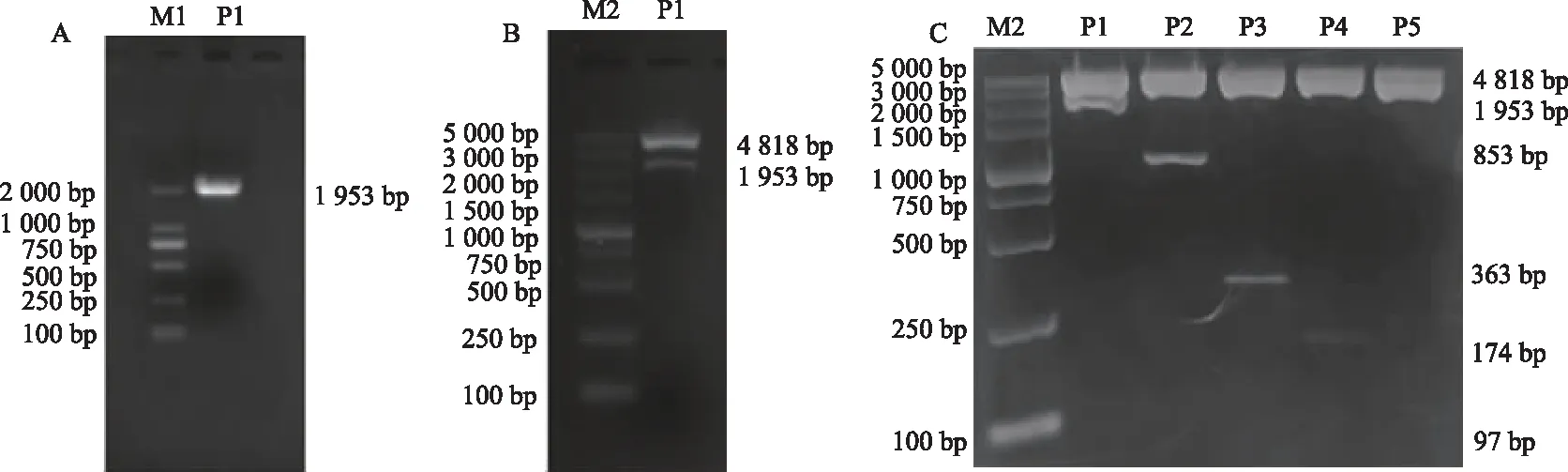
M1: DNA2000标准参照物;M2: DNA5000标准参照物;P1: pGL-1880/+73;P2: pGL-780/+73;P3: pGL-290/+73;P4: pGL-101/+73;P5: pGL-24/+73;A: ADAM33基因5′侧翼区序列PCR产物的琼脂糖凝胶电泳结果;B: 含ADAM33基因启动子的重组质粒的双酶切结果;C:重组的截短质粒酶切鉴定结果

a: P<0.05,b: P<0.01,与pGL3-Basic组比较
2.3 GATA3上调ADAM33基因启动子活性
在HEK293T、BEAS-2B细胞中,与pcDNA3.1组相比,pcDNA-GATA3组ADAM33重组质粒pGL3-1880/+73的启动子荧光素酶活性明显增加(t=9.21,20.48,P<0.05或P<0.01),表明GATA3上调ADAM33基因启动子活性。见图3。
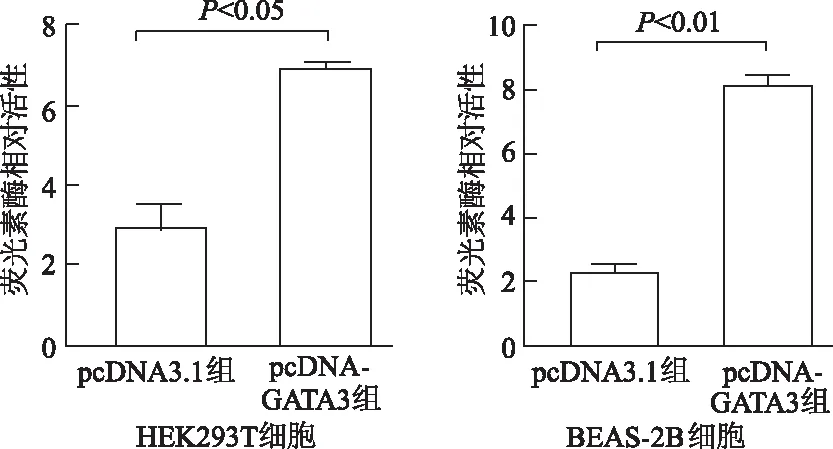
图3 不同细胞中荧光素酶相对活性比较
2.4 GATA3上调ADAM33 mRNA表达
由图4可见,与pcDNA3.1组相比,BEAS-2B细胞中pcDNA-GATA3组ADAM33mRNA相对表达量显著增加(t=23.57,P<0.05),表明GATA3可上调ADAM33mRNA表达。

图4 BEAS-2B细胞中ADAM33 mRNA相对表达水平比较
3 讨论
本研究以GenBank数据库中报道的人ADAM33基因(NM-153202)为模板,成功构建含人ADAM33启动子的一系列截短重组质粒;并且发现在HEK293T、BEAS-2B细胞中,pGL3-290/+73质粒启动子活性最高,ADAM33基因的核心启动子序列位于该基因-290 bp~+73 bp。这与先前Yang等[8]研究所得到的结论相比,即ADAM33基因启动子序列在-550 bp~+87 bp具有活性,进一步明确了ADAM33基因启动子的核心序列所在位置。
本研究发现在HEK293T、BEAS-2B细胞中,过表达GATA3质粒可增强ADAM33启动子活性。HEK293T细胞易被转染,可作为功能细胞用于检测ADAM33启动子活性,但其为人体肾脏细胞系,不是肺组织相关细胞,利用其检测过表达GATA3质粒对ADAM33mRNA的表达影响意义不大,故本研究仅在人正常肺上皮BEAS-2B细胞中检测,结果发现过表达GATA3质粒可上调ADAM33mRNA表达。JASPAR网站(http://jaspar.genereg.net)预测表明,ADAM33基因的核心启动子区域含有GATA3、EGR1、SOX18、KLF5和E2F1等转录因子结合位点。本研究结果提示转录因子GATA3通过与ADAM33启动子结合增加ADAM33表达,从而可能诱导哮喘发生。这与既往研究[9-10]中GATA3能够激活IL-4、IL-13基因的启动子,上调二者表达相一致。此外,有研究发现,通过T-bet/GATA-3途径调节相关细胞因子(IL-4、IL-5、IL-9及IL-13)水平和Th1/Th2比值可减轻哮喘大鼠气道炎症及减轻哮喘症状[11]。由此,本实验结果进一步表明GATA3与哮喘发生密切相关。
综上所述,本研究表明,转录因子GATA3与ADAM33基因的核心启动子区域结合,上调人哮喘易感基因ADAM33启动子活性及mRNA表达,但具体与哪个区域结合,还需后续行染色质免疫沉淀和凝胶迁移等实验进一步研究。
——一道江苏高考题的奥秘解读和拓展

