例析碳酸钠性质的实验探究
卞蓉蓉
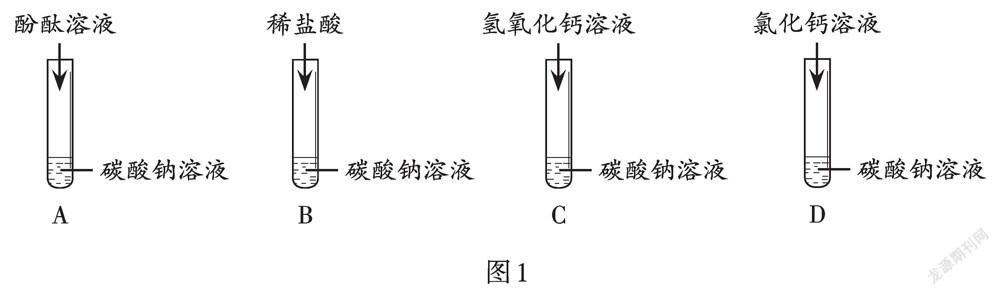

原题呈现
同学们在验证碳酸钠的化学性质时,分别取少量的碳酸钠溶液于四支试管中,做了如图1实验。
(1)A试管中溶液变为红色,说明碳酸钠溶液显 ________性。
(2)B试管中有气泡产生,发生反应的化学方程式为________。
(3)C试管中发生反应的化学方程式为________。
(4)D试管中产生明显的现象是________。
(5)实验结束后,同学们将上述四支试管中的物质倒入同一烧杯内,烧杯底部有白色固体,上层为红色溶液。为处理废液,将烧杯内混合物过滤后,向红色滤液中加入稀盐酸,有气泡产生,说明滤液中一定没有的溶质为________(填字母序号)。
A. 氢氧化钠 B. 碳酸钠 C. 氯化钙 D. 氢氧化钙
(6)继续加稀盐酸至溶液颜色恰好消失,此时溶液中的溶质为________(除酚酞外)。
解析:(1)酚酞遇碱性溶液变红色,A试管中溶液变为红色,说明碳酸钠溶液显碱性。
(2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,据此写出化学方程式。
(3)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠。
(4)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,所以D试管中可观察到有白色沉淀生成。
(5)将上述四支试管中的物质倒入同一烧杯内,混合后溶液中涉及的离子有:H+、Na+、Ca2+、OH-、CO[2-3]、Cl-。烧杯底部有白色固体,上层为红色溶液,说明上层液体显碱性,为处理废液,将烧杯内混合物过滤后,向红色滤液中加入稀盐酸,有气泡产生,说明滤液中一定含有CO[2-3],CO[2-3]与H+反应生成水和二氧化碳,CO[2-3]和Ca2+反应生成碳酸钙沉淀,所以滤液中一定没有H+和Ca2+。OH-可能存在,也可能不存在(被H+反应掉),Na+、Cl-不与滤液中的其他离子反应,它们一定存在。所以滤液中一定存在Na+、Cl-、CO[2-3],可能存在OH-,一定不存在H+、Ca2+。故滤液中一定有碳酸钠、氯化钠,可能有氢氧化钠,一定没有氯化钙、氢氧化钙。
(6)滤液中一定有碳酸钠、氯化钠,可能有氢氧化钠,继续加稀盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠和盐酸反应生成氯化钠和水,所以继续加稀盐酸至溶液颜色恰好消失,此时溶液中的溶质为NaCl。
答案:(1)碱 (2)Na2CO3 + 2HCl [ ] 2NaCl + H2O + CO2↑ (3)Ca(OH)2 + Na2CO3 [ ] CaCO3↓+ 2NaOH (4)有白色沉淀生成 (5)CD (6)NaCl
方法总结
1.碳酸钠溶液中存在碳酸根离子,检验时可以滴加稀盐酸,观察是否产生气泡;也可以滴加含钙离子的溶液,观察是否有沉淀生成。
2.分析废液混合后溶质的成分,主要依据离子共存问题的原理,即先根据实验中所用物质确定混合后烧杯中涉及的所有离子,然后根据实验现象确定离子的存在情况(即一定存在、可能存在,还是一定不存在),再根据一定存在的离子,排除与它反应的离子,最后由离子的存在情况确定物质的存在情况。
3.离子共存问题:
(1)常见的不能大量共存的离子:OH-不能与H+、Mg2+ 、Cu2+ 、Fe3+、NH4+大量共存;H+不能与OH-、CO[2-3]、HCO[-3]大量共存;CO[2-3]不能与 H+ 、Ca2+ 、Ba2+大量共存;SO[2-4]不能与Ba2+大量共存;Cl-不能与Ag+大量共存。
(2)根據反应现象推断一定不存在的离子:有CO2生成——溶液中一定不存在OH- ;有CaCO3、BaCO3、Cu(OH)2、Fe(OH)3、Mg(OH)2 沉淀生成——溶液中一定不存在 H+ 。
能力强化
(2021·北京·平谷区二模)烧杯A中盛有一定量的碳酸钠溶液,进行如图2所示的实验。
(1)碳酸钠溶液显碱性,得出此结论的依据是________。
(2)步骤②中发生反应的化学方程式为________。
(3)步骤③观察到的现象是烧杯中产生气泡,红色褪去,________。
(作者单位:南京师范大学盐城实验学校)
答案:(1)无色酚酞溶液变红色 (2)Ca(OH)2 + Na2CO3 [ ] CaCO3↓+ 2NaOH (3)沉淀逐渐消失

