从“粗提”到“精制”
陈志鹏 洪兹田

粗盐中除氯化钠外,还含有泥沙等难溶性杂质和CaCl2、MgCl2、Na2SO4等可溶性杂质。为制得试剂(或医用)级氯化钠,需除去这些难溶性杂质和可溶性杂质。
[要点提炼]
一、粗盐中难溶性杂质的去除实验(“粗提”)
1.主要步骤:溶解→过滤→蒸发(或蒸发结晶)。
2.应用次数最多的玻璃仪器是玻璃棒,溶解时玻璃棒的作用是搅拌,加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止因局部过热造成液滴飞溅。
3.注意事项
(1)过滤时应注意“一贴、二低、三靠”。“一贴”即滤纸紧贴漏斗内壁;“二低”即滤纸边缘低于漏斗边缘,滤液面低于滤纸边缘;“三靠”即倾倒液体的烧杯口紧靠玻璃棒,玻璃棒下端靠在三层滤纸上,漏斗下部尖端紧靠承接液体的烧杯内壁。
(2)蒸发时,当蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热将剩余的滤液蒸干。
二、粗盐中可溶性杂质的去除实验(“精制”)
假设粗盐经“粗提”后的可溶性杂质为MgCl2、CaCl2。
1.步骤方法
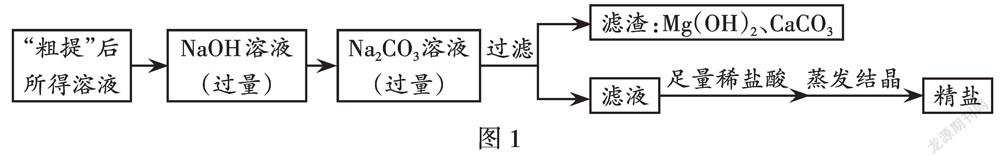
要得到纯净的NaCl固体(精盐),应选择合适的试剂除去其中的可溶性杂质,具体流程如图1。
(1)除杂时应尽量不引入新杂质,即使引入也要选择容易被除去的,最好能反应生成所需要的物质。
(2)加入的NaOH溶液、Na2CO3溶液必须过量,试剂加入顺序可调换。若调换了试剂的加入顺序,则实现的转化也要相应调换,但不影响实验结果。
(3)加入的过量除杂试剂应能在下一步骤(或最后步骤)被除去。加足量稀盐酸的目的是除去前面步骤剩余的过量的NaOH、Na2CO3。在除杂的同时,也将杂质转化为产品NaCl。
(4)蒸发结晶时,利用稀盐酸和水易挥发的性质,除去前面步骤的过量的除杂试剂稀盐酸和溶剂水,以获得较为纯净的NaCl晶体(精盐)。
(1)母液为NaCl的__________(填“饱和”或“不饱和”)溶液。
(2)试剂X为__________(填字母序号)。
A. NaOH B. KOH C. NaNO3
(3)操作Y为__________。
(4)加适量盐酸的作用是为了除去__________(填物质名称或化学式)。
解析:(1)母液为析出NaCl晶体之后的溶液,一定是NaCl的饱和溶液。
(2)加入試剂X的目的是为了除去Mg2+,试剂X为NaOH溶液(若选用KOH,会引入新杂质KCl,故B错误)。
(3)操作Y是将滤渣与溶液分离,故为过滤操作。
(4)经过操作Y(过滤)后,滤液中含有过量的除杂试剂Na2CO3和NaOH,加适量盐酸调pH = 7的目的是为了除去前面步骤的过量除杂试剂(Na2CO3和NaOH),得到NaCl。
答案:(1)饱和 (2)A (3)过滤 (4)碳酸钠、氢氧化钠(或Na2CO3、NaOH)
(作者单位:福建省厦门市翔安第一中学)

