UPLC-MS/MS 法同时测定人血浆中泊沙康唑、氟康唑、伏立康唑的血药浓度
张飞雨,张瑞霞,高慧儿,张弋
(1.天津医科大学一中心临床学院,天津 300192;2.天津市第一中心医院药学部,南开大学医学院,天津 300192)
唑类抗真菌药物的药代动力学均受较多因素影响,导致患者服药后个体间及个体内血药浓度差异较大,如泊沙康唑的吸收与饮食、剂型、患者生理病理状态等因素有关[4],氟康唑在中枢神经系统真菌感染的患者或肾功能不全的患者体内血药浓度会显著增加[5],伏立康唑的代谢为非线性药代动力学特征,血药浓度变异性较大[6]。在英国医学真菌学协会出版的《抗真菌治疗药物监测指南》中推荐FLU、POS 和VRC 均应根据患者实际用药情况进行血药浓度监测[7]。本研究旨在建立同时测定3 种三唑类抗真菌药物的LC-MS/MS 方法,节约成本,并为临床抗真菌药物的合理应用提供参考。
1 材料与方法
1.1 仪器、药品及试剂
1.1.1 仪器 Waters ACQUITY UPLC I-Class 系统和Xevo TQD 质谱仪,BY-G20 普通高速离心机(北京白洋医疗器械有限公司);UMV-2 多管涡旋混合仪(北京优晟仪器有限公司);SB-5200DT 型数控超声波清洗器(宁波新芝生物科技股份有限公司)。
1.1.2 药品及试剂 FLU(中国食品药品检定研究院,纯度99.8%,批号100314-201906);POS(美国TRC公司,纯度98%,批号3-JLW-13-1);VRC(中国食品药品检定研究院,纯度99.8%,批号100862-201903);泊沙康唑-D4(POS-D4,美国TRC 公司,同位素丰度96.3%,批号12-MRS-161-1);氟康唑-D4(FLU-D4,美国TRC 公司,同位素丰度99.5%;批号7-MMH-92-2);伏立康唑-D3(VRC-D3,美国TRC 公司,同位素丰度99.3%,批号5-JUZ-42-1);乙酸铵(上海安谱科学仪器有限公司);甲酸(上海安谱科学仪器有限公司);甲醇(德国默克股份两合公司);实验用水为广州屈臣氏蒸馏水。
1.2 色谱及质谱条件
1.2.1 色谱条件 色谱柱为ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm),流动相A 为0.1%甲酸,2 mmol/L 乙酸铵水溶液,流动相B 为0.1%甲酸,2 mmol/L 乙酸铵甲醇溶液,梯度洗脱,流速为0.5 mL/min,进样量10 μL。
1.2.2 质谱条件 采用多反应监测模式(MRM),正离子模式,电喷雾离子源(ESI)扫描。锥孔电压、碰撞能量、毛细管电压、离子源温度及脱溶剂气温度等质谱参数见表1。
根据肾虚性质偏于阴虚或阳虚选用六味地黄丸(仲景宛西制药有限公司,生产批号:151010)和金匮肾气片(特一药业集团股份有限公司,生产批号:20150902),六味地黄丸每次8粒,每日3次,金匮肾气片每次4片,每日2次。口服10天为1个疗程,连续治疗3个疗程。
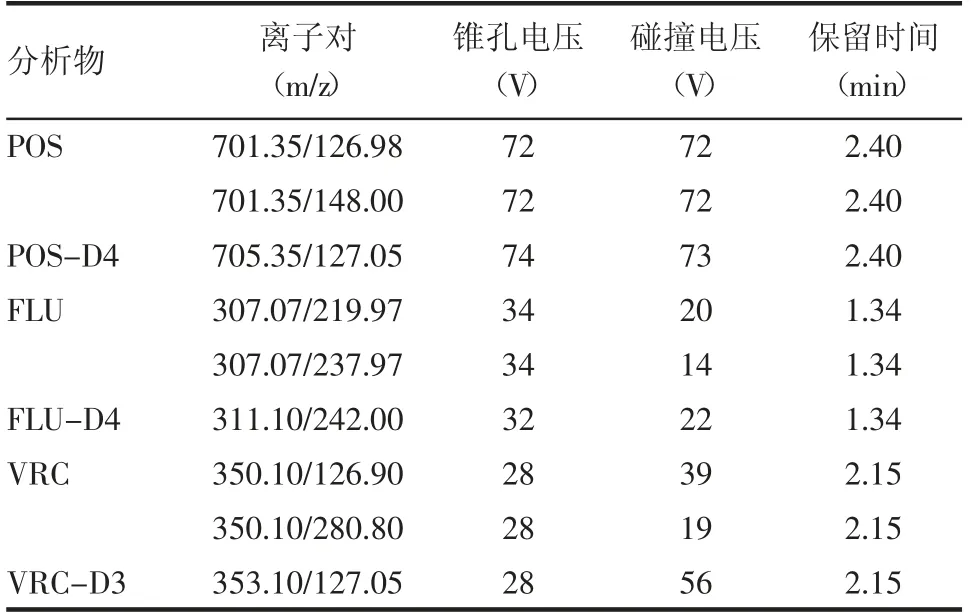
表1 POS、FLU、VRC 及其内标的质谱检测参数Tab 1 Mass spectrometric detection parameters of posaconazole,voriconazole,fluconazole and their internal standards
1.3 溶液及血样样品的配制
1.3.1 POS、FLU 和VRC 标准品溶液的配制 精密称取POS 0.041 36 g、FLU 0.164 15 g、VRC 0.040 17 g,分别置于10 mL 棕色容量瓶中,甲醇溶解并定容至刻度,摇匀,配制浓度为4 136、16 415、4 017 μg/mL的标准品储备液。取适量储备液,用甲醇稀释为质量浓度分别为1 641.5、413.6、401.7 μg/mL 的混合对照品溶液。取混合对照品溶液,用甲醇倍比稀释为梯度工作液,POS 浓度为413.60、165.44、82.72、33.09、15.50、6.62、1.65 μg/mL,FLU 浓度为1 641.50、656.60、328.30、131.32、65.66、26.26、6.57 μg/mL,VRC 浓度为401.70、160.68、80.34、32.14、16.07、6.43、1.61 μg/mL。同时用甲醇配制质控样品溶液,POS、FLU、VRC浓 度 分 别 为330.88、66.18、2.65 μg/mL,1 313.20、262.64、10.51 μg/mL,321.36、64.27、2.57 μg/mL。所有溶液-20 ℃避光保存,临用时取用。
1.3.2 内标工作液的配制 精密称取POS-D4、FLU-D4、VRC-D3 各1.0 mg 分别置于100 mL 棕色容量瓶中,甲醇溶解并定容至刻度,摇匀,配制成含POS-D4、FLU-D4、VRC-D3 均为10μg/mL 的内标储备液。取适量储备液,100 μL 甲酸,用甲醇稀释为浓度分别为0.2、1.0、0.2 μg/mL 的混合内标工作液。-20°C 避光保存备用。
1.3.3 标准曲线和质控样品的配制 分别精密量取“1.3.1”项下梯度工作液各10 μL,加入空白人血浆190 μL,涡旋1 min,制成POS 浓度范围为0.083~20.680 μg/mL,FLU 0.328~82.075 μg/mL,VRC 0.080~20.085 μg/mL 的混合血浆样品。分别精密量取“1.3.1”项下质控样品溶液各10 μL,加入空白人血浆190 μL,涡旋1 min,制成POS、FLU、VRC 浓度分别为0.132、3.309、16.544 μg/mL,0.525、13.132、65.660 μg/mL,0.129、3.214、16.068 μg/mL 低、中、高3 个浓度的混合质控血浆样品。
1.3.4 血浆样品预处理 取血浆样品200 μL,加入600 μL 内标工作液,涡旋1 min,13 000 r/min 离心10 min,上清液过0.22 μm 微孔滤膜后取300 μL,加入900 μL 纯水,混匀置于进样小瓶中,取10 μL 进样分析。
1.4 方法学验证
1.4.1 专属性 分别取空白血浆,空白血浆加入POS、FLU、VRC 标准品和内标溶液,患者服用POS、FLU、VRC 后的血浆样品,按照“1.3.4 项”处理后进样。
1.4.2 提取回收率和基质效应 用不同来源的空白血浆制备POS、FLU、VRC 低、中、高3 个浓度的质控样品,按照“1.3.4 项”处理,将对照品与内标峰面积的比值记为A;用甲醇替代上述过程中的血浆,加入内标,将混合标准品储备液稀释为与A 中质量浓度相同的3 个浓度的质控样品,将对照品与内标峰面积的比值记为B;取不同来源的空白血浆按照“1.3.4 项”步骤处理后加入混合标准品储备液,用甲醇稀释为与上述质量浓度相同的3 个浓度质控样品,对照品和内标峰面积比值记为C。A/C 值为各化合物的提取回收率,C/B 为基质效应。
1.4.3 标准曲线和最低定量限 取含POS 浓度范围为0.083~20.680 μg/mL,FLU 为0.328~82.075 μg/mL,VRC 为0.080~20.085 μg/mL 的混合血浆样品,每一浓度各制备3 份,按照“1.3.4 项”处理后进样。分别以待测物与对应内标峰面积比值(Y)对POS、FLU、VRC 质量浓度(X)作线性回归分析(W=1/C)。
1.4.4 精密度和准确度 分别取POS、FLU、VRC 低、中、高3 个浓度的质控样品,每个浓度平行制备5 份,按照“1.3.4 项”处理,连续3 d 每天制备一批并进样分析,计算批内及批间精密度(RSD)和准确度(RE)。
1.4.5 稳定性 配制POS、FLU、VRC 低、中、高3个浓度的质控样品,每个浓度平行制备3 份,分别考察室温放置24 h、进样器(10℃)放置8 h、4℃放置24 h、-20℃冻融循环3 次和-20℃放置30 d 后的稳定性。
2 结果
2.1 专属性 进样后色谱图显示,FLU、VRC 、POS的保留时间分别为1.34、2.15、2.40 min。空白血浆中的内源性物质在相应药物及内标色谱峰保留时间内均无干扰峰,各物质色谱图见图1。

图1 POS、FLU、VRC 和内标POS-D4、FLU-D4、VRC-D3 在血浆中的色谱图Fig 1 Representative chromatography of POS FLU,VRC and POS-D4,FLU-D4,VRC-D3 in plasma
2.2 提取回收率和基质效应 各待测物3 种浓度的基质效应为94.5%~148.8%,RSD<14.2%;提取回收率在59.7%~77.5%,RSD<14.0%。结果见表2。
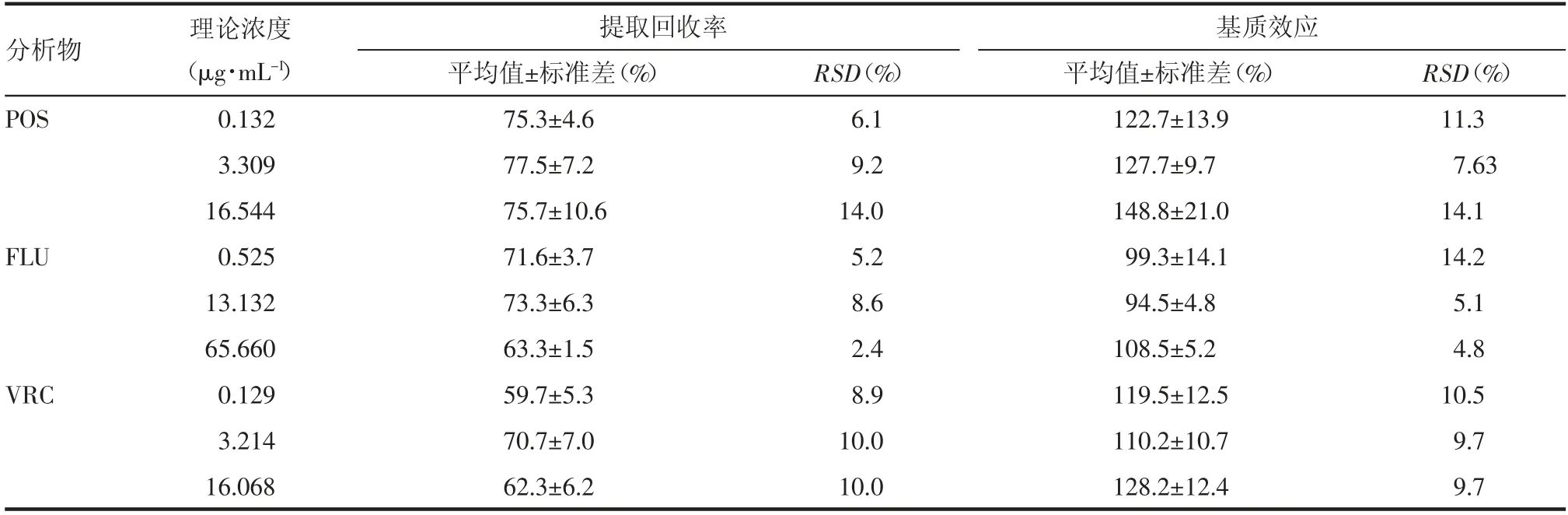
表2 POS、FLU、VOC 标准人血浆样品内标归一化的提取回收率及基质效应(n=6)Tab 2 The normalized extraction recovery rate and matrix effect of the internal standard of POS,FLU,VOC standard human plasma samples(n=6)
2.3 标准曲线和最低定量限 结果表明,人血浆中POS、FLU、VRC 浓度分别在0.083~20.680、0.328~82.075、0.080~20.085 μg/mL 范围内具有良好的线性关系,标准曲线如图2。
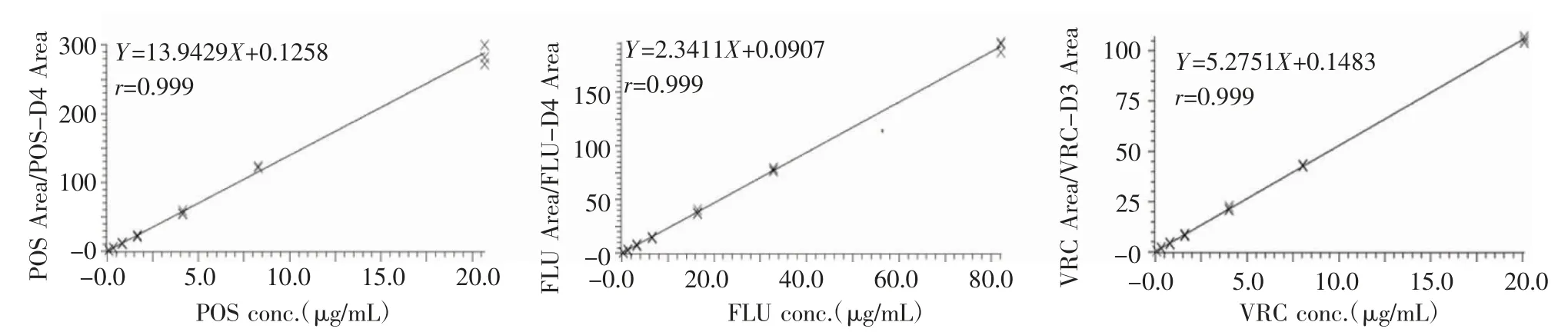
图2 POS、FLU、VRC 在血浆样品中的标准曲线Fig 2 The standard curve for the plasma sample of POS,FLU,VRC
2.4 精密度和准确度 各待测物的批内及批间RE为-8.61%~10.16%,RSD<7.60%,见表3。

表3 POS、FLU、VRC 在血浆中的批内及批间RSD、RE(n=5)Tab 3 The RSD and RE within and between batches for POS,FLU and VRC in plasma sample(n=5)
2.5 稳定性 各待测物3 个不同浓度的质控样品分别在室温放置24 h、进样器(10℃)放置8 h、4℃冰箱放置24 h、冻融循环3 次、-20℃冰箱冷冻30 d 后依然能够保持稳定,RSD 均<10.69%,见表4。
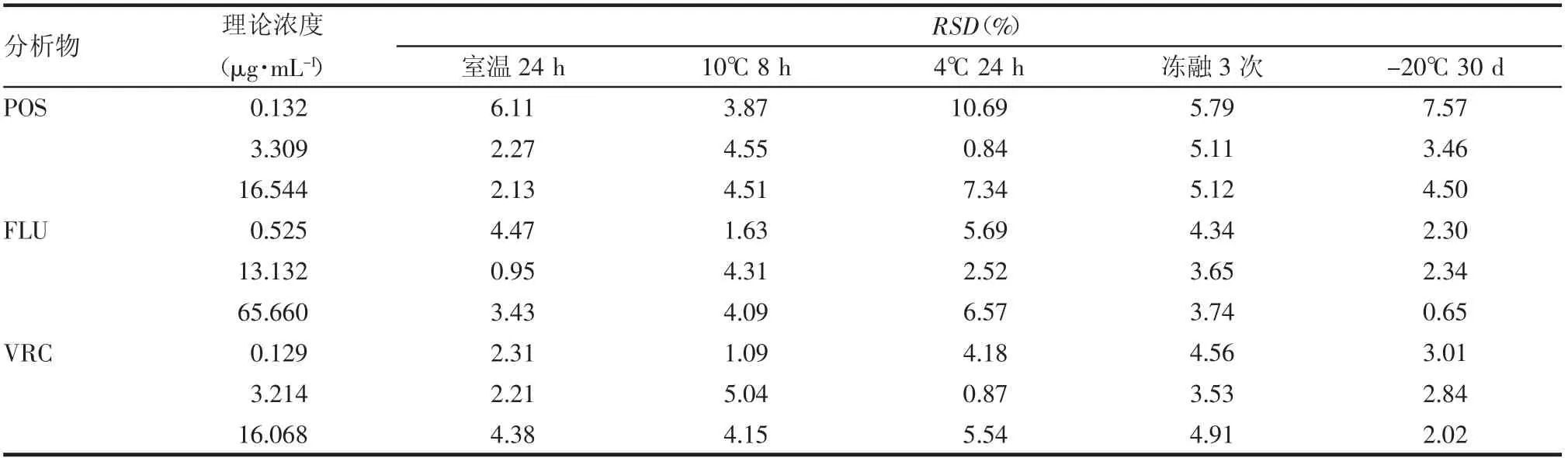
表4 POS、FLU、VRC 在不同条件下的稳定性(n=3)Tab 4 Stability of POS,FLU,VRC at different storage conditions(n=3)
3 讨论
POS、FLU、VRC 均呈弱碱性,为改善使用纯水、纯甲醇作为流动相的色谱峰拖尾及响应强度弱等现象,两相中均加入0.1%甲酸、2 mmol/L 乙酸铵以调节流动相pH,促进分析物在ESI 源下以正离子形式存在,响应强度增加,峰形良好。流动相中若甲醇比例过高时,最先被分离出峰的FLU 峰形较宽,而增加水相比例则导致出峰慢,分析时间较长,综合考虑选用梯度洗脱。
考虑到同位素内标作为LC-MS/MS 定量分析方法的首选,本方法选用了POS-D4、FLU-D4、VRC-D3 3 种同位素内标,与待测物POS、FLU、VRC 的化学性质极为相似。同位素内标与待测物在前处理过程中,色谱分离、离子化过程中变化完全相同,只有在质谱的质量分析器中才可将它们分离,可最大限度的消除基质效应等分析方法的误差。方法学验证结果显示可将内标与待测物色谱峰完全分离且峰形较好。
由于POS、FLU、VRC 均含三唑基团,具有一定的碱性,本实验选用适用于碱性化合物分析的ESI 正离子源,结合自动及手动调谐结果,分别选择3 种待测物及其相应内标化合物响应最强的离子对作为MRM扫描模式中的扫描离子对,分别手动优化各离子对的碰撞能量及锥孔能量使其灵敏度最高。
患者血浆样本中含有大量蛋白质,进样前需进行血浆样品前处理去除蛋白,以免污染堵塞色谱柱。目前常用的生物样本前处理方法有固相萃取法、液-液萃取法、蛋白沉淀法等。因固相萃取法成本较高、批次间重现性较差,液-液萃取法操作繁琐费时且需要消耗大量有机溶剂,本方法选择了操作简便的蛋白沉淀法,该法常用的沉淀剂有甲醇、乙腈、高氯酸等,因甲醇成本较低且方法学考察结果显示,患者血浆样本经甲醇沉淀蛋白处理后,待测物的液相图谱中无干扰峰存在,可达到生物样本分析要求。
笔者分别比较了加入600、800、1 000 μL 内标溶液后的色谱峰,最终选取响应强度最高的600 μL作为本实验中内标溶液的加入量,同时可达到较好的蛋白沉淀效果。因样品溶剂甲醇与流动相初始梯度中的高比例水相极性相差较大,导致最先出峰的FLU 出现前沿峰,故在进样前于样品中加入与初始流动相同比例的纯净水,混匀后进样,前沿峰消失。
本研究建立的液质方法可同时测定POS、FLU、VRC 3 种三唑类抗真菌药在人血浆中的药物浓度,既节约成本,又操作便捷,凡服用以上3 种药物的患者均可采用本方法进行血药浓度的测定,无需切换实验方法,节省了平衡色谱柱、配制新的流动相等时间;准确度高、重现性好、专属性强,可满足POS、FLU、VRC药动学研究的需求,为临床药学服务提供参考。

