miR-152 通过靶向FGF2 抑制肺癌A549 细胞系的增殖侵袭
何磊,杜佳辉,李娜
(1.郑州人民医院急诊科,郑州 450000;2.河南省胸科医院胸外科,郑州 450000)
肺癌是一种呼吸系统恶性肿瘤疾病,其病死率位居恶性肿瘤之首[1]。目前,关于诊断肺癌的方案主要检测肿瘤标志物、支气管镜检查、痰脱落细胞学检测、胸腔积液检测以及胸部计算机断层扫描等[2]。由于肺癌发病前期不明显,大部分患者确诊时候已处于中晚期,所以5 年生存率比较低[3]。因此,寻找用于肺癌的诊断和治疗的新靶点至关重要。近年来自噬作为抗肿瘤研究的热点,在肿瘤的发生发展中扮演重要的角色,一方面其通过降解聚集的蛋白质和功能性障碍的细胞器,减少细胞内氧化应激反应。另一方面,自噬调控肺癌细胞增殖、侵袭和凋亡等过程[4]。
微小RNA(miRNA)是长度在20~24 个碱基的单链非编码小RNA[5]。研究表明,miRNA 与信使RNA(mRNA)碱基互补配对,从而降解靶mRNA 或抑制其翻译,进而参与转录后的调控[6]。越来越多研究发现,miRNA 参与肿瘤发生和发展,主要调控肿瘤细胞的自噬、增殖、迁徙和侵袭等过程[7-8]。研究发现,miR-21 和miR-23a 可成为肺癌早期诊断的标志物[9]。并且miRNA-31 和let-7a 在肺癌患者中的异常表达,为肺癌早期诊断提供参考意义[10]。研究发现,miR-144 表达增加后,肺癌细胞中自噬激活后,从而抑制细胞的增殖和迁移[11]。因此,特异性表达的miRNA 可成为肺癌诊断和治疗的标志物。
miR-152 参与多种肿瘤的发生、发展过程,研究表明,在肺癌患者血清中检测miR-152 异常表达,并且显著性低于正常人群[12]。在早期非小细胞肺癌诊断中,血清外泌体中的miR-152 可以作为辅助诊断标志物[13]。但miR-152 影响肺癌A549 细胞的作用及机制仍不明确。成纤维细胞生长因子-2(FGF2)是一种广泛存在人体各组织中的肽类丝裂源[14]。由于FGF2 常参与细胞自噬过程[15],对肿瘤细胞增殖、迁移和侵袭具有重要作用[16]。本研究通过脂质体转染技术构建miR-152 过表达以及FGF2 过表达的肺癌A549 细胞,检测miR-152 与FGF2 互作关系,探究miR-152 和FGF2 对肺癌A549 细胞的自噬、增殖和侵袭能力的影响。
1 材料与方法
1.1 材料
1.1.1 细胞 正常上皮细胞BEAS-2B 和肺癌A549细胞系均购自中科院上海细胞库。
1.1.2 试剂及试剂盒 FBS 胎牛血清、MEM 培养基和0.25%的胰蛋白酶(Gibco,Waltham,MA);miRNA空转化合物、FGF2 过表达空转质粒、miR-152 mimic和miR-152 shRNA 以及FGF2 过表达质粒(广州市锐博生物科技有限公司);opti-medium 培养基、lip3 000、Trizol 试剂和BCA 试剂(Invitrogen;Thermo Fisher Scientific,lnc);Dual Luciferase Reporter Assay System 试剂盒(psiCHECK-2 vector; Promega,Madison,WI,USA);0.25%甲紫溶液(索莱宝科技有限公司);Transwell 小室(密理博科技有限公司);PrimeScript TM RT 试剂盒(Takara Biotechnology);SYBR Green Ⅰ[宝日医生物技术(北京)有限公司];RIPA 缓冲液、SDS-PAGE 和PVDF 膜(Sigma-Aldrich 中国);牛血清白蛋白(盐城赛宝生物科技有限公司);PMSF 抑制蛋白降解液(北京索莱宝科技有限公司);兔抗人FGF2、LC3B Ⅱ/Ⅰ、beclin1、p62 和GAPDH 单克隆抗体(Cell Signaling Technology,Inc.);羊抗兔二抗[艾博抗(上海)贸易有限公司];一抗稀释液和二抗稀释液(北京百奥莱博科技有限公司);超敏发光液ECL(上海翊圣生物科技有限公司)。
1.2 细胞培养 正常上皮细胞BEAS-2B 和A549细胞通过快速升温复苏后,10%FBS 的MEM 培养液分别制成细胞混悬液,放入培养皿后,于37℃恒温,5%CO2的培养箱中。隔天进行传代1 次,实验使用的细胞为对数生长期的细胞。
1.3 细胞转染及分组 将正常上皮细胞BEAS-2B(正常上皮细胞组)和A549 细胞(肺癌A549 细胞组)接种于6 孔板,待其长至密度80%~90%后,为下一步实验做准备。再将A549 细胞分为miR-NC 组、pcDNA3.1-NC 组、miR-152 mimics 组、miR-152 inhibitor 组、pcDNA3.1-FGF2 组 和miR-152+pcDNA3.1-FGF2 组。miR-NC 组是miRNA 空转物干扰A549 细胞,pcDNA3.1-NC 组是FGF2 过表达的乱序质粒干扰A549 细胞,miR-152 mimics 组是miR-152 过表达质粒干扰A549 细胞,miR-152 inhibitor组是miR-152 沉默质粒干扰A549 细胞,pcDNA3.1-FGF2 组是FGF2 过表达质粒干扰A549 细胞,miR-152+pcDNA3.1-FGF2 组是miR-152 过表达质粒和FGF 过表达质粒同时干扰A549 细胞。转染步骤:将对数生长的A549 细胞种于6 孔板内,待其长至密度40%~50%。用opti-medium 培养基稀释对应的质粒后,再与lip3000 混匀孵育15 min 后,加入孔内。待转染8 h 后,弃去转染液。添加正常培养基进行培养,当细胞长至80%~90%,放在荧光倒置显微镜观察转染效率。转染率超过80%,可进行下一步实验。
1.4 双荧光素酶报告实验 双重荧光素酶报告基因检测使用Dual Luciferase Reporter Assay System试剂盒。将FGF2 非翻译区(UTR),包含miR-152 预测结合位点的3′UTR,所有各自结合位点突变型(Mut)3′UTR 的片段插入psiCHECK-2 载体,再通过DNA 测序验证所有构建体。将含有野生型(Wt)或Mut 的psiCHECK-2 载体转染到有或没有合成miR-152 模拟物细胞中。转染36 h 后,使用双重荧光素酶报告基因检测系统检测荧光素酶活性,以海肾活性标准化。
1.5 细胞克隆检测细胞增殖能力 取miR-NC 组、pcDNA3.1-NC 组、miR-152 mimics 组、miR-152 inhibitor 组、pcDNA3.1-FGF2 组和miR-152+ pcDNA3.1-FGF2 组对数生长时的细胞,0.25%的胰蛋白酶消化后,1 000×g 离心10 min 收集细胞后,用10% FBS 的MEM 培养基混匀制成单细胞混悬液。每组将1 000 个细胞接种于6 孔板内,培养10~14 d,当观察孔内有肉眼可见的克隆,就终止培养。用PBS洗涤2~3 次后,甲醇固定15 min,加入适量的0.25%甲紫溶液染色。在倒置显微镜计算大于50 个细胞的克隆数,最后统计分析每个孔的克隆数,该实验每组需要设立3 个复孔,并且独立重复操作3 次。
1.6 Transwell 小室检测细胞侵袭能力 Transwell小室上层添加100 μL 的Matrigel 生物胶,在培养箱中培养40 min 后,再分别加入100 μL MEM 混合1×104个miR-NC 组、pcDNA3.1-NC 组、miR-152 mimics 组、miR-152 inhibitor 组、pcDNA3.1-FGF2 组和miR-152+ pcDNA3.1-FGF2 组的细胞。而Transwell小室下室加100 μL 10% FBS 的MEM 培养基,再置于培养箱培养12 h。弃去上清液,PBS 洗涤3 次,再用甲醇固定15 min 后,0.25%甲紫溶液染色1 h。将小室放在倒置显微镜下随机选取5 个视野(200×),拍照记录迁移下室的细胞总数。该实验每组需要设立3 个复孔,并且独立重复操作3 次。
1.7 蛋白质印迹法检测相关蛋白表达水平 将miR-NC 组、pcDNA3.1-NC 组、miR-152 mimics 组、miR-152 inhibitor 组、pcDNA3.1-FGF2 组和miR-152+ pcDNA3.1-FGF2 组细胞长至80%~90%通过胰酶消化,1 000×g 离心收起细胞后用蛋白裂解液(RIPA 缓冲液:PMSF 抑制蛋白降解液=100:1)裂解后提取总蛋白。BCA 试剂测得各组的总蛋白浓度后,都调成一致浓度,再100℃变性后保存于-20℃。总蛋白电泳分离后,将其转膜至PVDF膜。用3%牛血清白蛋白液封闭2 h 后,TBST 洗涤3 次,每次10 min。将其放入对应的一抗混合液(一抗1∶1 000)(FGF2、LC3B Ⅱ/Ⅰ、beclin1、p62 和GAPDH),在4℃孵育过夜。用TBST 洗涤3 次,每10 min 1 次,放入二抗和3%牛血清白蛋白液(1∶4 000)混悬液中,室温孵育2 h。TBST 洗涤3 次,每次10 min,将超敏发光液ECL 滴在膜上,放入化学发光成像仪(Invitorgen,USA)进行蛋白显影。通过Image J 软件进行分析结果,相对蛋白表达以GAPDH 标准化。
1.8 统计学处理 应用SPSS19.0 软件进行数据处理,所有实验数据为重复3 次实验结果。计量资料中符合正态分布资料以±s 表示,软件采用One way ANOVA 单因素分析,多组间的两两比较采用SNKQ 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-152 在正常上皮细胞BEAS-2B 和肺癌A549 细胞中的表达情况 qPCR 结果如图1A 和1B所示,与正常上皮细胞BEAS-2B 比较,肺癌A549 细胞中的miR-152 表达量显著降低(P<0.01),而FGF2的mRNA 表达量显著增加(P<0.01)。
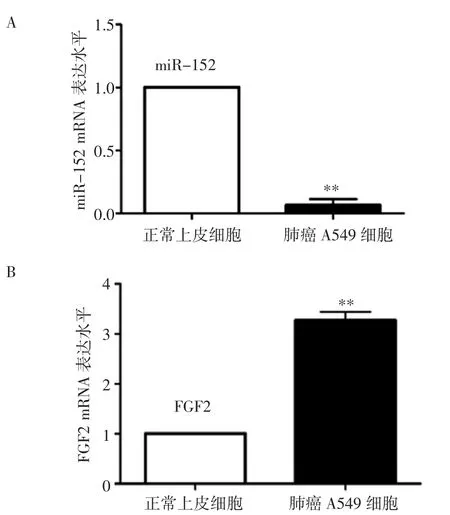
图1 qPCR 检测正常上皮细胞和A549 细胞中miR-152 和FGF2的表达情况Fig 1 The expression of miR-152 and FGF2 in normal epithelial cells and A549 cells detected by qPCR
2.2 FGF2 是miR-152 的靶点 根据TargetScan 的预测,miR-152 3′ -UTR 中的靶向位点与FGF2 部分互补(图2A)。假设FGF2 与miR-152 基因的3′-UTR 结合,从而抑制了miR-152 的基因表达。双重萤光素酶活性测定结果如图2B 所示,miR-152-Wt组的相对萤光素酶活性显著少于NC 组(P<0.05),但miR-152-Mut 组在萤光素酶活性方面与NC 组比较,无统计学差异。这表明miR-152 是FGF2 的直接靶标。
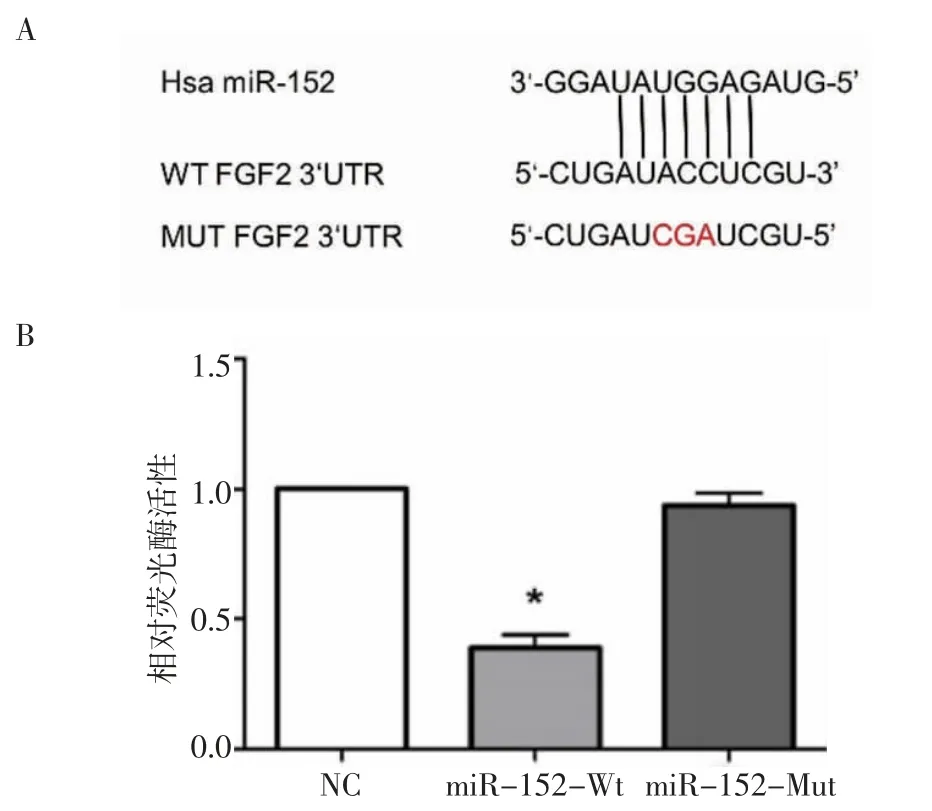
图2 双荧光素酶检测FGF 与miR-152 关系Fig 2 Relationship between FGF and miR-152 detected by dual luciferase
2.3 miR-152 靶向FGF2 对肺癌A549 细胞增殖的影响 二维克隆实验结果如图3A 和3B 所示,miR-152 mimics 组细胞形成的克隆数(42±3.21)显著低于miR-NC 组(214±10.23)(t=-48.88,P<0.05),而miR-152 inhibitor 组克隆数(352±4.23)显著高于miR-NC 组(t=-27.68,P<0.05)。pcDNA3.1-FGF2 组细胞形成的克隆数(501±6.12)显著高于pcDNA3.1-NC 组(124±11.43)(t=-42.18,P<0.05)。miR-152+pcDNA3.1-FGF2 组细胞形成的克隆数(187±6.21)显著高于miR-152 mimics 组(42±3.21)(t=-32.25,P<0.05)。
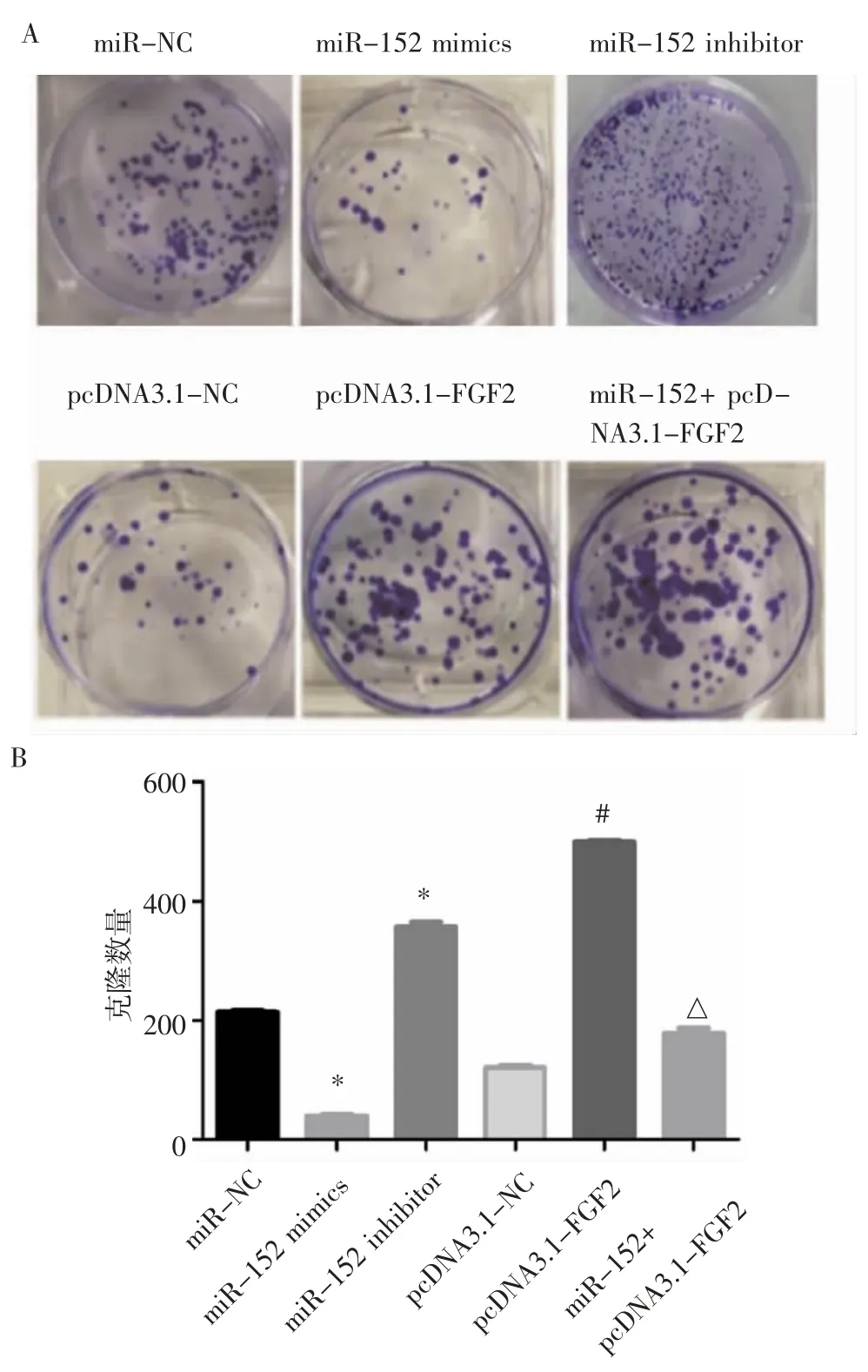
图3 二维克隆法检测肺癌A549 细胞克隆能力Fig 3 The clonal ability of lung cancer A549 cells detected by twodimensional cloning method
2.4 miR-152 靶向FGF2 对肺癌A549 细胞侵袭的影响 Transwell 实验结果如图4A 和4B 所示,miR-152 mimics 组穿过基质胶膜的细胞数为(35±4)个,显著低于miR-NC 组(101±5)个(t=-19.82,P<0.05),而miR-152 inhibitor 组(162±5.03)个,显著高于miR-NC 组(t=-22.33,P<0.05)。pcDNA3.1-FGF2 组穿过基质胶膜的细胞数为(199±6)个,显著高于pcDNA3.1-NC 组(98±4)个(t=-10.64,P<0.05)。miR-152+pcDNA3.1-FGF2 组穿过基质胶膜的细胞数为(78±3)个,显著高于miR-152 mimics 组(t=-8.19,P<0.05)。
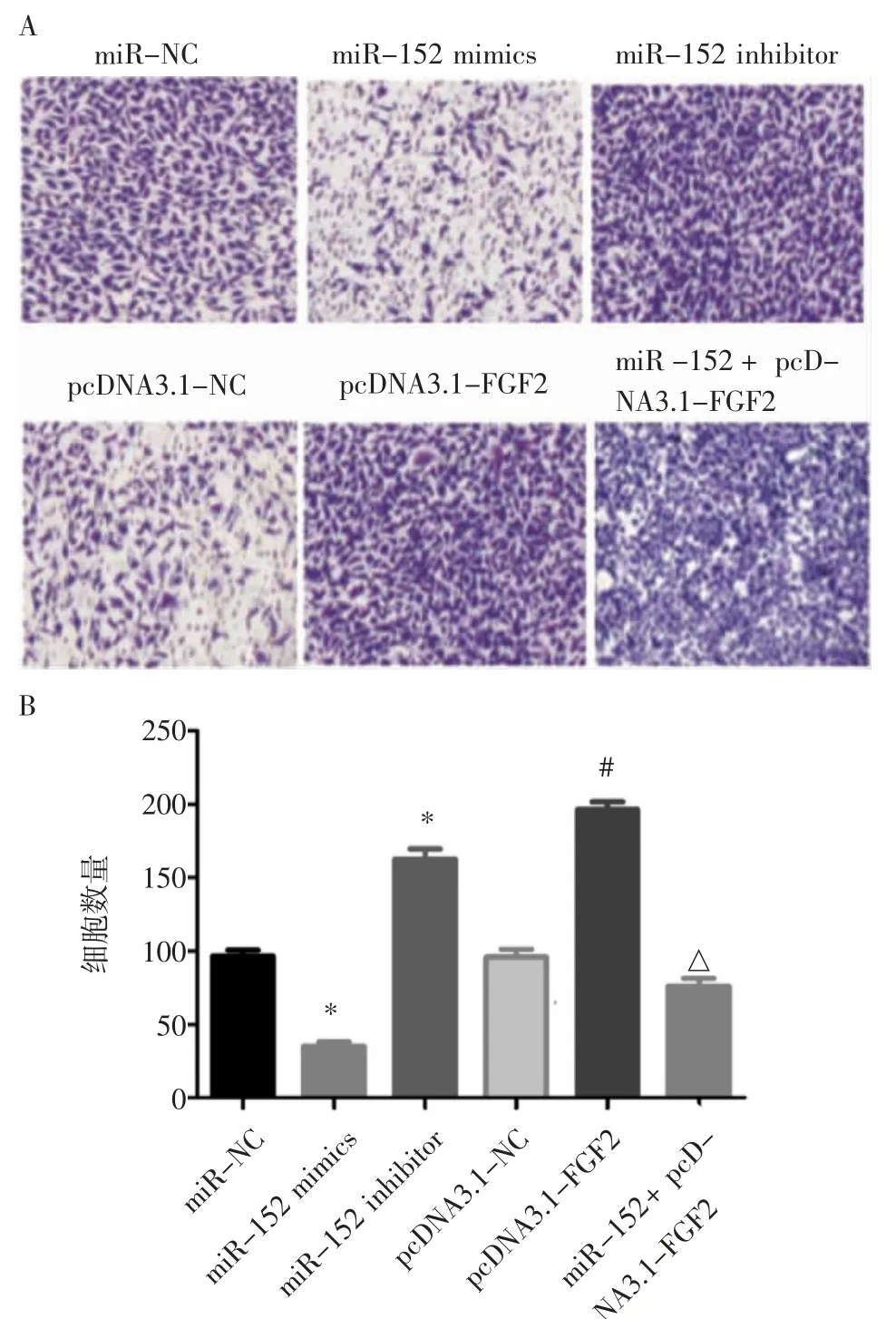
图4 Transwell 小室检测肺癌A549 细胞侵袭能力(200×)Fig 4 The invasiveness of lung cancer A549 cells detected by Transwell chamber(200×)
2.5 miR-152 靶向FGF2 对肺癌A549 细胞自噬相关蛋白的影响 Western 印迹实验结果如图5A 和5B 所示,与miR-NC 组比较,miR-152 mimics 组FGF2 和p62 蛋白表达量显著减少(P<0.05),LC3B Ⅱ/Ⅰ和beclin1 蛋白表达量显著增加(P<0.05),而miR-152 inhibitor 组FGF2 和p62 蛋白表达量显著增加(P<0.05),LC3B Ⅱ/Ⅰ和beclin1 蛋白表达量显著降低(P<0.05)。与pcDNA3.1-NC 组比较,pcDNA3.1-F GF2 组FGF2 和p62 显著增加(P<0.05),LC3B Ⅱ/Ⅰ和beclin1 蛋白表达量显著减低(P<0.05)。与miR-152 mimics 组比较,miR-152+ pcDNA3.1-FGF2 组FGF2 和p62 显著增加(P<0.05),LC3B Ⅱ/Ⅰ和beclin1 蛋白表达量显著增加(P<0.05)。
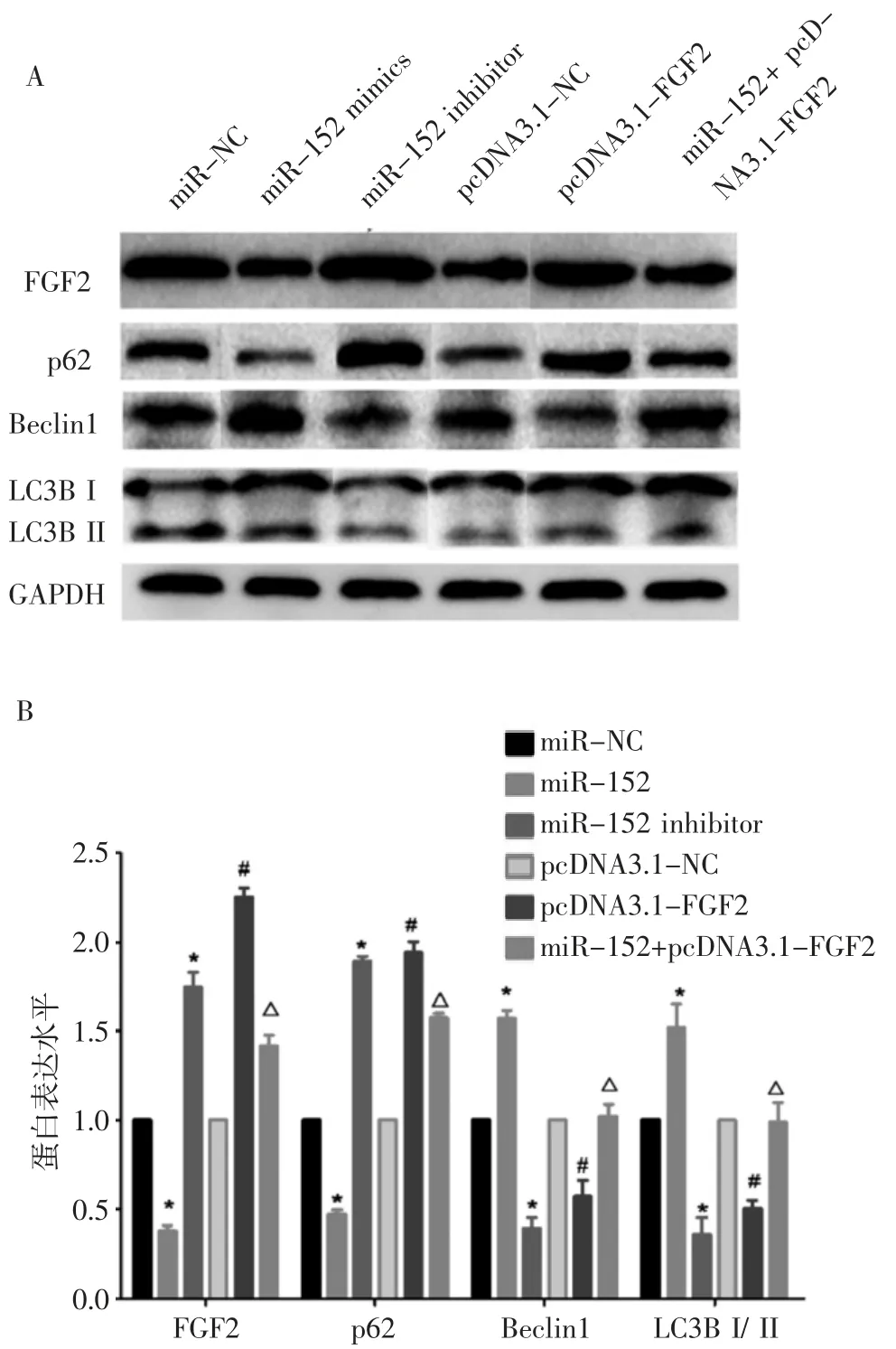
图5 Western 印迹检测A549 细胞内FGF2、LC3B Ⅱ/Ⅰ和beclin1和p62 蛋白表达情况Fig 5 The expression of FGF2,LC3BⅡ/Ⅰ,beclin1 and p62 proteins in A549 cells detected by Western blotting
3 讨论
肺癌是我国发病率最高的恶性肿瘤之一,恶性程度高且临床预后较差[17]。肺癌容易复发和转移,大部分患者确诊时已经处于中晚期[18]。目前,对于肺癌治疗的手段主要是手术和化疗等综合治疗方案,在一定程度能缓解病情,但是生存期仍不乐观[19]。研究表明,细胞自噬是机体的一种自我保护机制,其在应激条件下降解癌细胞产生的损伤细胞器和有害的蛋白质物质,可以阻止癌症的发生和发展[4]。LC3B Ⅱ/Ⅰ、beclin1 和p62 是主自噬标志物,LC3BⅡ/Ⅰ和beclin1 蛋白表达量随着自噬水平升高而升高。自噬降解受到抑制时,p62 的表达量增加[20]。越来越多研究表明,非编码RNA 通过参与自噬调控网络,介导自噬相关基因的表达,从而参与癌症细胞的增殖和侵袭过程[21]。因此,深入了解肺癌的发病机制,寻找与其自噬、增殖和侵袭相关的信号分子,可进一步提高肺癌的生存率,改善临床预后。
研究表明,miRNA 表达和功能异常常与肿瘤的发生、发展有密切关系[22]。研究表明,miR-152 抑制胃癌细胞、膀胱癌细胞和卵巢癌细胞的增殖、迁移和侵袭能力[23-25]。因此,miRNA 有可能参与肺癌A549 细胞的增殖和侵袭调控。本研究发现,与正常上皮细胞比较,miR-152 在肺癌A549 细胞中的表达显著降低。这说明miR-152 可能对肺癌A549 细胞有影响作用。笔者进一步构建miR-152过表达和沉默的肺癌A549 细胞。qPCR 结果显示,与miRNC 组比较,miR-152 mimics 组的miR-152 表达量显著增加,miR-152 inhibitor 组表达量明显减少。这说明miR-152 过表达和沉默的肺癌A549 细胞模型构建成功。细胞克隆和Transwell 小室实验结果显示,肺癌A549 细胞中miR-152 过表达后,其增殖和侵袭能力显著降低,而miR-152 沉默后,其增殖和侵袭能力明显增加。与miR-NC 组比较,miR-152 mimics 组的自噬标志蛋白LC3B Ⅱ/Ⅰ和beclin1 增加,而p62表达量受到抑制,但miR-152 inhibitor 组的结果与之相反。这说明miR-152 能激活肺癌A549 细胞的自噬,从而降低其增殖和侵袭能力。
FGF2 属于一种重要的神经营养因子和血管生成因子,能促进细胞的增殖和基因表达等[14]。FGF2通过调控肿瘤血管生成,从而参与肿瘤的生长、侵袭和转移过程[16]。本研究发现,与正常上皮细胞比较,肺癌A549 细胞中的FGF2 的表达显著增加。进一步通过过表达肺癌A549 细胞中的FGF2,观察FGF2 对肺癌A549 细胞的影响。qPCR 结果显示,与pcDNA3.1-NC 组 比 较,pcDNA3.1-FGF2 组 中 的FGF2 表达量增加,说明肺癌A549 细胞过表达FGF2模型构建成功。细胞克隆和Transwell 小室实验结果显示,肺癌A549 细胞中FGF2 过表达后,其增殖和侵袭能力显著增加。这说明FGF2 的过表达激活肺癌A549 细胞的增殖和侵袭能力。本研究进一步证实,过表达FGF2 后,肺癌A549 细胞中的FGF2 和p62明显增加,LC3B Ⅱ/Ⅰ和beclin1 表达受到抑制。这提示FGF2 抑制自噬,从而激活肺癌A549 细胞的增殖和侵袭。
越来越多研究发现,miRNA 与mRNA 相互竞争,从而影响靶基因的转录[6]。研究表明,miR-152通过与神经纤维网蛋白1 相互竞争,从而抑制非小细胞肺癌细胞的增殖和侵袭能力[12]。本研究通过TragetScan 预测miR-152 与FGF2 具有特异性结合,双荧光报告基因实验进一步验证miR-152 通过与FGF2 的3′UTR 区域直接结合从而负调控FGF2的表达。为了进一步验证miR-152 靶向FGF2 对肺癌A549 细胞的影响,本研究在过表达miR-152 的基础上过表达FGF2 基因,与miR-152 过表达组比较,其细胞自噬能力明显抑制,而增殖和侵袭能力显著增加。这也提示,过表达FGF2 基因可逆转过表达miR-152 对肺癌A549 细胞增殖和侵袭的抑制作用,进一步证实FGF2 是miR-152 的靶基因。
综上所述,miR-152 可靶向FGF2 调控肺癌A549 细胞自噬,从而影响A549 细胞增殖和侵袭能力,为肺癌的靶向治疗和诊断提供潜在靶点。
——一道江苏高考题的奥秘解读和拓展

