基于TCGA 数据库分析HPRT1 在口腔鳞状细胞癌中的表达及意义
张诗晗,张健
(天津医科大学口腔医院口腔颌面外科,天津 300070)
口腔鳞状细胞癌(OSCC)是口腔最常见的恶性肿瘤,约占口腔癌总数的90%,其发病率呈上升趋势[1-2]。OSCC 可发生在舌、颊、牙龈、硬腭、口底等黏膜部位。OSCC 的病因尚不清楚,多数研究表明吸烟、饮酒、咀嚼槟榔、人乳头瘤病毒(HPV,主要是16 型)、硬皮病、某些遗传病(如Zinsser- Engman -Cole 综合征等)可能是口腔癌发生的危险因素。OSCC 浸润性强,易出现淋巴结转移,通常在晚期后才被诊断出来,5年生存率不到50%[3]。目前已有一些研究探讨了影响OSCC 发展和预后的一些相关因子,以寻找新的治疗靶点,为OSCC 基因靶向治疗提供了新方向[4]。
次黄嘌呤磷酸核糖基转移酶1(hypoxanthine phosphoribosyltransferase 1,HPRT1)又称为HPRT、HGPRT。它是一种补救途径酶,负责将核糖单磷酸从磷酸核糖焦磷酸(phosphoribosyl pyrophosphate,PRPP)转移到次黄嘌呤和鸟嘌呤,分别形成肌苷单磷酸(inosine monophosphate,IMP)和鸟苷单磷酸(guanosine monophosphate,GMP)[5]。HPRT1含有217个氨基酸,在所有组织中均以低水平表达[6],唯一的例外是在中枢神经组织中表达水平异常升高[7]。最近一些研究发现,HPRT1 在恶性肿瘤组织中的表达普遍升高。有学者发现HPRT1 的mRNA 水平与受试小鼠的肿瘤负荷直接相关,说明小鼠体内HPRT1 的水平与肿瘤的大小有关[8]。研究表明,HPRT1 的表达在前列腺癌患者样本中增加,在乳腺癌患者的基础亚型中最高,并与乳腺癌的进展相关,可作为一个潜在的预后标志物[9]。对结肠、直肠癌的研究表明,与正常组织相比,肿瘤样本中HPRT1 的水平升高[10]。最新研究发现,HPRT 通过与信号转导与转录激活因子3(STAT3)的直接相互作用,促进头颈部鳞状细胞癌(HNSCC)的增殖和转移[11]。也有学者证实HPRT1在HNSCC 组织中的高表达与患者的不良预后有关[12]。目前国内对于HPRT1 在OSCC 中的作用鲜有报道,因此本研究拟利用TCGA 数据库网站分析HPRT1在OSCC 中的表达及意义。有文献报道嘌呤水平显著降低了癌症中的免疫细胞活化,恶性肿瘤组织中HPRT1的上调是免疫抑制微环境的一个促成因素[13]。因此本研究对HPRT1 在OSCC 免疫环境中的作用也做了相应研究。
1 资料与方法
1.1 TCGA 数据收集 从TCGA 数据库(https://can cergenome.nih.gov/)中下载OSCC 转录样本394 例(其中362 例癌症样本,32 例癌旁样本)和临床数据(381 例)。
1.2 研究方法
1.2.1 GESA 富集分析 GESA4.1.0 软件富集分析HPRT1 表达水平与京都基因和基因组百科全书(KEGG)通路基因集的相关性。从MsigDB 数据库中下载通路富集常用的c2.cp.kegg.v7.2.symbols 基因集作为参照基因集。软件参数设置为随机组合次数为1 000 次,计算富集系数和标准化后的富集系数。按照错误发现率(false discovery rates,FDR)进行排序,利用HPRT1 基因表达的中位数值将TCGA 数据集中的381 例OSCC 患者分为高表达组和低表达组,分别筛选出前十条通路。
1.2.2 免疫差异性与相关性分析 使用R4.1.1 软件的“limma”包和“vioplot”包对免疫细胞在HPRT1高低表达组中的差异性进行分析和绘图;使用“limma”包、“ggplot2”包、“ggpubr”包和“ggExtra”包对HPRT1 的表达量与免疫细胞的相关性进行分析和绘图。
1.3 统计学处理 利用R4.1.1 软件进行数据分析。利用Wilcoxon 法和Kruskal-Wallis 法进行临床相关性分析。利用Log-Rank 法进行生存评估分析。生存资料中不同变量的风险比采用Cox 回归分析。因TCGA 数据库中OSCC 患者临床数据中M 分期未知的数据过多,导致删除临床信息不完整的数据后样本量过小,因此在进行临床相关性分析和Cox 分析时未将M 分期纳入其中。P<0.05 表示差异有统计学意义。
2 结果
2.1 OSCC 和正常组织中HPRT1 的表达差异 TCGA数据库中OSCC 组织与正常组织样本相比,OSCC组织中HPRT1 表达水平明显高于正常组织(t=1.856,P<0.001,图1、2)。
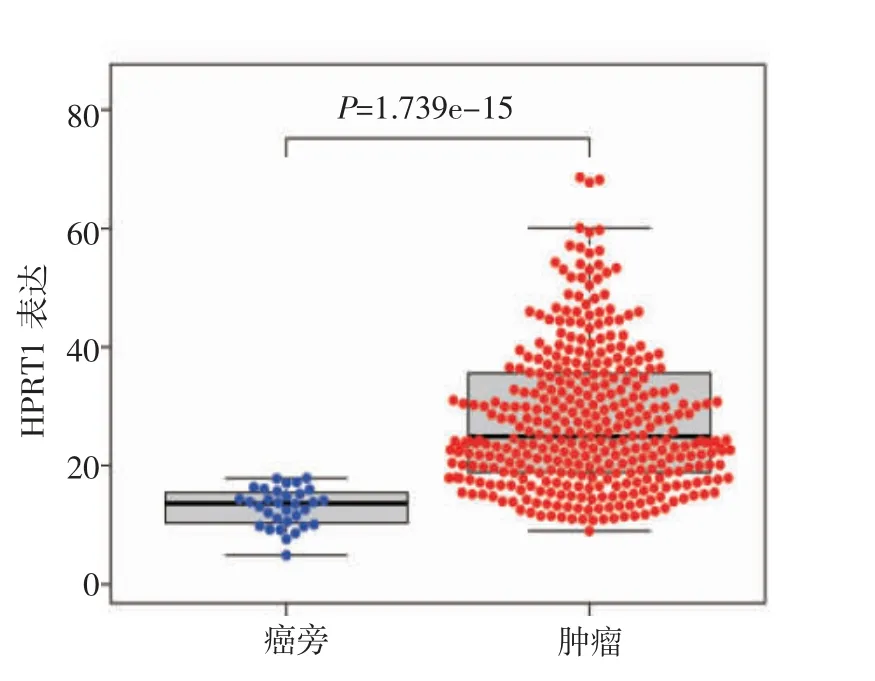
图1 总样本中HPRT1 的表达差异Fig 1 Expression difference of HPRT1 in total samples

图2 配对样本中HPRT1 的表达差异Fig 2 Expression difference of HPRT1 in paired samples
2.2 HPRT1 基因与OSCC 患者临床特征的相关性 HPRT1 表达水平在肿瘤分级中的G1 和G2 级(χ2=0.010,P=0.011)、G1 和G3 级(χ2=0.806,P< 0.001)以及G2 和G3 级(χ2=0.001,P=0.047)差异有统计学意义(图3);在肿瘤临床分期中的Ⅰ期和Ⅲ期(χ2=0.078,P=0.006)、Ⅲ期和Ⅳ期(χ2=0.091,P=0.038)差异有统计学意义(图4);在T 分期中的T1 期和T3期(χ2=0.342,P=0.037)差异有统计学意义(图5)。HPRT1 表达水平与年龄、性别、N 分期差异无统计学意义(图6~8)。

图3 HPRT1 与肿瘤分级的关系Fig 3 Relationship between HPRT1 and tumor grade

图4 HPRT1 与临床分期的关系Fig 4 Relationship between HPRT1 and clinical stage

图5 HPRT1 与肿瘤T 分期的关系Fig 5 Relationship between HPRT1 and tumor T stage

图6 HPRT1 与年龄的关系Fig 6 Relationship between HPRT1 and age

图7 HPRT1 与性别的关系Fig 7 Relationship between HPRT1 and gender

图8 HPRT1 与肿瘤N 分期的关系Fig 8 Relationship between HPRT1 and tumor N stage
2.3 HPRT1 基因表达与患者生存率的关系 TCGA 数据库中381 例患者的随访时间为0.07 个月至15 年,HPRT1 基因高表达组总生存率明显低于低表达组(图9,P<0.05)。高表达组5 年生存率为35.2%,低表达组5 年生存率为50.3%。

图9 HPRT1 与患者生存率的关系Fig 9 Relationship between HPRT1 and patients'survival rate
2.4 HPRT1 基因与OSCC 患者预后的关系 Cox 单因素分析显示OSCC 中年龄(HR=1.03,P= 0.001)、肿瘤分级(HR=1.38,P=0.031)、肿瘤分期(HR=1.74,P<0.001)、T 分期(HR=1.54,P<0.001)、N 分期(HR=1.50,P<0.001)、HPRT1 表达量(HR=1.03,P<0.001)与患者的生存预后相关(表1)。Cox 多因素分析显示OSCC 中年龄(HR=1.03,P<0.001)和HPRT1 表达量(HR=1.02,P=0.002)与患者生存预后相关。因此年龄和HPRT1 的高表达是影响OSCC 患者预后的独立因素(表1、图10)。
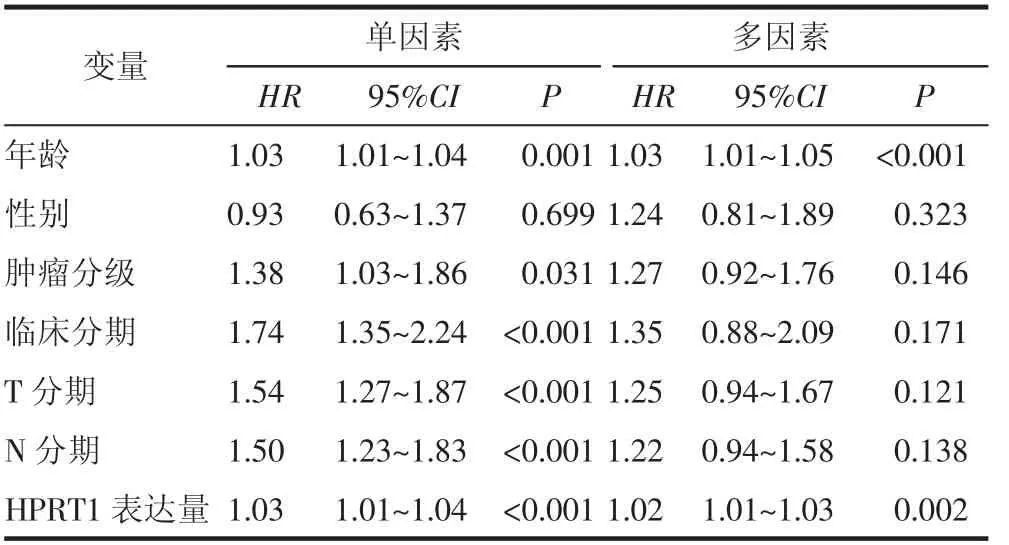
表1 Cox 单因素及多因素分析Tab 1 Cox single factor and multi factor analysis

图10 HPRT1 的Cox 多因素分析结果Fig 10 Cox multivariate analysis results of HPRT1
2.5 HPRT1 可能参与的信号通路 GSEA 结果显示,HPRT1 基因高表达样本主要富集在基础转录因子通路、细胞周期通路、DNA 复制等通路(FDR<0.05,P<0.05);HPRT1 基因低表达样本主要富集在氨酰-tRNA 生物合成通路、碱基切除修复通路(P<0.05)(图11、12)。

图11 HPRT1 基因高表达组的GSEA 富集结果Fig 11 GSEA enrichment results of HPRT1 gene high expression group
2.6 HPRT1 与免疫细胞的相关性
2.6.1 免疫细胞差异分析 幼稚B 细胞(P=0.048)、调节性T 细胞(P=0.001)、休眠NK 细胞(P=0.029)、休眠肥大细胞(P<0.001)、活跃肥大细胞(P=0.047)、嗜酸性粒细胞(P=0.035)、中性粒细胞(P=0.016)的表达在HPRT1 高表达组与低表达组中的差异有统计学意义(图13)。

图13 免疫细胞在两组患者中的表达Fig 13 Expression of immune cells in two groups of patients
2.6.2 免疫细胞相关性检验 调节性T 细胞(R<0,P<0.001)、休眠肥大细胞(R<0,P=0.003)和中性粒细胞含量(R<0,P=0.001)与HPRT1 表达量呈负相关;嗜酸性粒细胞含量(R>0,P=0.016)与HPRT1 表达量呈正相关(图14)。

图12 HPRT1 基因低表达组的GSEA 富集结果Fig 12 GSEA enrichment results of HPRT1 gene in low expression group

图14 HPRT1 与免疫细胞的相关性Fig 14 Correlation between HPRT1 and immune cells
3 讨论
OSCC 是严重威胁人类健康的一类恶性肿瘤,它的典型特征是高度的局部侵袭性和淋巴结转移,由于OSCC 易转移、易复发,因此OSCC 患者的总体5年生存率仍不到50%[14]。目前OSCC 的发病机制尚不清楚,可能是由多基因、多通路联合调控的复杂过程。寻找与OSCC 发展及预后的密切相关因子,对肿瘤的早期诊断与预后极其重要。本研究通过挖掘TCGA数据库公开发表的基因表达数据,发现HPRT1 在OSCC 组织中高度表达,对肿瘤内的免疫环境产生了影响,并且高表达患者的生存预后更差,提示HPRT1 可能是OSCC 的一个潜在的预后因子。
HPRT1 是一种蛋白质,已显示在多种肿瘤类型中显著升高[8-10],HPRT1 在神经发育和嘌呤合成中具有次要调节作用,嘌呤过剩分解与HPRT1 功能的丧失直接相关[15]。HPRT1 在肿瘤中的表达普遍升高,说明HPRT1 在肿瘤中的调节作用可能是独特的,HPRT1 的异常调节可能会增强细胞增殖并促进肿瘤发展。肿瘤微环境不仅由恶性细胞组成,实质细胞、成纤维细胞、间充质细胞、血管、淋巴管和免疫细胞之间存在复杂的相互作用,它们结合起来形成复杂的肿瘤微环境[16]。本研究显示HPRT1 升高会影响调节性T 细胞(Tregs)、休眠肥大细胞、中性粒细胞和嗜酸性粒细胞的含量,因此HPRT1 可能对肿瘤微环境中的细胞因子表达有影响。有学者研究HPRT1在几种肿瘤中的免疫浸润发现,HPRT1 表达与B 细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞和树突细胞的免疫浸润之间存在显著的负相关;在前列腺腺癌(PRAD)、肺鳞状细胞癌(LUSC)和甲状腺癌(THCA)中,HPRT1 升高后所有类型的免疫细胞的肿瘤浸润减少,但THCA 中的CD8+T 细胞除外;而HPRT1 升高后免疫浸润几乎没有变化的是食道癌(ESCA)、肾嫌色细胞癌(KICH)和子宫癌肉瘤(UCS)[13]。Tregs 在维持自身耐受和免疫稳态方面发挥重要作用,但它们参与促进了肿瘤周围的免疫抑制环境[17],而肿瘤微环境也促进了Tregs 的积累[18]。Tregs 可以高度浸润各种肿瘤类型(如皮肤癌、胰腺癌、乳腺癌等),在晚期肿瘤(Ⅲ期和Ⅳ期)经常表现出更高的积累[18]。有报道指出肿瘤内Tregs 的浸润与生存率呈负相关[19]。而本研究发现HPRT1 的高表达与Tregs 的含量呈负相关,并且在3 种与HPRT1 表达呈负相关的免疫细胞中差异最大,推测HPRT1 的表达对Tregs 在肿瘤微环境中的产生与积累密切相关,关于HPRT1 与Tregs 在肿瘤微环境中表达的机制还有待进一步探究。休眠肥大细胞是与软组织肉瘤的复发和生存率相关的免疫细胞[20],并与透明细胞肾细胞癌(ccRCC)的良好预后有关,尽管其在ccRCC 中的含量较低[21]。本研究发现休眠肥大细胞在HPRT1 高低表达组中含量差异最大,表明HPRT1高表达可能抑制休眠肥大细胞产生。肿瘤相关的中性粒细胞增多是黑色素瘤、胃癌、肺癌、头颈癌等的不良预后特征[22]。有学者发现CD16(high)CD62L(dim)中性粒细胞的增加与头颈癌的良好预后相关[23]。本研究发现中性粒细胞随HPRT1表达增高而减少,关于中性粒细胞在OSCC 中的作用还有待证实。嗜酸性粒细胞可分泌多种可溶性介质和效应分子,它们对肿瘤微环境中其他免疫细胞亚群具有调节功能,或对肿瘤细胞具有直接的细胞毒性功能,而产生抗肿瘤或促肿瘤作用[24]。在以肿瘤相关组织嗜酸性粒细胞增多(TATE)为特征的致癌物诱导的仓鼠OSCC模型,用抗白细胞介素-5 单克隆抗体治疗,可抑制肿瘤生长,嗜酸性粒细胞可能具有促肿瘤作用[25]。而本研究发现HPRT1 的高表达与嗜酸性粒细胞含量正相关,嗜酸性粒细胞在OSCC 中可能具有促肿瘤作用。HPRT1 参与嘌呤调节和产生,HPRT1 升高会产生更多的嘌呤。实质性肿瘤微环境可表现为缺氧,而嘌呤对缺氧条件下免疫细胞活化有显著影响,因此这也可能是HPRT1 对肿瘤微环境的作用之一。HPRT1 在调节细胞周期中起重要作用,其参与的基础转录因子通路、细胞周期通路、DNA 复制等通路可能对OSCC 预后也有影响。尽管本研究确定了OSCC 中HPRT1 基因的表达水平增加,但这种现象的潜在机制仍不清楚,还需更深入的探讨。
综上所述,本研究结果表明HPRT1 过表达与OSCC 的进展显著相关。肿瘤组织中HPRT1 表达的上调可能是OSCC 诊断、预后和靶向治疗的生物标志物。然而,必须进行进一步的调查和临床试验来阐明HPRT1 在OSCC 中的作用机制。

