高IgM综合征1例并文献复习
刘江华 刘炜 李彦格 毛彦娜
作者单位:郑州大学附属儿童医院 河南省儿童医院 郑州儿童医院血液肿瘤科,河南 郑州 450000
高IgM 综合征(Hyper-IgM syndrome,HIGM)是一种抗体类别转换障碍导致的原发性免疫缺陷病,以反复感染、中性粒细胞减少、自身免疫性疾病、恶性肿瘤为主要临床表现,免疫学特征为IgM 水平升高或正常,IgA、IgE、IgG 降低。临床发病率低,反复呼吸道感染可使患儿发生不可逆肺损伤,重者危及生命。现分析我院收治的1 例HIGM 患儿的临床资料及基因变异数据,并进行文献复习,以期提高对该病的认识,早期诊断及治疗。
1 临床资料
1.1 一般资料患儿,男,8 岁,因“咳嗽1月,呼吸费力20 余天,加重1 天”于2021年5月21日入我院。入院前1月患儿无明显诱因出现咳嗽,呈阵发性,夜间为主,无发热、吐泻等,至诊所口服药物治疗6天,疗效差;20 余天前咳嗽加重,伴胸痛、呼吸费力、口唇发绀,遂至当地医院住院治疗,胸部CT 示肺间质性改变,予CPAP 辅助通气、支气管镜灌洗,先后予头孢西丁、阿奇霉素及头孢哌酮舒巴坦抗感染及雾化治疗,仍呼吸费力,遂至我院。既往体质差,易患呼吸道感染,3~5 次/年,其中2 次外院住院诊断为间质性肺炎。家族中无类似病史。入院查体:SpO292%,鼻导管吸氧下口唇发绀,鼻翼扇动,三凹征阳性,双肺呼吸音粗,可闻及中粗湿啰音,心率120 次/min,未闻及杂音。腹部查体未见异常。入院后主要检查结果:血常规:白细胞8.46×109/L,血红蛋白139g/L,血小板431×109/L,中性粒细胞比值60.9%,淋巴细胞比值27.4%,C-反应蛋白2.76mg/L;体液免疫:IgG 0.24g/L(减低),IgM 3.69g/L(增高),IgA 0.02g/L(减低),补体系列正常;细胞免疫:T 淋巴细胞63.27%,T8 淋巴细胞29.54%,T4 淋巴细胞29.54%(减低),CD4/CD8 1.00,NK 淋巴细胞8.40%,B 淋巴细胞28.04%(增高),总淋巴细胞绝对计数2177.72/μl,T 淋巴细胞绝对计数1377.91/μl,T8 淋巴细胞绝对计数643.20/μl,T4 淋巴细胞绝对计数643.20/μl,NK 淋巴细胞绝对计数183.02/μl,B 淋巴细胞绝对计数610.64/μl(增高),双阴性T 淋巴细胞百分数4.15%,双阳性T 淋巴细胞百分数0.04%,双阴性T 淋巴细胞数90.63U/L,双阳性T 淋巴细胞数0.88U/L;粒细胞呼吸爆发检测正常;肝肾功能未见异常;降钙素原、白介素-6、细菌毒素动态定量检测均正常;结核筛查阴性;EB 病毒、巨细胞病毒及常见呼吸道13 项病毒检测均阴性;1,3-β-D 葡聚糖(1,3-β-D glucan,G)试验199.51pg/ml(升高),半乳甘露聚糖(Galactomannan,GM)试验0.27μg/L(正常);肺泡灌洗液:曲霉菌半乳甘露聚糖1.77μg/L(偏高);肺泡灌洗液培养:白色念珠菌、肺炎克雷伯菌;肺泡灌洗液宏基因测序:卡氏肺孢子菌;入院时胸部CT(2021年5月21日):双肺纹理粗多、紊乱,部分呈细网格状改变,肺野透光度不均匀减低,局部呈磨玻璃样改变(见图1A)。出院前胸部CT(2021年6月13日):两肺片影较前吸收,肺野透光度较前明显好转(见图1B)。
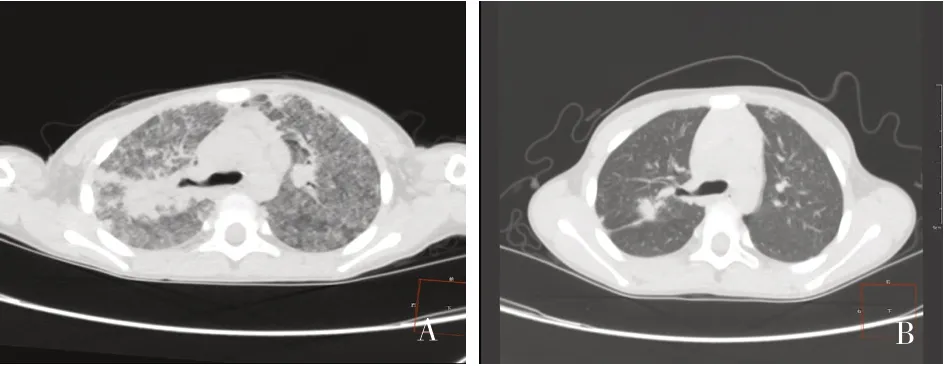
图1 患儿胸部CT 结果
1.2 方法
1.2.1 基因检测 根据患儿反复呼吸道感染、机会性感染,高度怀疑免疫缺陷病,为进一步明确病因,征得家属知情同意后,对患儿及其家庭成员行基因检测。采集先证者及其父母共3 人静脉血各2ml,EDTA-K2 抗凝。采用德国Qiagen 公司生产的试剂盒提取基因组DNA,用分光光度计检测DNA 纯度和浓度,质量达标后冻存于-20°冰箱。将待测DNA 送至康圣环球生物检测公司行基因组外显子DNA 检测,采用Sanger 测序方法验证患儿及其家庭成员相关的基因突变位点。测序所得数据进行过滤、拆分、与参考序列比对、注释等得到基因突变信息和其生物学意义。
1.2.2 文献检索策略 以“Hyper-IgM syndrome”为检索式在PubMed 数据库检索,以“高IgM 综合征”为主题词在中国知网、万方数据知识服务平台检索相关文献,检索时间设定为各数据库建库至2021年10月31日。
2 结果
2.1 基因检测结果患儿CD40L 基因编码区第515位核苷酸由腺嘌呤(A)变异为鸟嘌呤(G),为错义突变,导致第172 位氨基酸由酪氨酸(Tyr)变异为半胱氨酸(Cys),其母亲该位点为A/G 杂合,变异来源于其母亲,患儿父亲该位点无变异(见图2)。该变异在正常人群数据库中未收录,根据2015年美国医学遗传学与基因组学学会(ACMG)《ACMG 遗传变异分类标准与指南》,该变异初步判定为疑似致病性变异,可能导致基因功能丧失。结合患儿临床表现及免疫功能结果,诊断为:高IgM 综合征、卡氏肺孢子菌肺炎、呼吸衰竭。入院给予无创呼吸机辅助呼吸及有创机械通气、静注人免疫球蛋白2g/kg 支持治疗,复方磺胺甲基异噁唑、卡泊芬净抗感染治疗,支气管肺泡灌洗、小剂量短疗程糖皮质激素抗炎,患儿肺部情况好转后于2021年6月14日出院。
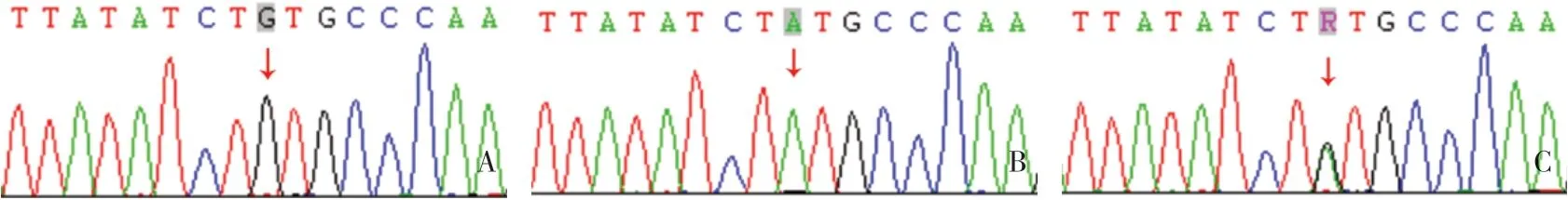
图2 CD40L 基因检测结果
2.2 文献检索结果共检索出Hyper IgM syndrome相关英文文献700 篇,中文文献75 篇。常见的致病基因有CD40L、CD40、活化诱导胞嘧啶核苷脱氨酶(AID)、尿嘧啶DNA 糖基化酶(UNG)、核转录因子κB 抑制蛋白α(IκBα)、核转录因子κB 必需调节蛋白(NEMO)的基因,突变类型有错义突变、无义突变、缺失突变、剪切位点突变、拷贝数变异等,其中以CD40L 基因突变最常见,大多为错义突变。
3 讨论
HIGM 综合征由Rosen 等于1961年首次报道[1],由B 淋巴细胞晚期发育阶段受阻所致,占原发性免疫缺陷病的0.3%~2.9%,以X-连锁遗传方式为主,占70%[2]。B 淋巴细胞在早期发育过程中一般均表达IgM 抗体,随后在体细胞高频突变(Somatic hyper mutation,SHM)及抗体类别转换(Class switch recombination,CSR)作用下产生IgA、IgE 或IgG。该过程受多种因素调控,如T、B 细胞相互作用,NF-κB 通路,调节双链DNA 剪切、修复、连接过程的酶和分子等[3]。其中CD40L/CD40 是一对重要的共刺激分子,二者结合后激活NF-κB,使其进入细胞核激活靶基因转录,使靶细胞发生CSR 及SHM。CD40L 主要表达于活化的CD4+T 淋巴细胞,CD40主要表达于B 淋巴细胞、单核巨噬细胞及树突状细胞,其相互作用产生的第二信号是B 淋巴细胞产生免疫应答及T 淋巴细胞活化的重要条件,故CD40L/CD40 基因突变不仅影响体液免疫,也会引起细胞免疫缺陷[4]。HIGM 以CD40L 基因突变最常见,该基因位于Xq26.3-27.1,有5 个外显子,HGMD 数据库中收录CD40L 基因突变234 个,大多为错义突变,其中位于5 号外显子者最常见。本病例为CD40L 基因c.515A>G,突变部位在第5 外显子,位于热点突变区,导致氨基酸改变p.Y172C,引起联合免疫缺陷,与文献报道一致[5]。
反复呼吸道感染是HIGM 最常见的临床表现,易感染细菌、真菌及原虫等,90%患儿于4 岁前出现症状,40%的HIGM 以卡氏肺孢子菌肺炎为首发表现[6]。卡氏肺孢子菌是常见的机会性感染病原菌,常发生于先天性免疫缺陷、血液系统恶性疾病、营养不良等患者中,早期应用复方磺胺甲基异噁唑治疗可控制感染进展。本病例以进展性呼吸困难为主要表现,既往存在反复间质性肺炎,查体呼吸、心率增快,胸部影像学示间质性磨玻璃样改变,支持卡氏肺孢子菌感染诊断。但入院后多次痰液及血培养检测均未发现阳性菌,肺泡灌洗液病原学宏基因测序检测出卡氏肺孢子菌,提示宏基因测序对机会性感染病原菌检出具有一定优势。本病例应用复方磺胺甲基异噁唑治疗3 周后仍有呼吸急促、离氧不耐受症状,加用小剂量糖皮质激素后病情较前改善,提示小剂量激素可能改善病情。除感染外,HIGM 还可表现为弥漫性肝内胆管扩张、嗜酸性粒细胞增高、自身免疫性疾病、恶性肿瘤等[7~9],本病例监测肝功能、肝脏彩超未见异常,但不排除随疾病进展,出现上述情况,需密切监测。
HIGM 的治疗以预防及支持治疗为主,根治需行造血干细胞移植(HSCT)。免疫球蛋白替代治疗是支持治疗的重要部分,常规剂量为400~600mg/kg,每3~4 周1 次,可显著降低患儿的感染频率和严重程度[10];预防性应用复方磺胺甲基异噁唑防治卡氏肺孢子菌感染,对中性粒细胞减少者应用粒细胞集落刺激因子,是预防感染的重要手段。异基因HSCT 是HIGM 的唯一治愈方法,早期治疗可提高生存率,国外报道造血干细胞移植治疗HIGM 的成功率为72%[11],2006年我国首例HIGM 患者造血干细胞移植成功[12]。近年来,越来越多的HIGM 患儿接受了HSCT 并从中获益[13,14]。Mitsui-Sekinaka 等[15]比较了29 例接受HSCT 治疗(试验组)和27 例未接受HSCT 治疗(对照组)的HIGM 患者生存率,发现试验组的总体生存率显著高于对照组,且与年龄相关,≤5 岁接受HSCT 者的无病生存率显著高于>5岁者,认为≤5 岁是HSCT 的理想年龄,可能与年龄越大脏器功能损害越严重有关。本例患儿感染控制后拟行HSCT,有望改善预后,因既往存在反复间质性肺部感染,需监测肺功能,积极控制并发症。
综上所述,本例HIGM 患儿的临床资料及基因突变数据分析,提示对反复呼吸道感染,特别是机会性感染的患儿需警惕HIGM 的可能,减少漏诊误诊。

