微创环切术联合浓缩生长因子应用于口腔种植中的效果
李明亮 韩永杰 钟奇帜
临床一般对骨损失较严重的患者进行种植手术,恢复牙齿咀嚼功能,其中微创环切术广泛应用于口腔种植技术中,该技术可保留口腔种植患者软硬组织,不需要进行拆线,创口愈合速度较快[1-3]。但术后种植体附近边缘骨会慢慢出现骨吸收、侧骨厚度降低的情况,种植体周围软组织逐渐退缩,影响美学效果[4-5]。浓缩生长因子(concentrated growth factor,CGF)通过增加口腔种植患者植体周围纤维连接蛋白及胶原的含量,降低破骨细胞水平和活性,促进成骨细胞分化,或许能减少骨吸收情况发生,提高美学效果。因此本文观察微创环切术联合CGF应用于口腔种植中的效果,结果如下。
1 资料与方法
1.1 一般资料
选取深圳市宝安区中心医院2018年7月-2020年8月87例口腔种植患者。纳入标准:(1)行口腔种植;(2)无全身系统性疾病;(3)良好骨质;(4)单牙种植。排除标准:(1)口腔感染;(2)牙周炎;(3)近期内出现口腔颌面部神经性疼痛;(4)软硬组织不足。根据计算机分组法将其分为对照组(n=43)和观察组(n=44)。对照组男22例,女21例;年龄24~60岁,平均(46.51±10.28)岁;失牙时间1~4个月,平均(1.96±0.52)个月。观察组男24例,女20例;年龄23~61岁,平均(47.26±11.35)岁;失牙时间1~4个月,平均(2.03±0.37)个月。两组患者上述资料对比差异无统计学意义(P>0.05),有可比性。患者与家属签署知情同意书,本研究经医院伦理委员会批准。
1.2 方法
两组均在术前进行CT拍摄,评估失牙区情况。
对照组给予微创环切术治疗,对面部及口腔进行常规消毒,铺巾,麻醉。用探针确定植入点,选择切龈刀对植入点的牙龈做一环状切口,切除环形牙龈,将牙槽嵴顶充分暴露,再按照术前设计的植入方向、种植长度,在钻及钻孔的协助下定向,制备种植窝,手术过程中反复使用等渗生理盐水冲洗种植窝及局部降温,选择探针观察骨壁是否穿孔,植入种植体,放入愈合帽,缝合创口。
观察组在对照组基础上给予CGF治疗,制备CGF:采集患者静脉血,放入离心机(DD-6R),根据CGF程序进行离心,离心后血液被分为3层,除去最下面一层,剩余的则为CGF。进行在植入种植体时同时植入含有CGF的骨粉,剪裁和患者骨缺损区形状一致的生物屏膜,保证生物屏膜对骨缺损区覆盖完全,缝合黏膜切口。
术后3~7 d均给予抗生素预防感染,术后随访3个月。
1.3 观察指标及评价标准
观察两组疼痛情况、种植体附近软组织美观效果、种植体附近边缘骨吸收量和种植体唇侧骨壁厚度及口腔功能。(1)疼痛情况:术后1 d选择视觉模拟评分表(VAS)对疼痛进行评估,0分代表无痛,1~5分为Ⅰ度疼痛,6~8分为Ⅱ度疼痛,9~10分为Ⅲ度疼痛[6]。(2)种植体附近软组织美观效果:术后3个月评估种植体附近软组织轮廓、颜色、质地、牙槽骨突度、边缘龈水平,每项总分为2分,分值越高表示美观效果越好[7]。(3)种植体附近边缘骨吸收量和唇侧骨壁厚度:于术后3个月选择X线检测近、中、远的种植体附近边缘骨吸收状况,检测3次取平均值,术后3个月拍摄锥形束CT,测定种植体唇侧骨壁厚度。(4)口腔功能:于术前及术后3个月对口腔舒适度、语言功能、咀嚼功能评分进行评估,各项总分为10分,分值越高表示其功能越好[8]。
1.4 统计学处理
数据录入SPSS 22.0软件中分析,计数资料以率(%)表示,采用χ2检验,等级资料采用秩和检验,计量资料以(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组疼痛情况比较
术后1 d,观察组疼痛情况优于对照组(P<0.05),见表1。
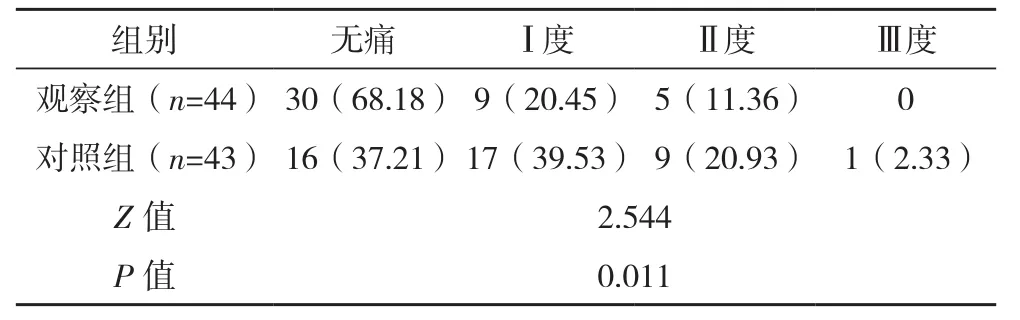
表1 两组疼痛情况比较[例(%)]
2.2 两组种植体附近软组织美观效果比较
术后3个月,观察组种植体附近软组织轮廓、颜色、质地、牙槽骨突度、边缘龈水平评分均高于对照组(P<0.05),见表2。
表2 两组种植体附近软组织美观效果比较[分,(±s)]
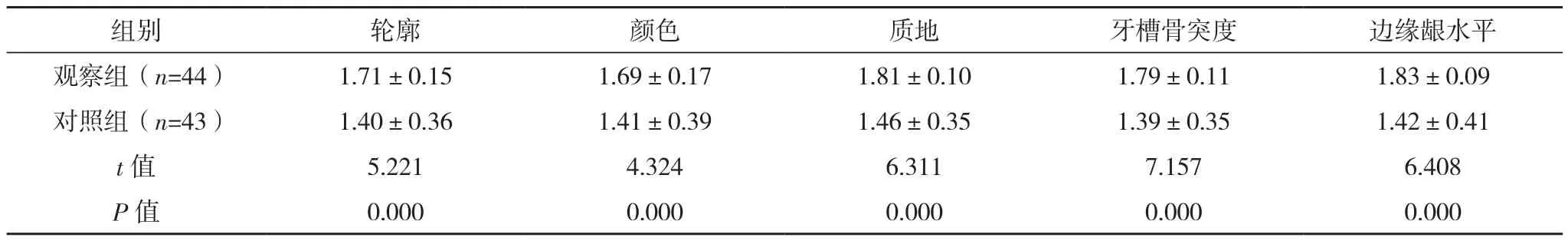
表2 两组种植体附近软组织美观效果比较[分,(±s)]
组别 轮廓 颜色 质地 牙槽骨突度 边缘龈水平观察组(n=44) 1.71±0.15 1.69±0.17 1.81±0.10 1.79±0.11 1.83±0.09对照组(n=43) 1.40±0.36 1.41±0.39 1.46±0.35 1.39±0.35 1.42±0.41 t值 5.221 4.324 6.311 7.157 6.408 P值 0.000 0.000 0.000 0.000 0.000
2.3 两组种植体附近边缘骨吸收量和唇侧骨壁厚度比较
术后3个月,观察组种植体附近边缘骨吸收量低于对照组,种植体唇侧骨壁厚度高于对照组(P<0.05),见表 3。
表3 两组种植体附近边缘骨吸收量和唇侧骨壁厚度比较[mm,(±s)]
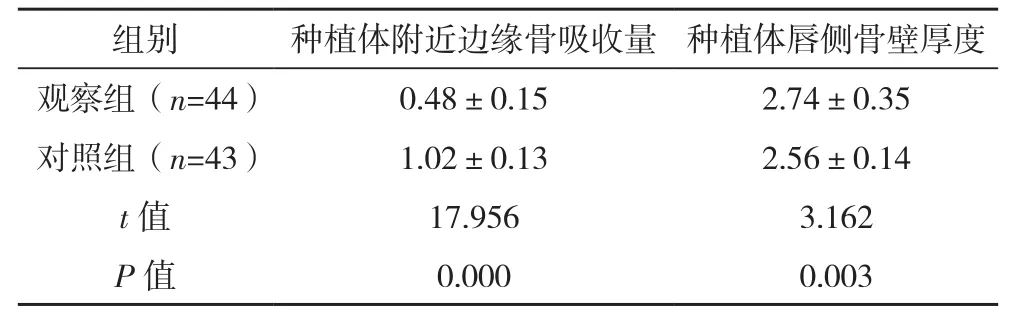
表3 两组种植体附近边缘骨吸收量和唇侧骨壁厚度比较[mm,(±s)]
组别 种植体附近边缘骨吸收量 种植体唇侧骨壁厚度观察组(n=44) 0.48±0.15 2.74±0.35对照组(n=43) 1.02±0.13 2.56±0.14 t值 17.956 3.162 P值 0.000 0.003
2.4 两组口腔功能比较
术后3个月,观察组口腔舒适度、语言功能、咀嚼功能评分均高于对照组(P<0.05),见表4。
表4 两组口腔功能比较[分,(±s)]
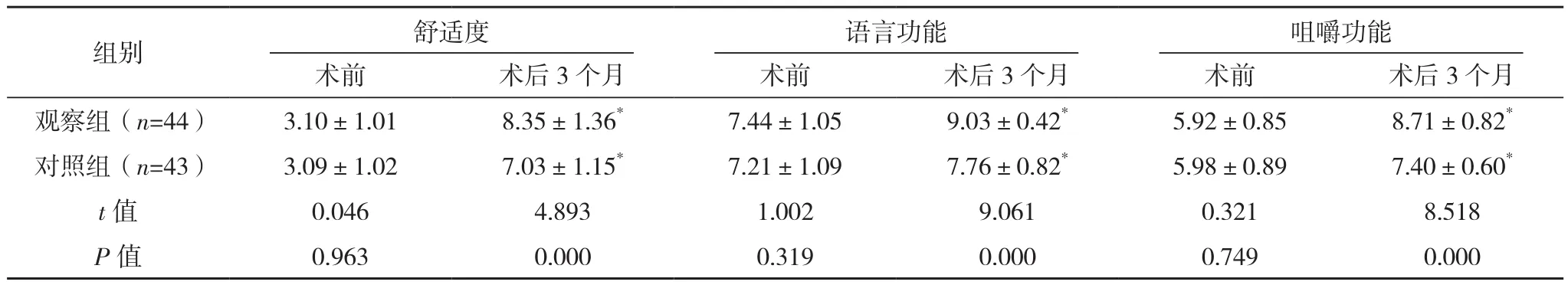
表4 两组口腔功能比较[分,(±s)]
*与本组术前比较,P<0.05。
术前 术后3个月 术前 术后3个月 术前 术后3个月观察组(n=44) 3.10±1.01 8.35±1.36* 7.44±1.05 9.03±0.42* 5.92±0.85 8.71±0.82*对照组(n=43) 3.09±1.02 7.03±1.15* 7.21±1.09 7.76±0.82* 5.98±0.89 7.40±0.60*t值 0.046 4.893 1.002 9.061 0.321 8.518 P值 0.963 0.000 0.319 0.000 0.749 0.000组别 舒适度 语言功能 咀嚼功能
3 讨论
口腔种植能为患者提供和天然牙固位、形态相似的修复效果,逐渐成为修复牙缺失的首选方案[9]。当前微创环切术是常用的种植技术,对口腔种植患者造成的创口较小,可使种植体附近组织完整,但进行口腔种植后种植体附近容易出现骨缺损的情况,影响口腔功能[10-12]。CGF可促进口腔种植患者局部细胞增殖、分化及脂质合成,修复其缺损区,以期能帮助患者骨组织再生,提高患者的口腔功能。
CGF由自体静脉血分离而得,是一种种植牙修复生物材料,含有血小板和多种高浓度生长因子的纤维蛋白网状支架,可刺激磷脂酰肌醇3-羟基激酶和蛋白激酶B通路,促进一氧化氮和血管生成素的表达,提高血管内皮细胞含量,促进软组织修复,加速伤口愈合[13-15]。通过在局部分泌生长因子,吸收未分化的内皮细胞促进受损部位恢复,提高种植体稳定系数及口腔功能[16-17]。CGF还能刺激成骨细胞增殖及种植体附近骨组织重建,帮助形成新骨,增加种植体周围骨容量,提高美学效果。
微创环切术是一种微创手术,但也会导致出血疼痛[18]。术后1 d,观察组疼痛情况优于对照组(P<0.05),说明微创环切术联合CGF应用于口腔种植中可减轻疼痛。因为CGF可分泌白细胞及免疫细胞,参与炎症调节,缓解疼痛,同时可以提高牙龈成纤维细胞生长及黏附分子表达,诱导干细胞增殖及血管再生,控制细胞有丝分裂、趋化及新陈代谢,促进组织修复及伤口愈合,缓解疼痛。
术后3个月,观察组种植体附近软组织轮廓、颜色、质地、牙槽骨突度、边缘龈水平评分均高于对照组(P<0.05),说明微创环切术联合CGF应用于口腔种植中可提高种植体附近软组织美观效果。因为CGF抗张强度大,黏性好,给予合适压力能形成理想的生物屏障,分隔不同的牙周组织,保护黏骨膜完整性,提高美观效果,这与来卫东等[19]研究结果类似。还能够提高成骨细胞和成纤维细胞的活性,促进血管生成,维持种植体周围良好血液循环,促进种植体附近软组织及硬组织再生,提高种植体附近软组织美观效果。
术后3个月,观察组种植体附近边缘骨吸收量低于对照组,种植体唇侧骨壁厚度高于对照组(P<0.05),说明微创环切术联合CGF应用于口腔种植中可减少种植体附近边缘骨吸收量,增加种植体唇侧骨壁厚度。因为CGF有利于骨髓基质干细胞有丝分裂,提高成骨细胞水平,稳定颈部边缘骨厚度及高度,还能促进内皮细胞有丝分裂及移植区域毛细血管生长,提高角化龈宽度和牙龈厚度,防止牙槽嵴骨吸收。
术后3个月,观察组口腔舒适度、语言功能、咀嚼功能评分均高于对照组(P<0.05),说明微创环切术联合CGF应用于口腔种植中可改善口腔功能。因为微创环切术使种植体附近组织维持较好的血液循环,减少边缘骨吸收,提高种植体稳定性,还可以使牙龈组织和骨组织保留原有结构,保护种植体颈部牙龈形态,提高口腔功能。CGF利用细胞膜上特定的两种受体的跨膜异二聚体复合物进行信号传导,促使间充质干细胞增殖和分化,同时增加胶原蛋白含量,进行骨修复,调节种植体周围骨的生长并和机体骨进行骨结合,减少种植体不良及排斥情况发生,改善口腔功能。同时CGF以微粒形成一种黏合剂,为新骨内向生长和沉积提供了支架,利用TGF-β/BMP信号通路及丝裂活化蛋白激酶信号通路,提高成骨相关基因表达,持续引导骨再生,稳定种植体,提高口腔功能,与卢俊等[20]研究结果一致。
综上所述,微创环切术联合CGF应用于口腔种植中可减轻疼痛,减少种植体附近边缘骨吸收量,增加种植体唇侧骨壁厚度,提高种植体附近软组织美观效果和口腔功能。

