SERS结合光谱法研究正壬酸香草酰胺与人血清白蛋白的相互作用
周家羽,周光明,陈 蓉,罗 丹
(西南大学 化学化工学院,发光与实时分析教育部重点实验室,重庆 400715)
药物及其他生物活性化合物对人体血液循环系统蛋白质成分的影响是当前的研究热点。众所周知,药物与血液成分的相互作用不仅会影响药物的生物利用度,还会影响生物分子的功能,对药理活性产生重大影响[1-3]。大多数药物的生物活性和药理活性可以通过药物与蛋白质之间的相互作用进行研究。较高的血浆循环水平和白蛋白具有结合多种化合物的能力,但通常认为药物与白蛋白的相互作用是主要的作用方式[4],而光谱技术作为药物-白蛋白相互作用研究的主要手段引起了人们的极大兴趣[5-7]。
辣椒素是具有镇痛止痒、抗炎消肿与抗肿瘤等作用的辣椒果实次生代谢产物[8]。正壬酸香草酰胺(Nonivamide,OC)与辣椒素有相似的化学结构和药理作用,可在神经生理、药理学研究中用作其替代物,现已广泛应用于医药、农业等行业[9]。目前关于OC的大部分研究主要集中于合成或间接评估OC的应用方面,有关OC与血清白蛋白之间相互作用的研究较少。人血清白蛋白(HSA)是人血浆中最丰富的血浆蛋白(约45 mg/mL),具有配体结合特性、抗氧化功能和酶活性[10-11],负责将各种氨基酸、药物分子、脂肪酸及其代谢物结合并转运至其分子靶位[12]。尽管HSA结构复杂,但其分子中仅含有一个色氨酸残基(Trp214),这一特点使其成为模型蛋白,为研究蛋白质与药物相互作用时的构象变化和局部微环境变化提供了便利[13-15]。药物与血清白蛋白的强结合导致血浆中游离药物的利用率低,而弱结合则导致药物分布较少[16],因此药物对血浆白蛋白的亲和力将直接决定可在游离状态下用于治疗的药物量[3]。
荧光光谱法是研究药物和HSA相互作用的方法之一,可得到结合常数及药物引起的HSA的结构变化等信息[17-18]。表面增强拉曼散射(SERS)技术是一种用于单分子检测和界面分析等的分子振动光谱,对研究分子间的相互作用非常灵敏,可提供分子构型和化学键变化方面的信息[19-20],也可以解释药物与血浆或血清白蛋白之间相互作用的机制。在非常低的药物浓度下,SERS的排他性和灵敏的检测能力使其成为血浆或血清白蛋白药物敏感领域中一种有吸引力的工具[21-22]。
本文利用多种光谱技术讨论了OC与HSA相互作用的性质,包括相互作用结合力和子域微环境的变化,同时对结合过程的热力学参数进行了评估。OC-HSA相互作用的有关信息不仅有利于药物设计和疾病治疗,也可为药物与生物大分子相互作用机制的研究提供参考。
1 实验部分
1.1 主要仪器与试剂
UItra-55场发射扫描电子显微镜(SEM,德国Carl zeiss NTS GmbH);UV-2450紫外可见光谱仪(日本岛津);雷尼绍拉曼光谱仪(英国雷尼绍),选用633 nm激光器;F-7000荧光光度计(日本日立)。
HSA用Tris-HCl缓冲液(pH 7.4,0.05 mol/L)配制成1.0×10-4mol/L的储备液,OC用50%无水乙醇/Tris-HCl溶液配制成1.0×10-3mol/L的储备液;氯金酸(HAuCl4·4H2O)、柠檬酸三钠(Na3-Cit)及以上试剂均为分析纯,购于上海阿拉丁生化科技有限公司。
1.2 紫外可见吸收光谱
将HSA溶液浓度固定为1.0×10-5mol/L,控制HSA与OC的浓度比,将其混合液恒温水浴30 min,扫描波长范围为200~800 nm的紫外可见吸收光谱。
1.3 荧光光谱
取500μL HSA溶液和不同浓度的OC溶液加至10 mL比色管中,用Tris-HCl缓冲溶液定容,然后置于298 K(303 K或310 K)恒温水浴30 min。荧光光谱参数设定:激发和发射狭缝宽度均为5 nm,激发波长280 nm,记录发射波长范围230~500 nm的光谱;同步荧光光谱参数设定:固定Δλ(Δλ=λemλex)为15 nm和60 nm,扫描荧光光谱。
1.4 金纳米颗粒(AuNPs)的制备
参考并改进了P.C.Lee法[23]制备AuNPs。首先配制100 mL HAuCl4(1.5 mol/L)和50 mL柠檬酸钠(1%)溶液;然后取50 mL HAuCl4溶液于烧瓶,采用油浴加热沸腾后迅速加入5 mL柠檬酸钠溶液,待溶液变为酒红色后继续加热15 min;最后持续搅拌冷却至室温,置4℃冷藏备用。
1.5 表面增强拉曼光谱
将OC固体置于干燥的玻片上进行普通拉曼光谱(NRS)测试。将HSA与OC的混合液与等体积AuNPs混合进行SERS测定。选用633 nm的激光器,扫描范围为350~2 000 nm,曝光时间为10 s,累计测定3次。
2 结果与讨论
2.1 金纳米颗粒的表征
AuNPs的SEM图如图1A所示,AuNPs呈尺寸约50 nm的小球状,大小及分布均匀。图1B为AuNPs的紫外光谱图,其在520 nm处出现最大吸收峰,与文献报道一致[24];加入OC后,吸收峰红移至603 nm,说明OC的附着使AuNPs的偶极矩增大,同时最大吸收峰的峰强降低;再加入HSA溶液,体系的最大吸收峰发生蓝移,最大吸附峰强度进一步降低。说明与HSA的相互作用使OC整个电子共轭体系的能量发生改变,并引起光谱变化。

图1 金纳米溶胶的SEM图(A)及室温下金纳米溶胶的紫外光谱图(B)Fig.1 SEM image(A)and UV-Vis spectra(B)of AuNPs
2.2 OC与HSA作用的紫外可见吸收光谱
HSA色氨酸和酪氨酸残基中的芳杂环发生n-π*和π-π*电子跃迁,使得HSA在280 nm处有吸收峰[25]。如图2所示,HSA的吸收峰强度随OC浓度的增加逐渐增强,表现为增色效应。由于已消除了药物的吸收作用,因此吸收强度的提高可能归因于药物与蛋白质之间形成的基态复合物[26]。结果表明,OC和HSA的相互作用会影响蛋白质的微环境和基态复合物(OCHSA)的形成,使蛋白质肽链伸展,内部氨基酸残基的微环境极性及疏水性产生变化,从而导致蛋白质构象结构的进一步改变。

图2 室温下OC-HSA的紫外可见吸收光谱图Fig.2 UV-Vis spectra of OC-HSA system T=298 K,c(HSA)=1×10-5 mol/L,c(OC)=0,0.25,0.5,1,2,3,4,5,6,7,8,9(×10-5)mol/L for curves 1 to 12
2.3 OC与HSA作用的荧光光谱
在天然构象中,HSA结构中的氨基酸残基可以产生内源荧光,其中产生最大荧光强度的是色氨酸残基(Trp)。因此,HSA结构域IIA中仅包含一个Trp残基(Trp214)的独特性质可以作为研究该结构域中局部微环境变化和蛋白质药物结合特性的内在探针。如图3所示,不同温度下HSA的荧光强度随着OC浓度的增大而变大,并伴随着明显的蓝移。通常认为荧光发射的蓝移意味着荧光团周围的环境变得更加疏水,而荧光发射的红移意味着荧光团的暴露,周围的环境变得更加亲水[10,27-28]。图3结果表明OC分子可能结合在亚结构域IIA中,使部分二级结构打开,暴露HSA的疏水腔,从而使蛋白质的微环境比其天然状态更具疏水性。此外,Trp214残基微环境的变化表明HSA与药物结合后可能形成更紧凑的结构。

图3 HSA与不同浓度OC在不同温度下相互作用的荧光光谱Fig.3 The fluorescence spectra of different concentrations of HSA with OC at different temperatures
2.4 OC与HSA作用的同步荧光光谱
通过同步荧光法选取合适的波长差使重叠的峰分开,从而判断蛋白质中氨基酸残基的极性和微环境变化。Δλ=60 nm表示色氨酸残基的荧光光谱,Δλ=15 nm代表酪氨酸残基的荧光光谱[29]。如图4A所示,随着OC浓度的增大,最大发射峰强度逐渐增强,并表现为蓝移,表明色氨酸残基的外环境极性减小,疏水性增大,该结论与从紫外可见吸收光谱以及荧光光谱中获得的结论非常吻合。而图4B光谱图的峰形未发生改变,说明酪氨酸残基的外环境未发生显著改变。
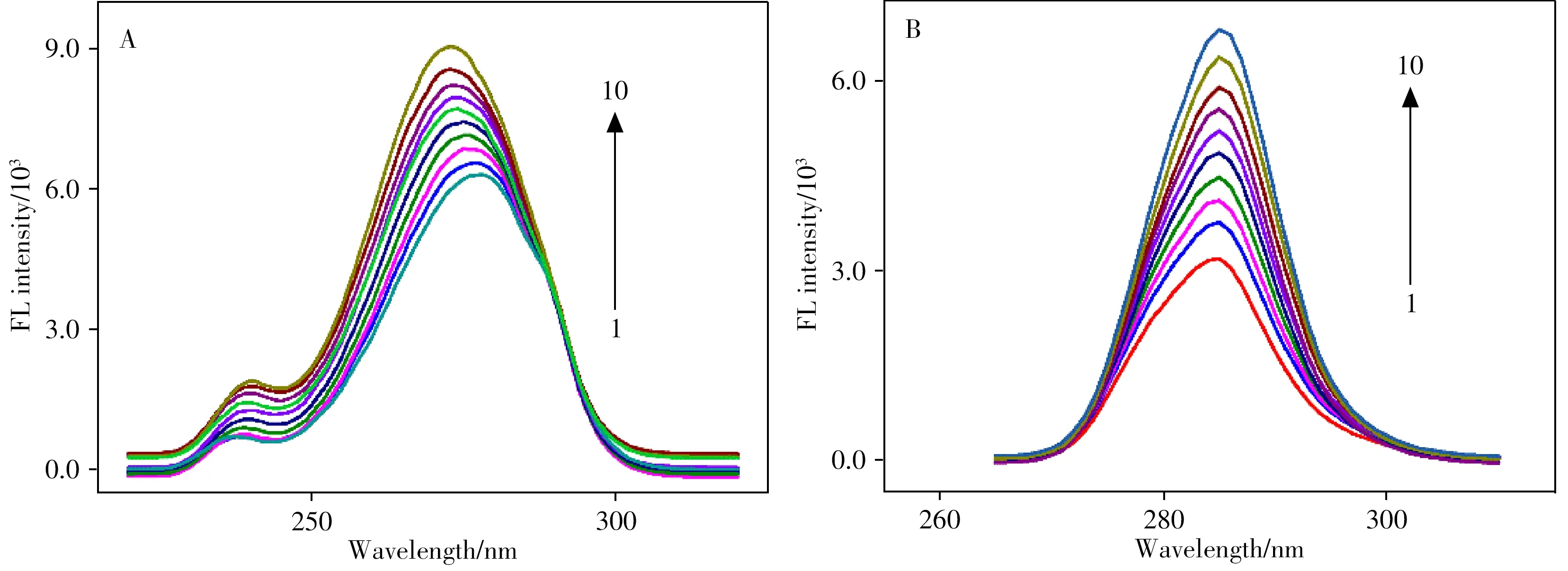
图4 OC-HSA体系的同步荧光光谱图Fig.4 Synchronous fluorimetry emission spectra of HSA upon addition of different concentrations OC
2.5 OC与HSA相互作用的结合常数
假设蛋白质与药物作用过程中存在单一结合位点,根据荧光增强方程[30-31]:

式中:F0为HSA的荧光强度;F为药物结合后的荧光强度;F∞为药物结合达饱和的荧光强度;Q为药物浓度;K为结合常数。以1/ΔF(y)对1/Q(x)作图(图5),直线斜率的倒数值即为K。OC-HSA体系荧光增强的双倒数图具有明显的线性,说明温度对两者间作用的K影响较小,且在不同温度下K值均较大(表1),说明两者结合稳定。

表1 不同温度下OC与HSA的结合常数Table 1 Binding constants of OC-HSA at different temperatures

图5 OC-HSA体系在不同温度下的荧光增强曲线Fig.5 Fluorescence enhancement curves for OCHSA system at different temperatures
2.6 OC与HSA的键和模式
根据Gibbs-Helmholtz方程[31]可以推断出配体与生物大分子之间相互作用的方式:

式中:K表示平衡常数;T表示温度;ΔH表示焓变;R表示摩尔气体常数;ΔG表示吉布斯自由能;ΔS表示熵变。焓变ΔH在温度变化不大的条件下可作为常数。由表2可知,将一定量的OC加入到HSA溶液中时可获得负的ΔH和正的ΔS,表明OC与HSA间存在静电和疏水作用力[32]。但是,静电力通常伴随着接近零的ΔH值。本研究中获得的ΔH为负值表明HSA与OC之间没有静电作用力。另一方面,ΔH为负可归因于范德华力以及OC与HSA极性氨基酸残基之间的氢键[32-33]。因此,疏水力、范德华力以及氢键被认为是稳定HSA-OC复合物的主要作用力[28,32]。

表2 不同温度下OC与HSA相互作用的热力学参数Table 2 Thermodynamic parameters of OC-HSA at different temperatures
2.7 OC的表面增强拉曼光谱
如图6所示,AuNPs对OC的拉曼信号有明显的增强作用。参考文献[34-37]并结合OC理论拉曼光谱(Theoreticala)对OC分子的谱峰进行归属。其NRS光谱中598 cm-1处为C—N—C的面外弯曲振动;715 cm-1处的峰由甲氧基伸缩振动引起;1 331 cm-1处由C—H面内弯曲振动引起。在OC的SERS光谱中,598、682、792 cm-1处的面外振动模式峰未增强,甚至消失,而面内弯曲振动(1 158 cm-1)和苯环面内变形振动(1 579 cm-1)显著增强。由表面选择定则可知:垂直方向的振动模式被显著增强,平行基底表面的振动模式增强较小,表明OC以垂直方式在基底表面吸附。此外,983 cm-1处的SERS谱峰对应于C—O—C的伸缩振动,该振动在NRS中是一个弱峰,而在SERS谱图中明显增强,再次表明分子以垂直方式结合于基底表面。OC的SERS谱图中位于1 158 cm-1处的C—O—H剪式振动模式增强,表明OC可能以—O-形式吸附在AuNPs表面。图6中苯环骨架振动特征峰出峰特别明显,原因在于,OC分子中的苯环是一个大π键的共轭体系,与基底结合时周围的π电子发生化学吸附,受苯环π电子的影响,OC分子牢牢地吸附在AuNPs表面,从而增大了拉曼信号。

图6 OC的SERS光谱Fig.6 Surface-enhance Raman spectroscopy of OC
2.8 OC与HSA作用的表面增强拉曼光谱
图7显示,HSA在AuNPs基底中的振动峰强度不大,OC-HSA相互作用的结合方式和空间取向可通过与HSA识别前后OC分子SERS谱图的变化进行分析。OC与HSA相互作用后的光谱峰强度显著降低,信噪比较差,说明两者发生了强烈的相互作用。在OC的SERS谱图中,存在甲氧基伸缩振动峰(712 cm-1)和983 cm-1处C—O—C的伸缩振动(图6),而与HSA作用后,这两个振动峰的相对强度降低,表明OC分子可能以甲氧基团嵌入到HSA的疏水位点中。此外,OC-HSA的C—H面外弯曲振动(695 cm-1和827 cm-1)和骨架伸缩振动峰以及面内弯曲振动峰均有所增强,表明与HSA结合后,表面OC在AuNPs上的空间取向发生了变化。但C—O—H剪式振动峰(1 164 cm-1)被显著增强,表明OC与HSA作用前后,以—O-形式吸附在AuNPs表面,吸附方式由垂直吸附转变为倾斜吸附。
3 结 论
本文在模拟生理条件下通过多种光谱法对OC与HSA的相互作用进行研究,以了解药物结合作用诱导的蛋白质微环境变化。荧光光谱结果表明,OC分子能够进入色氨酸残基附近的亚结构域IIA疏水空腔内部。通过过程热力学参数研究和分析,得出OC与HSA分子之间的作用力主要是氢键、范德华力和疏水作用力。这些相互作用导致OC-HSA复合物的形成,使蛋白质的局部微环境比其原生状态更疏水。最后以AuNPs作为增强基底,通过比较与HSA识别前后OC分子的SERS谱图的变化情况,推断OC分子以甲氧基作用于HSA的疏水腔中。该研究为进一步探索OC在体内的转运、代谢、排泄,以及药用科学性、合理性的发展等提供了一定的理论依据,对于阐明OC作用机理,揭示药物药效的实质以及生物体系内主客体识别的化学本质具有重要意义。

