化学发光酶免疫分析法检测水产品中残留的麻醉剂丁香酚
王 强,王旭峰,赵东豪,张英霞,黄 珂
(中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,广东 广州 510300)
丁香酚(Eugenol,Eul),化学名为4-烯丙基-2-甲氧基苯酚,广泛存在于丁香、肉豆蔻、月桂叶等中草药植物的提取物中[1-2]。丁香酚具有麻醉、抗菌及抗氧化等药理作用,在水产行业中常被作为渔用的麻醉剂[3-4]。在流通运输过程中,于暂养水体里添加丁香酚对鲜活水产品进行麻醉,可使其进入类似休眠状态从而降低生理代谢强度,有效降低鱼体损伤率和死亡率[5]。但研究表明丁香酚可能造成哺乳动物肝脏损伤,甚至具有潜在的致癌作用[6-7]。目前,不同国家和地区对丁香酚作为渔用麻醉剂尚未有统一的规定,日本允许使用并规定水产品中丁香酚最大残留限量为0.05 mg/kg,而我国和欧盟等其它国家对其在水产品中的限量值尚无明确的政策规定出台[8-9]。文献显示[10],在我国国内农贸市场上随机抽取的部分水产品中丁香酚的最高残留量达30 690μg/kg,整体检出率超过10%,其在食品中的残留蓄积状况值得关注。
目前,以液相色谱(LC)[11-13]和气相色谱(GC)[14-17]为基础的仪器分析法已经广泛应用于丁香酚的检测。其中部分液相色谱-串联质谱法(LC-MS/MS)对水产品中丁香酚的检出限可低至0.1μg/kg[13]。但仪器分析法需要昂贵的检测设备和相对专业的技术人员进行操作,其普遍应用受到限制。而免疫分析法(IA)具有高通量、灵敏、简便的优点,非常适用于现场快速筛查与检测。现有的丁香酚免疫分析法相对较少,且灵敏度较低。解超男等[18]建立了丁香酚胶体金免疫层析法,检出限为2.0 mg/L。Shen等[19]基于单克隆抗体建立的酶联免疫吸附法(ELISA)针对丁香酚的检出限为0.012μg/mL,但该方法只能检测水体样品。相比于传统的ELISA方法,化学发光酶免疫分析法(Chemiluminescent enzyme immunoassay,CLEIA)将化学发光信号增强技术与特异性的免疫分析法相结合,通过酶催化发光底物产生荧光信号实现定量检测,具有灵敏度高、线性范围宽、分析速度快(无需显色过程和终止)等优点,可进一步发挥抗原抗体特异性反应的优势[20]。目前,有关丁香酚的CLEIA快速检测技术研究尚未见文献报道。本研究在成功制备丁香酚半抗原和多克隆抗体基础上,建立了一种测定水产品中丁香酚残留的间接竞争化学发光酶免疫检测方法(ic-CLEIA),其检测结果与液相色谱-串联质谱法具有良好的相关性,且灵敏度相当。
1 实验部分
1.1 仪器、试剂与材料
SpectraMax多功能酶标仪、MultiWash洗板机(美国Molecular Devices公司);Xevo-TQS液相色谱-质谱联用仪、Xevo G2-XS Q-TOF四极杆-飞行时间质谱仪(美国Waters公司);N-EVAP氮吹仪(美国Organomation公司);U-3900紫外分光光度计(日本Hitachi公司);5810型台式离心机(德国Eppendorf公司);Oasis PRiME HLB固相萃取小柱(60 mg/3 mL,美国Waters公司);Milli-Q去离子水发生器(美国Millipore公司)。
丁香酚(纯度≥95.5%,上海麦克林生化科技有限公司);4-溴丁酸叔丁酯(上海阿拉丁生化科技股份有限公司);N-羟基琥珀酰亚胺、二环己基碳二亚胺、牛血清蛋白(BSA)、卵清蛋白(OVA)、Freund完全与不完全佐剂、色谱级甲醇(美国Sigma公司);羊抗兔IgG-HRP(武汉博士德生物工程有限公司);ic-CLEIA所需的包被液、封闭液、高灵敏ECL增强发光剂和稳定剂(生工生物工程(上海)股份有限公司);实验用新西兰大白兔(广东省医学动物实验中心);其它试剂均为国产分析纯。
1.2 半抗原的合成
参照文献[19]方法获取丁香酚半抗原4-(4-烯丙基-2-甲氧基-苯氧基)-丁酸(Eul-4-Tbl),并对其合成反应条件进行适当改进:将丁香酚1.64 g用30 mL N,N-二甲基甲酰胺(DMF)溶解后,加入无水K2CO32.0 g,置于80℃搅拌反应10 min,向溶液中缓慢滴加3.0 g 4-溴丁酸叔丁酯,随后将温度升至100℃后反应过夜;待反应液降至室温后,加入约80 mL冰水,进一步用乙酸乙酯连续萃取3次,有机相经过水洗和无水硫酸钠干燥,减压蒸馏除去乙酸乙酯后得到浅黄色油状物中间体。
将上述油状物用20 mL二氯甲烷(DCM)溶解,冰浴下加入10 mL三氟乙酸(TFA)反应2 h,蒸干溶剂,加20 mL水稀释后用20 mL乙酸乙酯连续萃取3次,进一步减压蒸馏后的油状物通过层析柱纯化得到的白色固体即为半抗原Eul-4-Tbl,具体合成路线如图1所示。
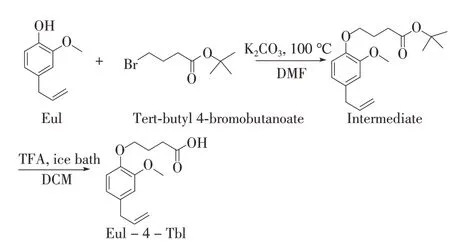
图1 半抗原Eul-4-Tbl的合成路线Fig.1 Synthesis route of hapten Eul-4-Tbl
1.3 人工抗原及Eul多克隆抗体的制备
采用活泼酯法将半抗原Eul-4-Tbl分别与载体蛋白BSA和OVA偶联,通过测定偶联物在200~400 nm波长区间的紫外吸收光谱对其进行结构鉴定,并计算人工抗原的偶联比[21]。以偶联物Eul-4-Tbl-BSA作为免疫抗原,Eul-4-Tbl-OVA作为包被抗原。将Eul-4-Tbl-BSA与等体积的Freund佐剂充分乳化混合后对新西兰大白兔进行动物免疫,免疫周期间隔3周,经6次免疫后获取兔源多抗血清,取部分抗血清以饱和硫酸铵沉淀法纯化后得到Eul多克隆抗体,备用。
1.4 ic-CLEIA方法的建立
用包被缓冲溶液将Eul-4-Tbl-OVA稀释至0.125μg/mL,每孔移取100μL加到酶标板上,4℃下放置过夜。用洗液洗涤3次,每孔加入120μL封闭液后于37℃下封闭3 h,随后用洗液洗涤2次,备用。检测时,每孔分别加入50μL待测物和50μL稀释40 000倍的Eul多克隆抗体,于37℃温箱中孵育反应30 min。酶标板用洗液洗涤5次后,每孔加入100μL羊抗兔IgG-HRP,继续于37℃孵育20 min。最后,酶标板洗涤5次后每孔加入100μL化学发光底物溶液(ECL发光剂和稳定剂等体积混匀),用多功能酶标仪测定相对发光强度单位(Relative light units,RLU)。采用OriginPro 8.5软件进行数据分析,其中横坐标为标准溶液质量浓度,纵坐标为RLU/RLU0(RLU0为无竞争药物时的化学发光值),绘制S型拟合竞争标准曲线,计算获得方法线性范围、半抑制浓度(IC50)和检出限(LOD)等参数。
1.5 样品前处理
鲜活水产样品取可食肌肉部分,于绞肉机中绞成肉糜状后,备用。准确称取(2.00±0.02)g于50 mL聚丙烯离心管中,加入5 mL乙腈,旋涡振荡提取5 min,随后5 000 r/min离心5 min,上清液转移至另一个50 mL聚丙烯离心管中,残渣再用5 mL乙腈重复提取1次。将乙腈提取液全部加载至PRiME HLB小柱上,收集流出液,于40℃水浴条件下氮吹至近干,加入0.5 mL甲醇充分复溶,用PBS缓冲液稀释10倍后,待测。
1.6 液相色谱-串联质谱分析(HPLC-MS/MS)
采用HPLC-MS/MS进行方法验证,色谱条件如下:Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,2.6μm);流速0.35 mL/min;柱温35℃;进样量10μL;流动相A为甲醇,B为水;梯度洗脱程序:0~2 min,10%~90%A;2~3 min,90%A;3~4 min,90%~10%A;4~5 min,10%A。质谱条件:电喷雾电离负离子模式(ESI-);毛细管电压2.0 kV;脱溶剂气温度450℃;脱溶剂气流速900 L/h;锥孔电压20 V;锥孔反吹气流速40 L/h;定量离子对(m/z):163.1/148.1,定性离子对(m/z):163.1/121.1。
2 结果与讨论
2.1 半抗原与人工抗原的合成与鉴定
丁香酚属于小分子有机化合物,分子量较低,本身不具有免疫原性,且其结构上缺乏能与大分子载体蛋白偶联的活性基团[22]。要获取丁香酚特异性抗体,首先必须设计合成有效的丁香酚半抗原。本研究采用4-溴丁酸叔丁酯衍生化法对丁香酚母体结构上的酚羟基进行改造,通过优化各项反应条件参数,合成了含有羧基手臂结构的半抗原Eul-4-Tbl,产率可达80%以上。将Eul-4-Tbl用甲醇溶解并稀释至100μg/L,随后用四极杆-飞行时间质谱仪对化合物结构进行鉴定(图2)。一级质谱(TOF MS)扫描显示,Eul-4-Tbl在其准分子离子峰[M-H]-m/z249.12处具有稳定的信号峰,且该峰附近一系列同位素峰m/z250.12和m/z251.12均与该化合物理论分子量相匹配。二级质谱(TOF MS/MS)扫描图显示,碎片离子m/z163.08(-C10H12O2)、m/z148.05(-C9H8O2)和121.03(-C7H5O2)具有明显的丰度,分子裂解规律与文献结论一致[19]。
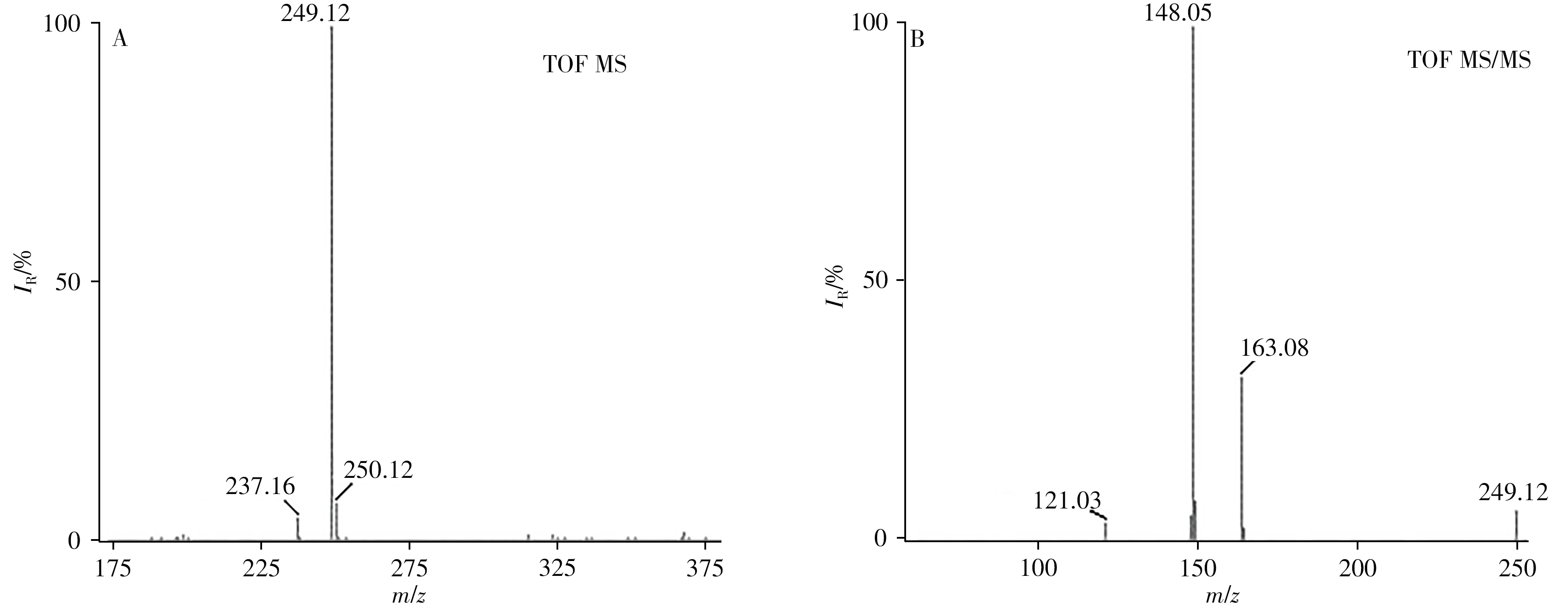
图2 半抗原Eul-4-Tbl的一级(A)和二级质谱图(B)Fig.2 TOF MS(A)and TOF MS/MS(B)spectra of hapten Eul-4-Tbl
将该半抗原进一步与载体蛋白进行偶联获取人工抗原。紫外光谱扫描显示(图3),偶联物Eul-4-Tbl-BSA和Eul-4-Tbl-OVA同时具备了半抗原和载体蛋白的特征吸收峰,经计算其偶联比分别为22∶1和17∶1,满足免疫分析法检测要求。
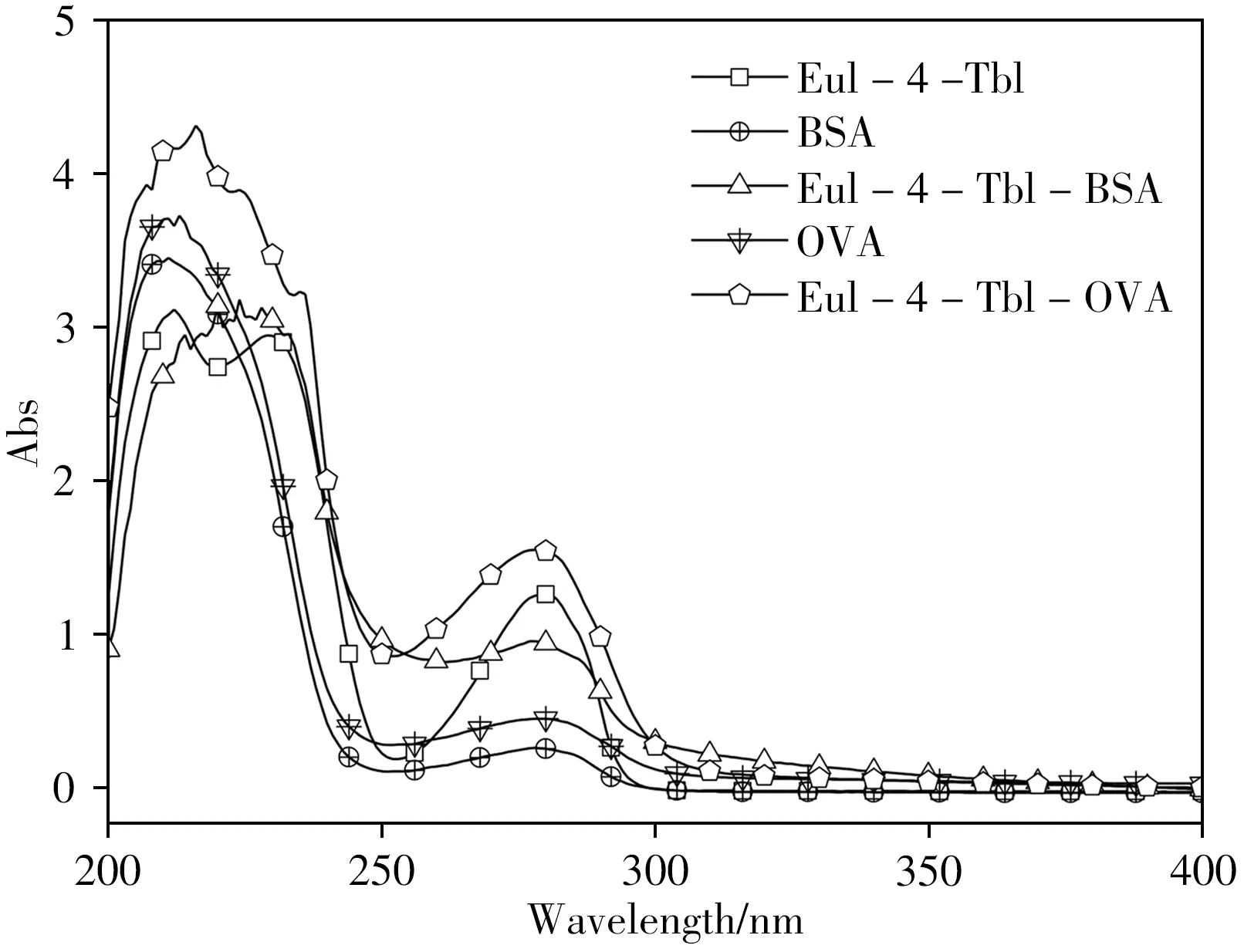
图3 人工抗原的紫外吸收图谱Fig.3 UV spectra of artificial antigen
2.2 抗体稀释度及包被抗原质量浓度的优化
按照“1.3”方法获取Eul多克隆抗体,采用棋盘法对抗体的稀释度和包被抗原Eul-4-Tbl-OVA的质量浓度进行优化。以100μg/L丁香酚标准溶液作为竞争药物,比较了不同条件下ic-CLEIA的化学发光强度RLU值以及同等条件下竞争药物对RLU值的抑制率,抑制率越高,灵敏度越高。经优化,确定最佳包被抗原质量浓度为0.125μg/mL,Eul多克隆抗体稀释40 000倍。
2.3 抗体反应时间的确定
抗体反应时间是影响免疫分析法灵敏度和检测效率的重要因素。将待测物或标准溶液和抗体溶液加入发光板微孔后,比较了不同反应时间下ic-CLEIA竞争曲线的RLU0值、IC50值以及RLU0/IC50的变化,RLU0/IC50越大,ic-CLEIA方法的灵敏度越高。结果显示,随着反应时间的延长,抗体与微孔板上固相包被原的结合量不断增多,RLU0逐渐升高,反应时间为15~30 min时,RLU0上升较为显著;超过30 min后,RLU0增长趋于平缓,而此时IC50值逐渐变大,导致RLU0/IC50不断降低。综合比较发现,反应时间为30 min时RLU0适中,RLU0/IC50最大,因此本研究的抗体竞争反应时间设为30 min。
2.4 标准稀释液的选择
分别使用ddH2O、PB、PBS和Tris-HCl 4种常用溶液作为标准稀释液并绘制ic-CLEIA竞争曲线,考察其对方法灵敏度的影响。结果发现,使用ddH2O和Tris-HCl时RLU0相对较低,而IC50值在PB稀释液下较高,均不是最优的选择。使用PBS作为稀释液时,IC50最低,RLU0/IC50最大,灵敏度优于其它溶液。研究表明,免疫分析检测中,反应体系含有低浓度的甲醇不会影响抗原抗体的结合反应[23-24]。本实验尝试在PBS标准稀释液中添加2%~10%(体积分数)的甲醇,结果显示,其竞争曲线的IC50值和RLU0无明显变化。因此,为使待测物充分溶解,提高实际样品检测结果的准确度和稳定性,在“1.5”前处理过程中,乙腈提取液经PRiME HLB净化并浓缩后,复溶时先加入0.5 mL甲醇促溶,再进一步用PBS稀释用于ic-CLEIA测定。
2.5 标准曲线的建立
根据上述优化条件,建立了丁香酚ic-CLEIA方法的标准曲线(图4),方法的IC50为1.28μg/L,检测范围(IC20~IC80)为0.25~6.43μg/L,LOD(IC10)为0.11μg/L,灵敏度优于文献报道的其它丁香酚类免疫分析法[18-19]。国家市场监督管理总局于2019年发布了《水产品及水中丁香酚类化合物的测定》的补充检验方法[25],其中水产品中丁香酚的气相色谱-质谱测定法的检出限为0.01 mg/kg,本方法可满足其检测要求。
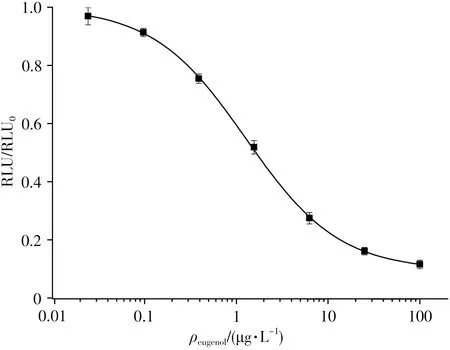
图4 丁香酚的ic-CLEIA标准曲线Fig.4 Standard curve of ic-CLEIA for eugenol
2.6 特异性分析
选择与丁香酚结构或功能类似的化合物进行测定并计算交叉反应率(Cross-reactivity,CR):结果表明,本方法对丁香酚的同分异构体异丁香酚和丁香酚的主要代谢物甲基丁香酚具有较低的交叉反应率,而对三卡因、苯佐卡因和异丙酚3种常见麻醉剂基本无交叉应(表1),所建立的丁香酚ic-CLEIA方法特异性良好。
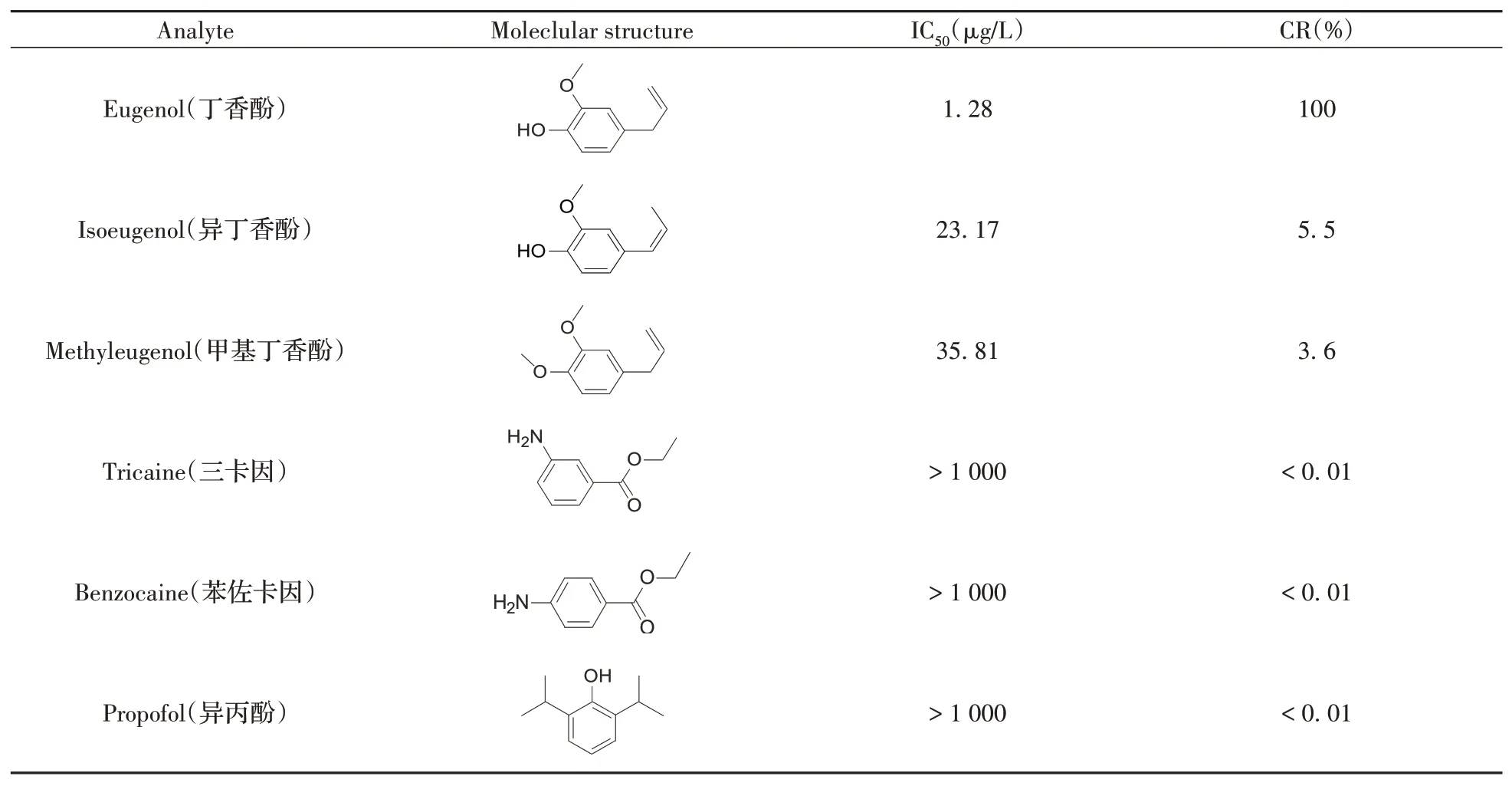
表1 ic-CLEIA方法对丁香酚及其类似物的交叉反应率Table 1 Cross-reactivity of eugenol and its analogs by ic-CLEIA method
2.7 样品基质效应消除
丁香酚属于极性化合物,易溶于有机试剂,本研究选用乙腈作为样品提取溶剂,获得了良好的蛋白沉淀效果,提取液澄清,样品回收率高。以Oasis PRiME HLB固相萃取柱进行净化处理,可吸附除去水产品中的脂肪和磷脂等杂质。将空白样品的净化提取液浓缩后分别用2、5、10 mL的PBS缓冲液复溶,并以此基质匹配液稀释丁香酚标准品,绘制基质标准曲线,考察基质效应。结果显示(图5),复溶体积为5 mL时所获得的基质竞争曲线与用标准稀释液所得曲线趋势一致,此时可以忽略基质效应对ic-CLEIA的干扰,无需进一步的稀释处理。
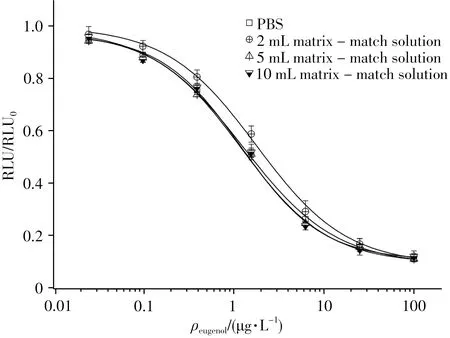
图5 样品基质效应对ic-CLEIA的影响Fig.5 Matrix effect of blank samples on ic-CLEIA performance
2.8 样品加标回收实验
向阴性的鲈鱼、鳜鱼和石斑鱼样品中分别添加低、中、高(2、5、10μg/kg)3个水平的丁香酚标准溶液,按照“1.5”方法进行样品前处理,用所建立的ic-CLEIA方法测定,每个水平做5次平行试验,计算样品的加标回收率和相对标准偏差(RSD)。同时用HPLCMS/MS方法进行比对验证。结果表明(表2),加标样品ic-CLEIA测定的平均回收率为76.6%~108%,RSD为5.9%~12%。将HPLC-MS/MS和ic-CLEIA的测定结果进行相关性分析,得到两种方法的线性回归方程为Y=1.120 21X-0.491 96,相关系数(r)为0.990 4,说明建立的ic-CLEIA方法准确可靠,可用于水产品中丁香酚残留的检测。
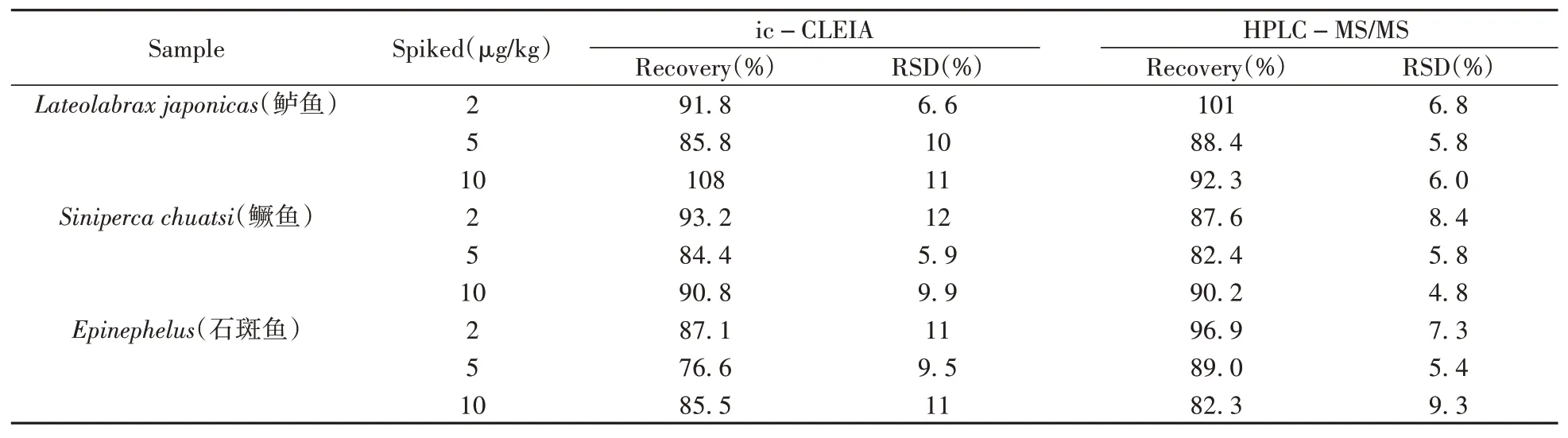
表2 HPLC-MS/MS与ic-CLEIA的样品加标回收率对比(n=5)Table 2 Recoveries of eugenol from spiked aquatic samples by ic-CLEIA and HPLC-MS/MS(n=5)
2.9 实际样品的测定
采用ic-CLEIA方法对广东省内水产批发市场采购的20份水产样品(石斑鱼、鲈鱼、乌鳢、鳜鱼、草鱼等)进行检测,结果在1份鲈鱼样品中检出丁香酚,含量为15.3μg/kg。通过HPLC-MS/MS对该样品进行确证分析,阳性色谱图如图6所示,其中丁香酚的含量为17.5μg/kg。
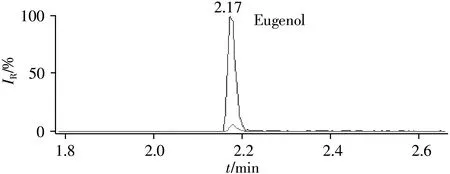
图6 阳性样品的色谱图Fig.6 Chromatogram of a positive sample
3 结 论
本文建立了ic-CLEIA测定水产品中麻醉剂丁香酚的分析方法。该方法采用4-溴丁酸叔丁酯衍生法制备丁香酚半抗原,通过免疫动物获取能够特异性识别丁香酚的多克隆抗体。优化建立的ic-CLEIA方法的IC50为1.28μg/L,检出限(IC10)为0.11μg/L。水产样品经Oasis PRiME HLB固相萃取柱净化消除基质干扰,平均加标回收率为76.6%~108%,RSD小于15%。该方法分析速度快、灵敏度高,适用于水产品中麻醉剂丁香酚残留的快速筛查和风险监测。

