成人与儿童急性淋巴细胞白血病免疫表型、染色体和分子遗传学异常分析
张军伟
(焦作市第二人民医院检验科,河南 焦作 454000)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病,其主要病理表现为大量异常增生的原始细胞在骨髓内聚集,抑制骨髓的正常造血功能,伴随侵及脑膜、淋巴结、性腺、肝等骨髓外组织[1-2]。ALL在儿童的发病率较高,儿童患者约占80%[3]。ALL患者的病死率较高,根据患者预后评估情况进行分层治疗可极大程度地改善ALL患者的预后[4]。ALL患者在免疫表型、细胞和分子遗传学、形态学等方面存在极大差异。随着检测技术的迅速发展,ALL的预后影响因素被不断发现,多数学者认为,细胞和分子遗传学与ALL患者的预后密切相关[5],但具体影响机制尚未完全明确。本研究旨在探讨成人与儿童ALL患者的免疫表型、染色体和分子遗传学异常情况,分析各年龄段患者的免疫表型、染色体和分子遗传学异常情况与预后的关系,为分层治疗提供依据。
1 资料与方法
1.1 一般资料选择2014年1月至2015年1月焦作市第二人民医院血液内科收治的ALL患者为研究对象。病例纳入标准:(1)所有患者经骨髓细胞形态学、免疫表型、细胞遗传学及分子生物学检查确诊为ALL,符合成人或儿童ALL诊断标准[6-7];(2)均为初次诊断患者;(3)患者入组前均未接受化学治疗;(4)行免疫表型、染色体和分子遗传学检测后根据患者年龄、病情及家属意愿给予患者个体化相关治疗。排除标准:(1)心、肝、肾等重要器官严重功能障碍;(2)患有其他血液系统疾病;(3)患者拒绝参与或因其他原因中途退出本研究。本研究共纳入ALL患者139例,按年龄将患者分为儿童组(≤14岁)和成人组(>14岁)。儿童组57例,男31例,女26例;年龄1~14(7.56±3.58)岁;骨髓细胞形态学-免疫学-细胞遗传学-分子生物学分型(即MICM分型)危险分级[8]:低危10例,标危41例,高危6例。成人组82例,男48例,女34例;年龄16~58(35.69±6.93)岁;MICM分型危险分级:标危66例,高危16例。本研究经医院伦理委员会审核批准,所有患者和(或)家属签署知情同意书。
1.2 资料采集(1)免疫表型:取患者肝素抗凝骨髓2 mL,常规分离单个核细胞,采用流式细胞术和荧光法进行免疫表型分析,单克隆抗体包括CD38、CD56、CD20、CD34、CD33、CD17、CD2、CD7、CD22、CD79、CD19、CD10、髓系抗原(myeloid antigen,MyAg)、人白细胞DR抗原(human leukocyte antigen DR,HLA-DR)等,阳性判断标准:髓系抗原阳性细胞≥20%,淋系抗原阳性细胞≥30%,干细胞抗原阳性及非系列特异性≥20%。(2)染色体核型:抽取患者骨髓3 mL,肝素抗凝,采用直接法和24~48 h培养法检测染色体核型。(3)分子遗传学特征:采用反转录-聚合酶链式反应技术检测15种ALL常见融合基因:BCR/ABL、SIL/TAL1、MLL/AFX、MLL/AF1P、MLL/AF4、MLL/AF6、MLL/EML、TEL/AML1、dupMLL、TEL/PDGFR、TEL/ABL、E2A/PBX1、HOX11、E2A/HLP。(4)临床随访情况:所有患者随访5 a,记录患者完全缓解(complete remission,CR)、复发、总生存期(overall survival,OS)、中位OS等。OS为从纳入研究开始,至因任何原因引起死亡的时间。CR:(1)外周血无原始细胞,无髓外白血病;(2)骨髓三系造血恢复,原始细胞<5%;(3)外周血中性粒细胞绝对值(absolute neutrophil count,ANC)>1.0×109L-1,外周血血小板(platelet,PLT)计数>100×109L-1;(4)4周内无复发[6]。复发是指已取得CR的患者外周血或骨髓又出现原始细胞(比例>5%),或出现髓外疾病[6]。
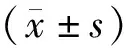
2 结果
2.1 免疫表型检查结果分析结果见表1和表2。139例ALL患者均进行免疫表型检查,其中急性B淋巴细胞白血病(B-line acute lymphoblastic leukemia,B-ALL)患者115例(82.74%),急性T淋巴细胞白血病(T-line acute lymphoblastic leukemia,T-ALL)患者18例(12.96%),非T非B细胞型急性淋巴细胞白血病(null acute lymphoblastic leukemia,N-ALL)患者3例(2.15%),T/B双表达急性淋巴细胞白血病(急性混合型)患者3例(2.15%)。115例B-ALL患者中,含有脯氨酸合成途径必需的基因B(pro-B)型16例,普通B细胞(com-B)型71例,前B细胞(pre-B)型28例。成人组患者中B-ALL 分型占79.27%(65/82),T-ALL分型占14.63%(12/82),N-ALL分型占2.44%(2/82),急性混合型ALL占3.66%(3/82);儿童组患者中B-ALL分型占87.72%(50/57),T-ALL 分型占10.53%(6/57),N-ALL分型占 1.75%(1/57),急性混合型ALL占0.00%(0/57);成人组与儿童组患者免疫表型比较差异无统计学意义(χ2=2.886,P>0.05)。髓系抗原表达以CD13阳性(43.61%)最常见,其次为CD15(16.54%)、CD33(9.02%)、CD117(7.51%)。T-ALL患者的干/祖细胞标志CD34、HLA-DR阳性率显著低于B-ALL患者,差异有统计学意义(χ2=5.103、4.925,P<0.05)。Kaplan-Meier 分析显示,pro-B型患者的中位OS未达到,com-B、pre-B型、T-ALL患者的中位OS分别为41、45、22个月;log-rank检验显示,T-ALL患者的中位OS显著短于com-B型、pre-B型患者,差异有统计学意义(P<0.05)。
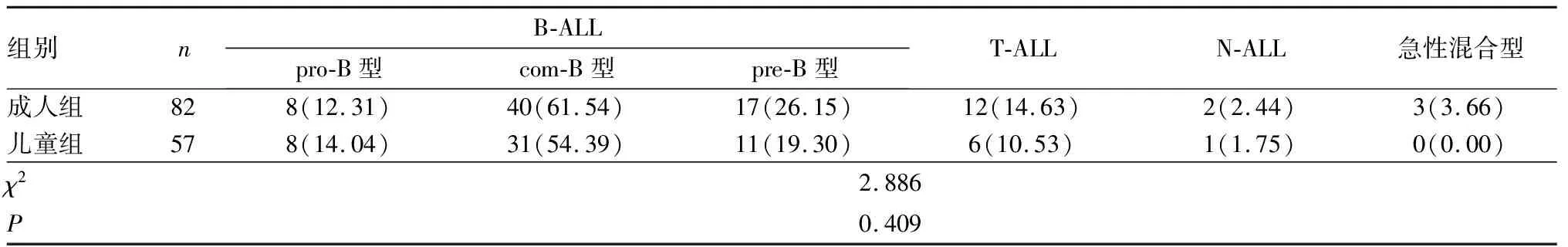
表1 成人组和儿童组ALL患者免疫表型比较

表2 B-ALL和T-ALL患者免疫表型特征分析
2.2 ALL患者染色体核型分析结果见表3和表4。139例ALL患者均进行染色体核型分析,其中正常核型72例(51.80%),异常核型67例(48.20%)。异常核型患者中,包括t(9;22)核型20例(14.39%),超二倍体核型14例(10.07%),亚二倍体核型10例(7.19%),t(1;19)核型9例(6.47%),t(8;14)核型6例(4.32%),11q-核型4例(2.88%),其他核型4例(2.88%)。成人组患者中正常核型34例(41.46%),异常核型48例(58.54%);儿童组患者中正常核型38例(66.67%),异常核型19例(33.33%);儿童组患者异常核型比例显著低于成人组,差异有统计学意义(χ2=8.554,P<0.05)。儿童组和成人组t(9;22)核型患者分别占3.51%(2/57)、21.95%(18/82),儿童组t(9;22)核型患者比例显著低于成人组,差异有统计学意义(χ2=9.284,P<0.05)。儿童组和成人组t(8;14)核型患者分别占0.00%(0/57)、7.37%(6/82),儿童组t(8;14)核型患者比例显著低于成人组,差异有统计学意义(χ2=4.358,P<0.05)。Kaplan-Meier分析显示,正常核型患者的中位OS未达到,t(9;22)、亚二倍体、复杂核型及其他类型的核型异常患者的中位OS显著低于正常核型患者(P<0.05)。单因素Cox分析显示,t(9;22)核型异常患者死亡风险是正常核型患者的4.008倍,其他核型异常患者死亡风险是正常核型的2.658倍。

表3 儿童组和成人组ALL患者染色体核型分析

表4 不同染色体核型ALL患者死亡风险分析
2.3 ALL患者分子遗传学特征分析139例ALL患者均进行分子生物学检查,未检出融合基因者93例(66.90%),检出融合基因者46例(33.10%)。46例检出融合基因患者中,BCR/ABL融合基因20例(43.48%),混合型融合基因9例(19.57%),MLL重排融合基因6例(13.04%),AML/TML融合基因5例(10.87%),PBX1/E2A融合基因4例(8.70%),E2A/HLF融合基因1例(2.17%),EVI1融合基因1例(2.17%)。儿童组检出融合基因者13例(22.81%),包括BCR/ABL融合基因2例,混合型融合基因5例,MLL重排融合基因2例,AML/TML融合基因1例,PBX1/E2A融合基因1例,E2A/HLF融合基因1例,EVI1融合基因1例;成人组检出融合基因者33例(40.24%),包括BCR/ABL融合基因18例,混合型融合基因4例,MLL重排融合基因4例,AML/TML融合基因4例,PBX1/E2A融合基因3例;儿童组患者融合基因检出率显著低于成人组,差异有统计学意义(χ2=4.617,P<0.05)。Kaplan-Meier分析显示(图1),未检出融合基因患者的中位OS未达到,BCR/ABL融合基因患者的中位OS为14.25个月,未检出融合基因患者的中位OS显著高于BCR/ABL融合基因患者,差异有统计学意义(P<0.05)。

图1 不同分子遗传学特征ALL患者的生存曲线
2.4 儿童组与成人组患者的预后比较儿童组和成人组患者的CR率分别为98.25%(56/57)、82.93%(68/82),儿童组患者的CR率显著高于成人组,差异有统计学意义(χ2=48.145,P<0.05)。82例成人患者中,低危、标危、高危患者的CR率分别为0.00%(0/0)、87.88%(58/66)、62.50%(10/16);标危患者CR率显著高于高危患者,差异有统计学意义(χ2=5.858,P<0.05)。57例儿童患者中,低危、标危、高危患儿的CR率分别为100.00%(10/10)、100.00%(41/41)、83.33%(5/6);高危患儿的CR率显著低于标危患儿,差异有统计学意义(χ2=6.981,P<0.05);高危患儿的CR率低于低危患儿,但差异无统计学意义(χ2=1.778,P>0.05);标危与低危患儿的CR率比较差异无统计学意义(χ2=0.000,P>0.05)。儿童组和成人组CR患者的复发率分别为21.43%(12/56)、72.06%(49/68),儿童组CR患者的复发率显著低于成人组,差异有统计学意义(χ2=31.496,P<0.05)。
68例CR成人患者中,低危、标危、高危患者的复发率分别为0.00%(0/0)、74.14%(43/58)、60.00%(6/10);标危成人CR患者的复发率高于高危成人患者,差异无统计学意义(χ2=0.846,P>0.05)。56例CR患儿中,低危、标危、高危患儿的复发率分别为10.00%(1/10)、19.51%(8/41)、60.00%(3/5);高危CR患儿的复发率显著高于低危和标危患儿,差异有统计学意义(χ2=4.261、4.015,P<0.05);标危CR患儿的复发率高于低危患儿,但差异无统计学意义(χ2=0.500,P>0.05)。
Kaplan-Meier分析显示(图2),儿童组和成人组患者的OS分别为(36.26±5.69)、(18.85±4.69)个月,儿童组患者的OS显著长于成人组,差异有统计学意义(t=19.709,P<0.05)。标危、高危成人患者的OS分别为(19.00±4.16)、(13.00±3.59)个月;高危成人患者的OS显著短于标危患者,差异有统计学意义(t=5.304,P<0.05)。低危、标危、高危患儿的OS分别为(43.56±4.15)、(38.16±3.28)、(19.10±2.58)个月;低危患儿的OS显著长于标危患儿,差异有统计学意义(t=8.531,P<0.05);低危和标危患儿的OS显著长于高危患儿,差异有统计学意义(t=15.556、13.585,P<0.05)。

图2 儿童与成人ALL患者的生存曲线
3 讨论
ALL根据免疫表型可分为B型和T型,其中B型ALL分为pro-B型、com-B型、pre-B型 3种类型。SANDDHYA等[12]研究表明,免疫表型与ALL临床治疗效果及患者生命周期存在一定相关性。本研究结果显示,T-ALL中的干/祖细胞标志CD34、HLA-DR阳性率明显低于B-ALL,log-rank检验显示,T-ALL患者的中位OS显著短于com-B型、pre-B型患者,提示ALL患者生物学特征差异较大,不同免疫表型患者的治疗效果也不尽相同,因此,根据ALL患者的生物学特征制订治疗方案,对改善患者生活质量、延长患者生存期等具有重要意义,这与VALLACHA等[13]的研究结果一致。
在分子生物学及细胞遗传学中,不同基因突变及染色体核型异常在成人和儿童ALL患者中的发生率差异较大,同时具有不同的意义。染色体数量超过46条即为超二倍体异常,常见于pre-B型ALL患者。存在超二倍体的ALL成人患者预后较差,5 a 总生存率仅约30%[14];而存在超二倍体的ALL儿童患者预后较好,5 a 总生存率高达100%[15]。t(9;22)在ALL成人患者中较为常见,发病率为12%~30%,而在儿童患者中出现相对较少[16]。本研究结果显示,儿童组患者异常核型比例显著低于成人组,儿童组t(9;22)核型患者比例显著低于成人组。Kaplan-Meier分析显示,t(9;22)核型患者的中位OS为11个月,正常核型患者中位OS未达到,亚二倍体、复杂核型及其他类型的核型异常的中位OS均短于核型正常患者,与国际权威的临床COX风险评估结果的论点一致[17]。
尽管目前造血干细胞移植技术迅速发展,多种新型酪氨酸激酶抑制剂问世,BCR/ABL患者复发率仍处于较高水平,而复发的BCR/ABL患者预后更差[18]。因此,早期检测融合基因对预测患者的临床疗效及预后具有一定帮助。本研究结果显示,儿童组患者融合基因检出率显著低于成人组,提示ALL患者融合基因发生率与年龄存在一定联系,检查患者的分子遗传学特征对评估患者的预后及制定针对性治疗方案具有一定帮助,这与邓莉萍等[19]研究结果一致。MICM分型标准是根据免疫表型、融合基因及染色体改变等进行危险度分级。本研究根据MICM预后分层将患者分组,发现高危成人患者的OS显著短于标危患者,低危患儿的OS显著长于标危患儿,低危和标危患儿的OS显著长于高危患儿;进一步说明免疫表型、染色体及分子遗传特征影响ALL患者的预后,MICM预后分层在评估ALL预后方面具有一定的价值。
综上所述,相较于成人ALL患者,儿童ALL的预后情况较好;ALL成人患者核型异常和分子遗传学异常发生率高于儿童患者,核型正常患者预后较好,早期进行MICM预后分层对评估ALL患者的预后具有重要意义。

