人参皂苷Rg1 通过激活Nrf2/HO-1 信号通路抑制H2O2-N2a 细胞氧化应激损伤的研究
赵宇萌,陈吉聪,肖洪贺,田 雨,李 贺,田晋明,杨静娴
(辽宁中医药大学 药学院,辽宁 大连 116600)
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的神经退行性疾病,病理表现为大脑皮层和海马区出现老年斑、神经纤维缠结和神经元丢失。在AD 早期患者的脑内普遍存在过量的活性氧,这将导致细胞膜的脂质过氧化,进而促进细胞外Aβ 的沉积和细胞内tau 蛋白的异常磷酸化,从而影响突触功能,加速AD 进程,导致神经元凋亡[1]。尽管国内外现有药物能部分缓解AD 症状,但无法有效改善脑内的过氧化状况,且长期使用均存在一定的副作用。因此,建立一种消除脑内过多氧自由基的新方法对治疗AD 具有重要意义。
核因子E2 相关因子2(Nuclear factor erythroid-2 related factor 2,Nrf2)是机体内重要的氧化应激调控蛋白。过度的氧自由基会激活Nrf2,使其由胞浆向核内转移,同时诱导血红素氧合酶-1(Heme oxygenase-1,HO-1)的表达[2]。HO-1 是机体内主要的抗氧化蛋白,可以促进血红素的降解以及胆绿素的生成,并清除氧化还原失衡所积累的自由基,从而发挥抗氧化作用[3]。
人参皂苷Rg1(Ginsenoside Rg1,Rg1)是中药人参的主要活性成分之一,相关研究表明,其具有增强免疫、神经保护、抗氧化等多重生物活性[4]。另外,本课题组前期研究结果显示[5],以Rg1 为主要药效成分的参枣健脑口服液能有效改善APP/PS1 小鼠的学习记忆能力并促进脑内神经再生。基于以上研究结果,推测Rg1 能通过抑制氧化应激损伤,改善脑内微环境来发挥抗AD 的作用。因此,本实验利用H2O2诱导小鼠神经瘤母细胞构建体外细胞模型,采用Western Blot、免疫荧光染色等方法进一步探究Rg1 对H2O2-N2a 的影响,从而为其治疗AD 提供实验基础。
1 材料与方法
1.1 材料
1.1.1 试剂 人参皂苷Rg1(四川省维克奇生物科技有限公司,批号:wkq19040208);胎牛血清(浙江天杭生物科技股份有限公司,批号:19110505);青-链双抗(美国Hyclone 公司,批号:J190007);Caspase3 抗 体(批号:WL02117)、Nrf2 抗体(批号:WL02135)、HO-1 抗 体( 批 号:WL02400),GAPDH 抗体(批号:WL01114)、HRP 标记山羊抗兔lgG (批号:WLA023)、山羊抗兔CyTM3 标记二抗、Hoechst33258 染色液(批号:WLA036a)均购自沈阳万类生物技术有限公司;CCK-8 细胞增殖检测试剂盒(G021-1)、乳酸脱氢酶试剂盒(A020-2-2)、总超氧岐化酶测定(LDH)试剂盒(A001-1-2)和丙二醛(MDA)测定试剂盒(A033-1-2)均购自南京建成生物工程研究所。
1.1.2 实验仪器 Ti-S 型倒置荧光显微镜(日本尼康株式会社);C00I01HW 型CO2培养箱(北京东联哈尔仪器制造有限公司);MR-96A 型酶标仪(深圳迈瑞生物医疗电子股份有限公司);SH-510 型凝胶成像系统(杭州申花科技有限公司)。
1.1.3 实验细胞 小鼠神经瘤母细胞(N2a)购于赛业(苏州)生物科技有限公司,批号:210409G61。在37℃、5% CO2条件下,用含10%胎牛血清、1% P/S的高糖DMEM培养基培养N2a细胞,选择对数生长期细胞进行实验。
实验分为对照组、模型组、给药组。对照组不进行处理;模型组加入浓度为500 μmol/L 的H2O2;给药组加入50 μmol/L 的人参皂苷Rg1,同时给予浓度为500 μmol/L 的H2O2,继续培养24 h 后进行检测。
1.2 实验方法
1.2.1 CCK-8 法检测细胞活力 取N2a 细胞以5×103个/孔的密度接种于96 孔板中,待细胞贴壁后,给药组分别加入不同浓度的Rg1(6.25、12.5、25、50、100 μmol/L)预保护24 h 后,模型组和给药组给予H2O2(500 μmol/L)孵化5 h[6-9],之后每孔加入10 μL CCK-8 溶液,37℃孵育2 h,并用酶标仪在450 nm 处检测各组细胞的吸光度,绘制量效曲线。
1.2.2 Hoechst 33258 染色法检测细胞凋亡率 取N2a 细胞以5×103个/孔的密度接种于96 孔板中,待细胞贴壁后,给药组加入浓度为Rg1(50 μmol/L),药物预保护24 h后,模型组和给药组更换成H-DMEM基础培养基,加入H2O2(500 μmol/L)孵育5 h。培养结束后,弃去培养基,加入100 μL 4%多聚甲醛溶液固定细胞10 min。弃去固定液,PBS 清洗3 min,重复两次。再加入500 μL Hoechst 33258 染色液,置于摇床上染色5 min。弃去染色液,PBS 清洗3 min,重复两次,使用抗淬灭封片液封片,荧光显微镜下拍照观察。
1.2.3 免疫荧光细胞化学法检测Caspase 3 的表达
细胞分组、接种方法、给药方法同 “1.2.2”,培养结束后,各组细胞用4%多聚甲醛固定30 min,PBS 清洗3 次,每次5 min,0.5% Triton 室温下透化5 min;PBS 洗 涤3 次, 每 次5 min。 随 后 加 入Caspase 3 一抗孵育,4 ℃过夜。次日弃去液体,PBS清洗,再用CyTM3 标记二抗室温孵育60 min;PBS洗涤3 次,每次5 min;加入DAPI 染色液(1 ∶10)避光反应2 min,PBS 洗涤3 次,每次5 min,荧光显微镜下观察并拍照。
1.2.4 LDH 释放量的检测 细胞分组、接种方法、给药方法同 “1.2.2”,培养结束后,吸出96 孔板中各组细胞的培养基于1.5 mL 的EP 管中,4℃,3 000 r/min离心5 min,吸取上清液,并根据LDH 试剂盒使用说明进行检测。
1.2.5 抗氧化指标的检测 细胞分组、接种方法、给药方法同 “1.2.2”,培养结束后,弃培养基,每孔加入100 μL 1%,Triton 溶液破碎细胞30 min,随后反复冻融细胞3 次,将溶液转移至EP 管中,4℃,1 500 r/min,取上清液,按照试剂盒的说明测定SOD活性和MDA 含量。
1.2.6 检测Nrf2 和HO-1 蛋白表达 细胞分组、接种方法、给药方法、细胞透化同“1.2.3”,每空加入Nrf2 和HO-1 一抗(1 ∶150),4 ℃孵育过夜。次日弃去液体,PBS 清洗,再用CyTM3 标记的二抗(1 ∶200)室温孵育60 min;PBS 洗涤3 次,每次5 min;加入DAPI 染色液(1 ∶10)避光反应2 min,PBS洗涤3次,每次5 min,荧光显微镜下观察并拍照。
1.2.7 Western Blot 法检测Nrf2 和HO-1 蛋白表达水平 取N2a 细胞以1×105个/mL 的密度接种于6孔板中,细胞分组、给药方法同“1.2.2”,培养结束后,弃培养基,预冷的PBS 洗涤3 次,根据全蛋白试剂盒说明书提取蛋白,根据BCA 蛋白定量试剂盒进行蛋白定量并调整蛋白浓度;两端各加入5 μL 预染的Marker,122 V 恒压电泳90 min,当指示剂达到分离胶底部停止电泳[10],转膜后,使用5%的脱脂牛奶室温封闭2 h,加入Nrf2、HO-1 和GAPDH 一抗抗体,4 ℃过夜,次日,将PVDF 膜用TBST 液清洗后,孵育二抗,TBST 洗膜3 次,用超敏ECL 化学发光试剂盒显色,用Image J 图像分析软件对条带扫描;以GAPDH 作为内参,分析目的蛋白表达。
1.2.8 统计学方法 用SPSS 22.0 软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较采用方差分析,两组间比较采用t检验。以P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 Rg1 改善H2O2-N2a 的细胞形态并促进存活
模型组细胞在给予500 μmol/L H2O2损伤5h 后,与对照组相比,细胞存活率明显下降(P< 0.01)。而经不同浓度Rg1 预保护24 h 后,与模型组相比,各给药组细胞存活率均有不同程度的提升;其中,25、50 μmol/L Rg1 组更明显(P< 0.05)。根据实验结果,选择50 μmol/L Rg1 预保护24 h 进行后续实验。光镜下可见,对照组细胞胞体饱满,生长状态良好,模型组细胞胞体皱缩,存在凋亡情况;而经过50 μmol/L Rg1 预保护24 h 后,细胞形态有所改善,凋亡细胞数目减少,见图2。以上结果证明,Rg1 预保护能改善H2O2-N2a 的细胞形态并促进存活。
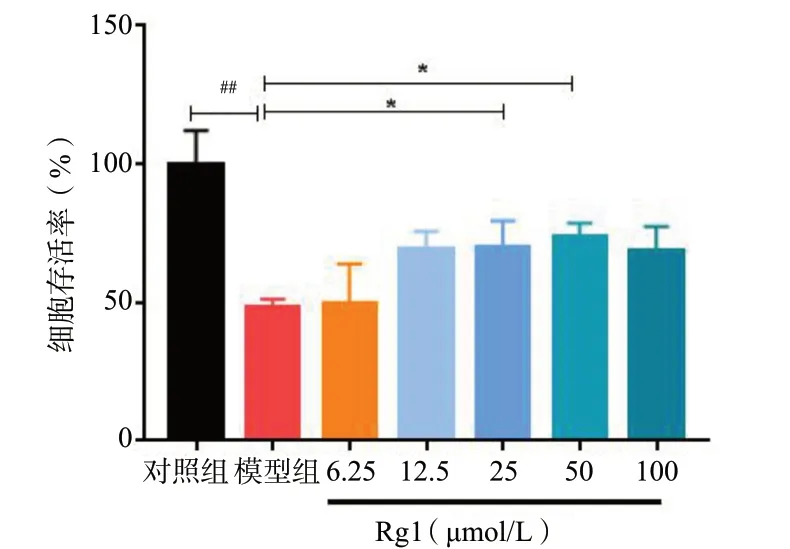
图1 不同浓度Rg1 对H2O2 诱导N2a 细胞的保护作用(n = 6)Fig.1 Protective effect of different concentrations of Rg1 on H2O2 induced N2a cell damage (n = 6)

图2 Rg1 对细胞影响的光镜图Fig.2 Microscopic view of the effect of Rg1 on cells
2.2 Rg1 减少H2O2-N2a 的凋亡
LDH 释放量的结果见图3,模型组细胞在给予H2O2损伤后,与对照组相比,LDH 的释放量明显升高(P< 0.01),而经50 μmol/L Rg1 预保护24 h后,与模型组相比,给药组LDH 的释放量下降(P<0.01)。使用Hoechst 33258 染色以及免疫荧光化学染色进一步验证Rg1 的抗凋亡作用。Hoechst 33258 染色结果见图4、图5,细胞损伤后,与对照组相比,模型组凋亡发生率明显上升(P< 0.01);而经Rg1预保护后,给药组细胞凋亡率较模型组相比明显下降(P< 0.01)。Caspase 3 是细胞凋亡过程中最主要的终末剪切酶,Caspase 3 表达的升高意味着细胞逐渐趋于凋亡。与对照组相比,模型组Caspase 3 阳性细胞率明显上升(P< 0.01),而给予Rg1 预保护后,给药组细胞内Caspase 3 阳性细胞率较模型组相比明显下降(P< 0.01),见图6、图7。综上所述,Rg1能有效减少H2O2-N2a 的凋亡。
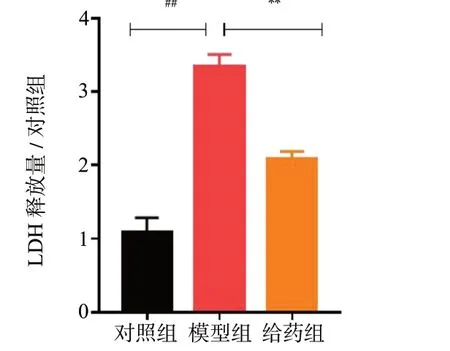
图3 LDH 释放量统计图(n = 6)Fig.3 Statistical plot of LDH release(n = 6)
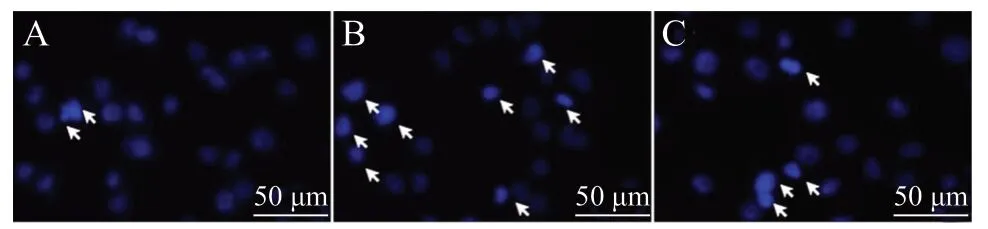
图4 Hoechst 33258 法检测细胞凋亡Fig.4 Detecting cell apoptosis by Hoechst 33258

图5 Hoechst 33258 统计图(n = 6)Fig.5 Statistical plot of Hoechst 33258 (n = 6)
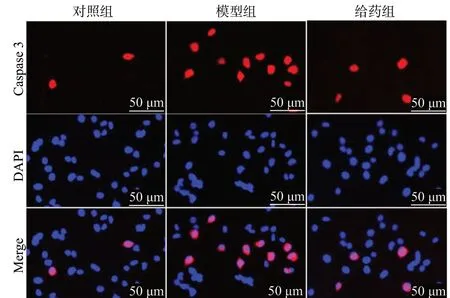
图6 免疫荧光染色法检测Caspase 3 阳性细胞的表达Fig.6 Immunofluorescence staining detect the expression of Caspase 3 positive cell
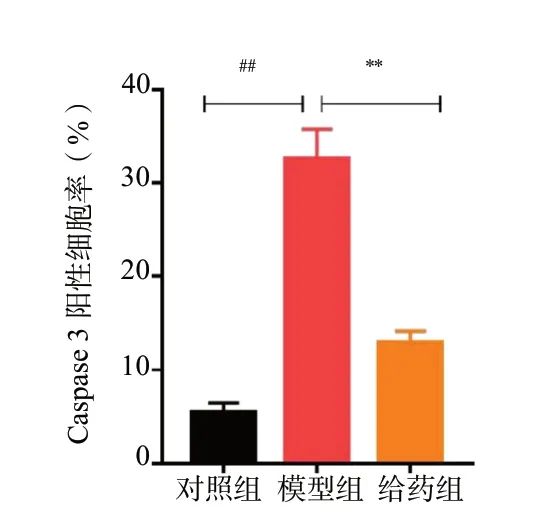
图7 Rg1 对Caspase 3 阳性细胞率统计图(n = 6)Fig.7 Statistical plot of Caspase 3 positive cell rate(n = 6)
2.3 Rg1 抑制H2O2-N2a 的氧化应激损伤
MDA 是脂质氧化的终产物,反映机体脂质过氧化的程度。SOD 是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质。因此测定MDA 和SOD 可有效的放映细胞的氧化应激状态。与对照组相比,模型组细胞在与给予H2O2损伤后,MDA 含量明显上升,SOD 活性明显降低(P< 0.01);而经Rg1 预保护后,与模型组相比,细胞内MDA 的含量下降,SOD 的活性有所上升(P< 0.05),见图8。根据以上结果,认为Rg1 能有效抑制H2O2-N2a 的氧化应激损伤。

,图8 Rg1 对MDA、SOD 影响的统计图(n = 6)Fig.8 Statistical plot of Rg1 effect on MDA and SOD(n = 6)
2.4 Rg1 对N2a 细胞Nrf2 和HO-1 蛋白表达水平的影响
为了探讨Rg1 抑制H2O2诱导的N2a 细胞氧化损伤作用的机制,我们采用免疫荧光化学法和Western Blot 法检测Nrf2 和HO-1 的表达情况。免疫荧光结果见图9 -图12,给予H2O2损伤后,与对照组相比模型组细胞Nrf2 和HO-1 的表达量减少(P< 0.01),而给予Rg1 后,细胞内Nrf2 和HO-1 的表达水平明显上升(P< 0.05,P< 0.01)。Western Blot 结果见图13、图14,与对照组相比,模型组细胞Nrf2 和HO-1 的表达明显降低(P< 0.01);而与模型组相比,给予Rg1 后,细胞内Nrf2 和HO-1 的表达明显增加(P< 0.05,P< 0.01)。

图9 免疫荧光染色法检测Nrf2 阳性细胞的表达Fig.9 Immunofluorescence staining detect the expression of Nrf2positive cell
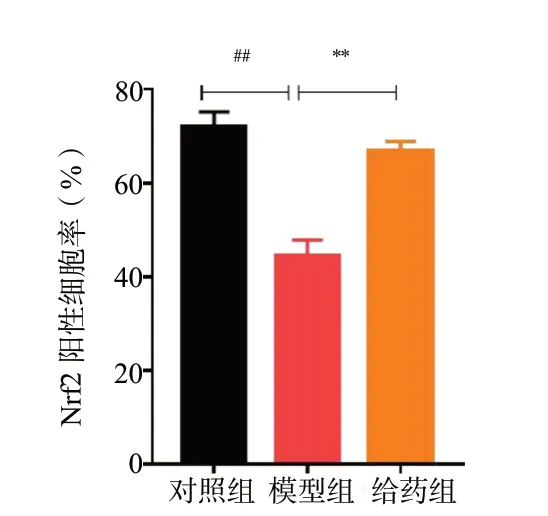
图10 Nrf2阳性细胞率统计图(n = 6)Fig.10 Statistical plot of Nrf2 positive cell rate(n = 6)
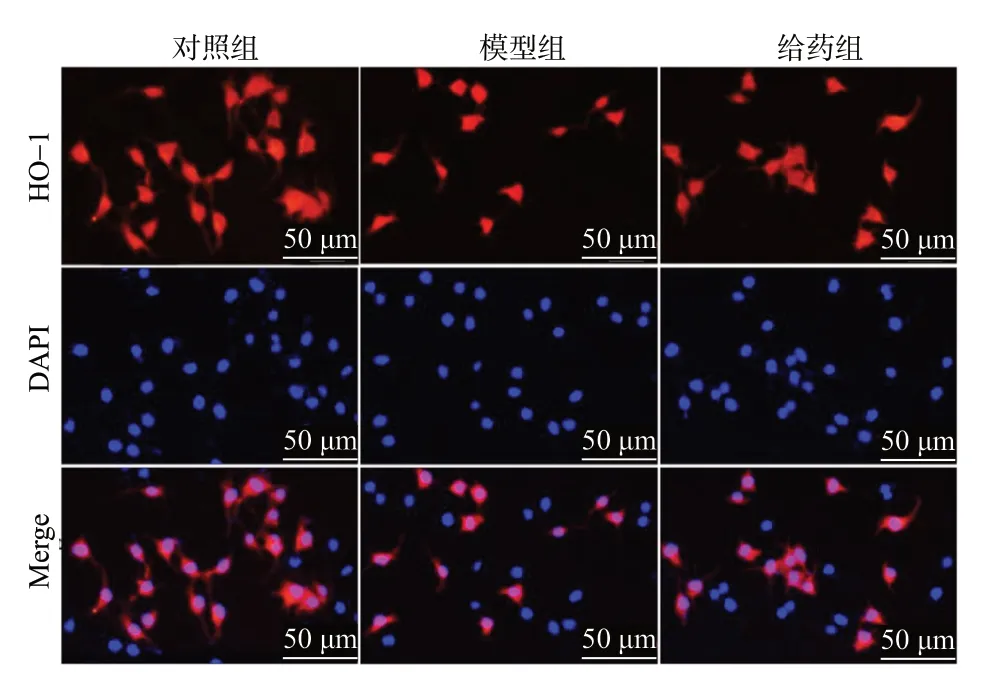
图11 免疫荧光染色法检测HO-1 的表达Fig.11 Immunofluorescence staining detect the expression of HO-1

图12 Rg1 对HO-1 阳性细胞率统计图(n = 6)Fig.12 Statistical plot of HO-1 positive cell rate(n = 6)
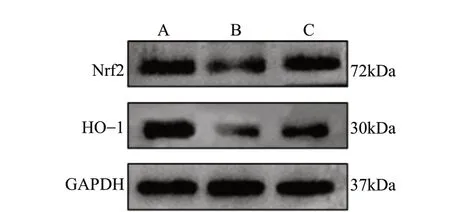
图13 Western Blot 条带图Fig.13 Western Blot strip plot

图14 Nrf2、HO-1 相对表达量的统计图(n = 3)Fig.14 Statistical plot of relative expression levels of Nrf2 and HO-1(n = 3)
3 讨论
由于目前AD 的发病机制尚未完全阐述清楚,使得AD 体外细胞模型的构建呈现多样性。众多研究表明,氧化应激参与AD 的病理过程,能够导致神经元凋亡并加速AD 的产生。H2O2是机体内常见的活性氧,被认为是神经元凋亡的启动剂,N2a 细胞具有神经干的特性,常被用于研究神经退行性疾病,因此本实验采用H2O2损伤N2a 建立氧化应激损伤模型。
文献报道显示,Rg1 对脑缺血和血管性痴呆大鼠的认知功能障碍具有明显改善作用,可以抑制海马CA1 区细胞凋亡[11],说明Rg1 具有良好的神经保护作用。实验结果证实,Rg1 能提升H2O2-N2a 细胞的存活率并降低其LDH 的释放量,具有明显的神经保护作用。
为明确Rg1 对H2O2-N2a 细胞氧化应激的影响,实验检测了MDA 的含量和SOD 的活性,发现模型组细胞的MDA 含量增高,SOD 活性降低,细胞抗氧化水平降低,而Rg1 可有效降低MDA 含量,增加抗氧化物的活性,使细胞氧化与抗氧化保持平衡,保护细胞免受氧化应激损伤。为了进一步探究其作用机制,通过Western Blot 及免疫荧光检测Nrf2 及其下游HO-1 蛋白的表达,发现Rg1 能够明显增加H2O2损伤后总Nrf2 及HO-1 的表达,表明Rg1 可以通过激活Nrf2/HO-1 信号通路抑制神经细胞的氧化应激反应。
4 结论
本实验通过H2O2诱导N2a 构建体外细胞氧化损伤模型,探讨Rg1 对AD 神经细胞的保护作用。研究证明Rg1 能通过激活Nrf2/HO-1 信号通路抑制H2O2-N2a细胞的氧化应激损伤,发挥神经保护作用。从机体氧化平衡角度出发,为Rg1 用于治疗AD 提供了实验基础。另外,Rg1 通过抑制神经细胞氧化应激损伤发挥抗AD 作用的结果仍有待利用动物模型进一步验证。

