接种乳酸菌发酵剂对风干肠成熟过程中微生物群落动态变化及感官品质的影响
陈援援 刘文秀 马凯华 杨华 马俪珍

摘 要:為研究乳酸菌发酵剂对风干肠成熟过程中微生物数量、微生物多样性及感官品质的影响,分别将SHI-59(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、PRO-MIX5(木糖葡萄球菌+清酒乳杆菌+类植物乳杆菌)复合型商业发酵剂接种到肉馅中,经过12 d的成熟过程生产发酵型风干肠,3 个接种组分别用SHI、WBL、PRO表示,以不接种作为对照组(control check,CK)。分别在成熟0、3、6、9、12 d取样,测定乳酸菌数、菌落总数、肠杆菌科数、假单胞菌数和葡萄球菌数变化,对成熟6、12 d的样品进行16S rDNA高通量测序分析,并对风干肠成品(成熟12 d)进行感官评定。结果表明:随着成熟过程的进行,样品乳酸菌数、菌落总数、肠杆菌科数、假单胞菌数和葡萄球菌数整体呈先升高后降低的变化趋势,SHI、WBL组的乳酸菌在肉馅中能够快速生长繁殖,WBL组能显著降低风干肠的菌落总数、肠杆菌科数和假单胞菌数(P<0.05),有利于提高风干肠的安全品质;SHI、WBL、PRO组风干肠的葡萄球菌数均显著高于CK组(P<0.05),这对风干肠的发色和风味的形成有积极影响;微生物多样性分析发现,风干肠在门水平主要有厚壁菌门、变形菌门和放线菌门,其中厚壁菌门为4 组风干肠的优势菌门,在WBL组中相对丰度最高,3 个接种组中乳杆菌属和漫游球菌属相对丰度大于CK组;质构特性分析和感官评定结果表明,乳酸菌发酵剂和复配发酵牛骨调味基料复合抗氧化剂协同作用能提高风干肠的感官品质,WBL组具有风干肠特有的风味,感官品质好。
关键词:乳酸菌发酵剂;风干肠;菌群结构;高通量测序;感官品质
Effects of Inoculating Lactic Acid Bacterial Starter Cultures on the Microbial Flora Dynamic Change and
Sensory Quality of Air-Dried Sausage during the Ripening Process
CHEN Yuanyuan1, LIU Wenxiu1, MA Kaihua1, YANG Hua2, MA Lizhen1,*
(1.College of Food Science and Biotechnology, Tianjin Agricultural University, Tianjin 300384, China;
2.Tianjin Key Laboratory of Agricultural Animal Breeding and Healthy Husbandry, College of Animal Science and
Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China)
Abstract: In order to study the effects of lactic acid bacterial (LAB) starter cultures on microbial quantity, microbial diversity and sensory quality during the ripening of air-dried sausage, three commercial mixed-strain starter cultures, namely SHI-59 (Staphylococcus xylose + Pediococcus pentosus + Lactobacillus plantarum), WBL-45 (Staphylococcus xylose + Staphylococcus carnosus + Lactobacillus sake), and PRO-MIX5 (Staphylococcus xylose + Lactobacillus sake +
Lactobacillus paraplantarum) were separately inoculated into ground meat and fermented for 12 days to produce air-dried sausage, and non-inoculated sausage was served as the control group. Samples were taken on days 0, 3, 6, 9 and 12 of ripening to determine the changes in LAB count, total viable count (TVC), Enterobacteriaceae, Pseudomonas and Staphylococcus counts. The samples on days 6 and 12 were analyzed by 16S rDNA high-throughput sequencing, and sensory evaluation was carried out on sausage on day 12. The results showed that LAB count, TVC, the numbers of Enterobacteriaceae, Pseudomonas and Staphylococcus increased first and then decreased with ripening time. SHI and WBL grew and multiplied rapidly in ground meat, and TVC, and the numbers of Enterobacteriaceae and Pseudomonas significantly decreased in the WBL group (P < 0.05), which was found to be beneficial to improve the safety and quality of air-dried sausage. The number of Staphylococcus in the SHI, WBL and PRO groups was significantly higher than that in the control group (P < 0.05), and the increase in Staphylococcus was found to have a positive effect on the formation of the color and flavor of sausages. The analysis of microbial diversity showed that air-dried sausages contained mainly Firmicutes, Proteobacteria and Actinomycetes at the phylum level, among which Firmicutes was the dominant phylum for the four groups, and that the relative abundance of Firmicutes was the highest in the WBL group. The relative abundance of Lactobacillus and Vogococcus in the three inoculated groups was higher than that in the control group. The results of texture analysis and sensory evaluation showed that the combination of LAB starter cultures and a blend of fermented bovine bone flavoring and antioxidants (FBFA) could synergistically improve the sensory quality of air-dried sausage. WBL fermented sausage had a unique flavor and good sensory quality.
Keywords: lactic acid bacterial starter culture; air-dried sausage; microbial flora; high-throughput sequencing; sensory quality
DOI:10.7506/rlyj1001-8123-20210827-208
中圖分类号:TS251.51 文献标志码:A 文章编号:1001-8123(2022)02-0001-08
引文格式:
陈援援, 刘文秀, 马凯华, 等. 接种乳酸菌发酵剂对风干肠成熟过程中微生物群落动态变化及感官品质的影响[J]. 肉类研究, 2022, 36(2): 1-8. DOI:10.7506/rlyj1001-8123-20210827-208. http://www.rlyj.net.cn
CHEN Yuanyuan, LIU Wenxiu, MA Kaihua, et al. Effects of inoculating lactic acid bacterial starter cultures on the microbial flora dynamic change and sensory quality of air-dried sausage during the ripening process[J]. Meat Research, 2022, 36(2): 1-8. DOI:10.7506/rlyj1001-8123-20210827-208. http://www.rlyj.net.cn
发酵和干燥是延长食品保质期最古老的方法,肉制品的传统发酵依赖于原料肉及当地环境中的微生物群落组成。然而,追求质量标准化和特定的有益微生物群落组成的高品质风干肠产品,则需要采用人工控制发酵技术进行生产[1]。目前,商业发酵剂,如植物乳杆菌已经取代了发酵过程中的天然微生物群落。有益菌发酵产生的乳酸促进了肉馅的酸化(pH 4.59~5.94),进而起到抑制致病菌和腐败菌生长繁殖的效果[2]。发酵肉微生物群落的动态变化与产品质量密切相关,特定发酵时间节点的微生物群落组成可作为评价发酵过程的指标[3]。高通量测序技术依据合成测序的原理,可以同时对几十万甚至数百万个DNA分子进行平行测序,使全面分析一个物种的整个基因组成为可能,能更真实反映样品中的菌群构成,因此,也被称为深度测序[4-6]。Wang Xiuhui等[7]采用高通量测序技术对萨拉米香肠、中国腊肠和烟熏香肠的细菌群落组成进行比较,发现中国腊肠和烟熏香肠的细菌群落组成与萨拉米香肠有很大的差异,细菌多样性比萨拉米香肠更丰富,在萨拉米香肠中,葡萄球菌属(Staphylococcus spp.)的操作分类单元最多,占97.45%,肠球菌属(Enterococcus spp.)占0.03%;中国干腌香肠和烟熏香肠中含有乳酸杆菌属(Lactobacillus spp.)、魏氏杆菌属(Weissella spp.)、片球菌属(Pediococcus spp.)和乳酸球菌属(Lactococcus spp.)等丰富的乳酸菌,但肠球菌属相对丰度分别为1.16%和2.99%,高于萨拉米香肠,这表明中式香肠的卫生质量还有待进一步提高,主要原因是由于中式香肠采用自然发酵而导致微生物群落不易控制。田建军[8]从内蒙古、新疆和西藏地区采集有代表性的传统发酵风干肉和接种发酵剂的人工调控发酵香肠进行微生物多样性分析,发现在人工调控发酵香肠中,仅有厚壁菌门(Firmicutes)为优势菌群,而自然发酵肉制品中的优势菌群有厚壁菌门、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)等,说明人工接种的发酵香肠安全品质高。Xiao Yaqing等[9]研究发现,单独接种植物乳杆菌R2或接种混合发酵剂植物乳杆菌R2和木糖葡萄球菌A2生产风干肠,可以增强肉馅体系中优势菌群的竞争力,抑制有害菌的生长,促进游离脂肪酸和游离氨基酸的释放,防止异味和酸败的形成。Li Chunsheng等[10]研究表明,分别接种戊糖乳杆菌30-7和30-15用于生产发酵罗非鱼香肠,能显著提高2 组香肠厚壁菌门的相对丰度,分别达94.62%和96.58%,明显高于自然发酵组(89.30%)。Zhang Yulong等[11]将弯曲乳杆菌LAB26和戊糖片球菌SWU73571稀释到107 CFU/mL,按体积比1∶1混合,制成酸肉发酵剂,生产酸肉。结果表明,与自然发酵相比,双菌发酵显著提高了酸肉的游离氨基酸含量,减少大肠菌群数量,降低亚硝酸盐、生物胺和丙二醛含量,提高了酸肉的品质和安全性。
提高肉制品安全品质的方法包括使用天然保鲜剂(如天然香辛料提取物、果蔬提取物、茶多酚提取物、乳酸链球菌素和美拉德反应产物等)、发酵技术和复配抑菌技术(多种抑菌剂协同使用时往往具有协同增效的作用,由于抑菌机理不同会减少单一防腐剂的使用量)。本研究在前期风干肠加工工艺和配料(添加具有防腐和抗氧化作用的外源添加物发酵牛骨调味基料和复合抗氧化剂(fermented bovine bone flavoring-antioxidant blend,FBFA))的基础上[12-14],人工接种3 种商业乳酸菌发酵剂,以不接种为对照组(control check,CK),通过测定成熟过程中乳酸菌数、菌落总数、肠杆菌科数、假单胞菌数和葡萄球菌数变化、16S rDNA高通量测序分析及感官评定,研究不同商业乳酸菌发酵剂对风干肠微生物特性及感官品质的影响,为提高风干肠的安全品质提供数据支持。
1 材料与方法
1.1 材料与试剂
冷却排酸成熟24 h的猪后腿肉、猪肥膘 天津二商迎宾肉类食品有限公司;食盐、白砂糖、曲酒、味精、酱油 天津市红旗农贸批发市场。
茶多酚、迷迭香 豫中生物科技有限公司;VE、异抗坏血酸钠 苏州佰亿鑫生物科技有限公司;SHI-59(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、PRO-MIX5(木糖葡萄球菌+清酒乳杆菌+类植物乳杆菌) 意大利萨科公司;人工胶原蛋白肠衣(牛二层皮提取、孔径30 mm) 神冠控股(集团)有限公司;MRS培养基、营养琼脂、结晶紫中性红胆盐葡萄糖琼脂(violet red bile agar,VRBA)、假单胞菌CFC选择性培养基、MSA培养基 青岛高科技工业园海博生物科技有限公司。
1.2 仪器与设备
SX-500高压蒸汽灭菌锅 日本Tomy有限公司;Climacell恒温恒湿箱、Friocell 22恒温恒湿培养箱 艾力特国际贸易有限公司;BVBJ-30F真空搅拌机 浙江嘉兴艾博实业有限公司;XZ-5L灌肠机 广州旭众食品机械有限公司;CLASS Ⅱ生物安全柜 天美(中國)科学仪器有限公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;JZ-4拍打式无菌均质器 天津歆毅翎科技有限公司。
1.3 方法
1.3.1 FBFA的制备
FBFA是由发酵牛骨调味基料(fermented beef flavorings,FBF)和复合抗氧化剂(compound antioxidants,CA)复配而成。FBF的制备参照樊晓盼等[15]的方法,其添加量为肉质量的2%,CA的添加量按照熊凤娇等[16]的方法,即茶多酚、迷迭香、VE和异抗坏血酸钠添加量(以原料肉质量计)分别为60.14、60.11、60.00、60.00 mg/kg。
1.3.2 风干肠的制作
1)腌制:将猪后腿瘦肉剔除筋膜、脂肪后,用绞肉机绞碎(筛板孔径8 mm),背膘用切丝机切成2 cm左右的丝条状,按照肥瘦比1∶9放入真空搅拌机中,加入肉总质量1.8%的食盐、0.01%的亚硝酸钠(事先用少量水溶解)和抗坏血酸钠0.055%,真空搅拌5 min,取出后放入不锈钢盆中,紧贴肉表面盖一层保鲜膜,于0~4 ℃冷库中腌制24 h;
2)拌馅:将腌制好的肉再次倒入真空搅拌机中,依次加入4%糖、1.5%曲酒、0.2%味精、0.3%生抽、10%水,乳酸菌发酵剂添加量为0.01%(按肉质量计,CK组不加),真空搅拌8 min;
3)灌肠:将制好的肉馅灌入胶原蛋白肠衣中,结扎(每节13~15 cm)、排气;
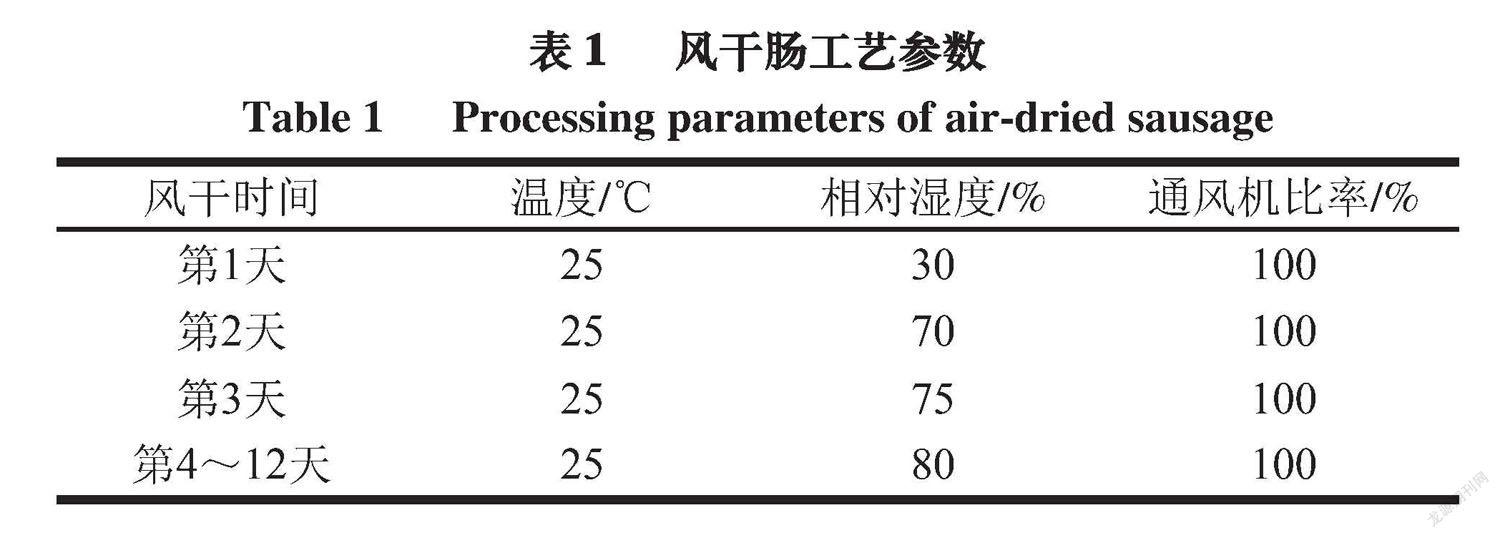
4)风干:将灌制好的肉肠放入恒温恒湿培养箱中风干12 d,恒温恒湿培养箱内的温度、相对湿度和风速参数如表1所示。
1.3.3 实验设计
设计4 组实验,拌馅时每组均加入FBFA,CK组不接种,其他3 组(SHI组、WBL组、PRO组)分别接种SHI-59、WBL-45、PRO-MIX5乳酸菌发酵剂(活菌数分别为1012、1011、1011 CFU/g),添加量为0.01%。分别在风干0、3、6、9、12 d取样测定样品的乳酸菌数、菌落总数、肠杆菌科数、假单胞菌数、葡萄球菌数;分析风干6、12 d的微生物多样性变化;对风干12 d终产品进行感官评定。
1.3.4 指标测定
1.3.4.1 乳酸菌数、菌落总数、肠杆菌科数、假单胞菌数、葡萄球菌数测定
在生物安全柜无菌操作,称取10 g样品放入无菌均质袋中,倒入90 mL无菌生理盐水,用无菌均质器拍打2 min,制成10 g/100 mL的样品匀浆液。吸取1 mL样品匀浆液进行10 倍梯度稀释,吸取相应稀释梯度的1 mL液体到无菌平皿中,每个稀释度做2 个平行,分别倒入MRS培养基、营养琼脂、VRBA、假单胞菌CFC选择性培养基、MSA培养基,在35 ℃培养箱中,肠杆菌培养24 h,其余菌培养48 h,对乳酸菌、菌落总数、肠杆菌科、假单胞菌、葡萄球菌进行计数。
1.3.4.2 微生物多样性分析
将4 组风干肠成品送到北京奥维森基因科技有限公司,采用扩增子测序方法分析样品16S rDNA 的V3~V4区段、细菌群落结构等,对样品进行细菌多样性分析[17],扩增区段引物序列为:ACTCCTACGGGAGGCAGCAG、GTGGACTACHVGGGTWTCTAAT。
1.3.4.3 感官评定
将风干12 d的4 组风干肠样品做好标记,放入沸水中煮制15 min,切成约3 mm左右的薄片,随机编号放入样品盘中,由本实验室经过感官培训的10 名人员组成感官评定小组进行感官评分,评分标准如表2所示。
1.4 数据处理
采用Microsoft Excel 2010软件计算平均值和标准差,用SPSS 19.0软件进行显著性分析,Origin 2018软件作图。
2 结果与分析
2.1 乳酸菌发酵剂对风干肠成熟过程中微生物变化的影响
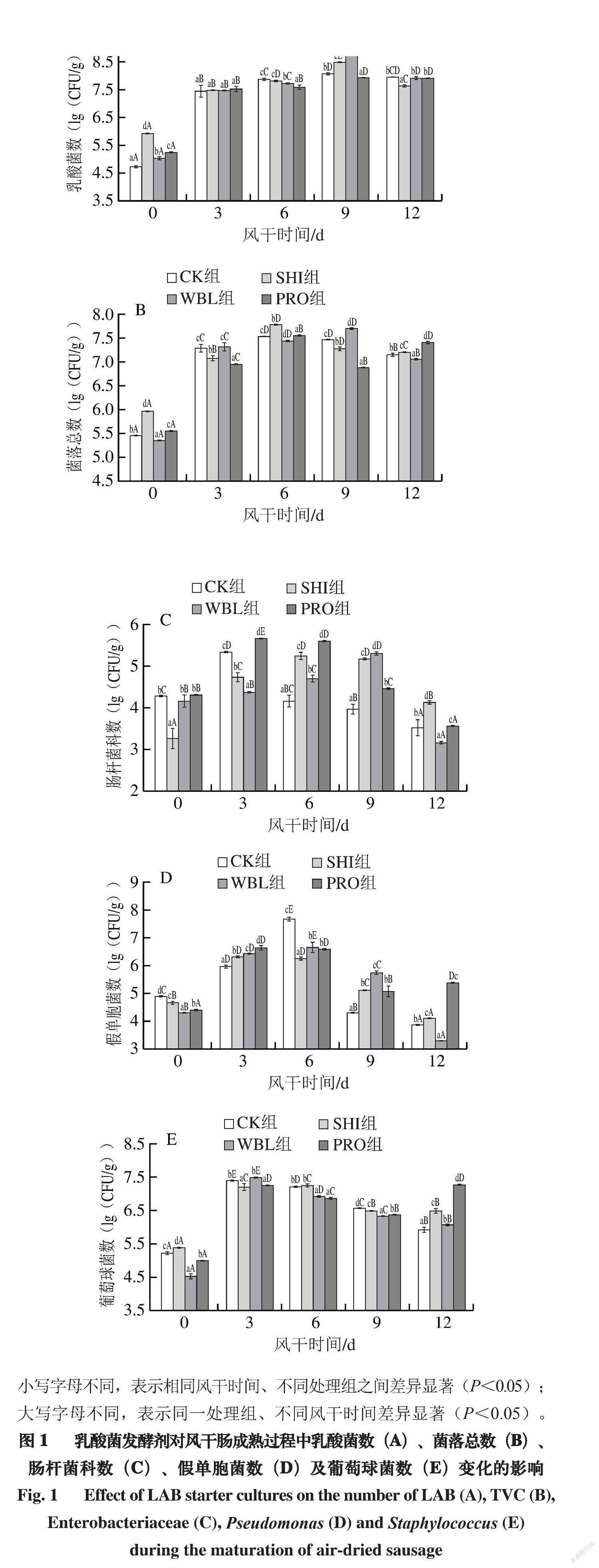
小写字母不同,表示相同风干时间、不同处理组之间差异显著(P<0.05);大写字母不同,表示同一处理组、不同风干时间差异显著(P<0.05)。
由图1A可知,在风干0 d时,SHI组的乳酸菌数显著高于CK、WBL、PRO组(P<0.05),说明SHI-59的初始活力较高。风干3 d时,4 组风干肠的乳酸菌数达到7.48~7.53(lg(CFU/g))。大量研究表明,充足的乳酸菌(通常高于7(lg(CFU/g)))有利于在发酵初期控制肉馅中致病菌、腐败菌的繁殖,提高发酵肉制品的安全性[18]。风干9 d时,4 组风干肠的乳酸菌数达到最大值(7.93~8.73(lg(CFU/g))),其菌数高低顺序依次为WBL组>SHI组>CK组>PRO组,说明WBL-45、SHI-59商业复合菌能很好地适应该肉馅体系并快速生长繁殖。风干12 d(终点)时,WBL、SHI组的乳酸菌数分别快速降低至7.91、7.65(lg(CFU/g)),这是因为SHI、WBL组的乳酸菌能快速繁殖产生乳酸,使肉馅的pH值降到接近蛋白质的等电点5.4,肌原纤维蛋白的收缩、变性或降解,肌肉蛋白持水力减弱,使肉馅中的水分散失。由于自由水和可利用碳水化合物的缺乏,不利于乳酸菌的生长繁殖[19]。而CK、PRO组的乳酸菌数下降缓慢,且与风干9 d时的乳酸菌数差异不显著。
由图1B、C、D可知,CK、SHI、WBL、PRO组的菌落总数、肠杆菌科数、假单胞菌数随风干时间的延长呈先升高后缓慢降低的趋势。4 组风干肠由于接种的乳酸菌种类不同,在风干过程中腐败微生物变化规律不同。到风干终点时,4 组风干肠菌落总数从高到底依次为:PRO组>SHI组>CK组>WBL组,肠杆菌科数从高到底依次为:SHI组>PRO组>CK组>WBL组,假单胞菌数从高到低依次为:PRO组>SHI组>CK组>WBL组。可以看出,WBL组的菌落总数、肠杆菌科数、假单胞菌数显著低于SHI、PRO和CK组(P<0.05),说明接种WBL-45
商业发酵剂对腐败微生物有较好的抑制作用,有利于提高风干肠的安全品质。但SHI和PRO组的菌落总数、肠杆菌科数和假单胞菌数显著高于CK组(P<0.05),可能归因于FBFA与3 种商业发酵剂复配会不同程度影响发酵剂菌株的活力和肉馅体系土著微生物间的群体感应,此外,接种的SHI-59和WBL-45商业发酵剂分别含有2 种乳酸菌,菌株间存在相互竞争作用,影响彼此的代谢,进而改变肉馅体系的菌相。另一方面,由于商业发酵剂的适宜生长温度为30~40 ℃,而本次风干工艺完全按照传统哈尔滨风干肠的干制条件,将温度控制在(25±2) ℃,而25 ℃恰巧是低温嗜冷菌假单胞菌的最适宜生长温度,由于接种的乳酸菌没能在短时间内快速生长繁殖成为优势菌,因而对假单胞菌和肠杆菌科等腐败微生物的抑制效果不佳;此外CK组具有土著的优势乳酸菌菌株,它作为典型的微生物发酵剂能更快地适应特殊的内部环境,具有良好的发酵性能[20]。
由图1E可知,SHI组的初始葡萄球菌数显著高于CK、WBL、PRO组(P<0.05),可能是由于SHI-59中的葡萄球菌能较好适应该肉馅体系。在风干3 d时,CK、WBL、PRO组的葡萄球菌数分别增加到最大值7.40、7.49、7.26(lg(CFU/g)),SHI组在风干6 d时葡萄球菌数增加到最大值7.25(lg(CFU/g))。随着风干时间的延长,4 组风干肠的葡萄球菌数开始缓慢降低,风干结束时(12 d),CK、SHI、WBL组分别降至5.93、6.50、6.08(lg(CFU/g))。PRO组在风干9 d时葡萄球菌数降到最低的6.38(lg(CFU/g)),到风干结束时又增加到7.27(lg(CFU/g))。SHI组、WBL组风干9 d时的葡萄球菌数显著低于CK组,而乳酸菌数显著高于CK组,二者变化趋势相反,可能是风干9 d时,SHI、WBL组乳酸菌的酸化能力较强,强酸化体系会抑制发酵香肠中pH值敏感的木糖葡萄球菌的生长[21-23]。到风干终点时,风干肠中的蛋白质被乳酸菌分解成碱性的氨基酸、生物胺和小分子风味物质等,使风干肠的pH值升高,进而使PRO组的葡萄球菌数升高。凝固酶阴性葡萄球菌具有发色和促进风味形成的作用[24],风干终点时接菌组葡萄球菌数均显著高于CK组(P<0.05),这可能也是接菌组风干肠的红度值比CK组高的原因。
2.2 乳酸菌发酵剂对风干肠成熟过程中微生物多样性指数的影响
由表3可知,所有样品的覆盖率均在99%以上,说明测序深度足以达到细菌菌群多样性的分析[25]。与风干6 d相比,风干12 d时CK、SHI组的菌群丰富度指数(Chao1、Observed_species)和菌群多样性指数(PD_whole_tree、Shannon、Simpson)呈现降低趋势;WBL组的Chao1指数有升高趋势,菌群多样性指数(PD_whole_tree、Shannon)降低;PRO组的菌群丰富度指数呈现升高趋势,该结果与图1的微生物菌落总数变化趋势一致。到风干12 d时,PRO组PD_whole_tree、Shannon指数明显高于CK、SHI、WBL组,且4 组风干肠的Shannon、Simpson指数大小关系为PRO组>SHI组>WBL组>CK组,说明接种组的菌群多样性高于CK组,其中PRO组的菌群多样性最丰富,细菌群落组成的变化主要是由原料、发酵剂种类、发酵温度、相对湿度和工艺环境的差异引起的[26],乳酸菌发酵剂能合成多种代谢产物,这在它们与其他微生物相互作用的背景下是非常重要的,细菌素和其他抗菌因子的产生,如乳酸的积累,可能是在混合发酵中获得稳定菌群的良好屏障[27],它们能杀灭腐败或致病微生物。
2.3 风干肠成熟6、12 d时基于门水平微生物群落结构动态变化
由图2可知,在门水平上鉴定出相对丰度大于1%的有3 个门,厚壁菌门是风干肠中基于门水平的优势菌群,其相对丰度占61%以上,其次是变形菌门和放线菌门(Actinobacteria),这与田建军[8]研究的接种发酵剂的人工调控发酵香肠鉴定出厚壁菌门为优势菌群结果一致。Haberman等[28]研究表明,革兰氏染色反应呈阳性的厚壁菌门是人类肠道的优势有益菌。厚壁菌门是CK、SHI、WBL、PRO組的优势菌群,风干12 d时4 组风干肠厚壁菌门的相对丰度分别为73.12%、69.41%、77.96%、68.91%,其中WBL组的厚壁菌门相对丰度最高;风干6 d时,CK、SHI、WBL、PRO组变形菌门的相对丰度分别为25.72%、31.64%、25.14%、36.62%,到风干12 d时依次降低为24.62%、28.99%、19.93%、29.14%,这可能是受发酵环境(低pH值)的影响,在发酵过程中一些腐败微生物被抑制,使细菌群落丰度持续降低[29],变形菌门在WBL组成品中相对丰度最低,说明接种WBL-45商业复合菌增强了优势菌的竞争能力,抑制了有害菌变形菌门的生长;放线菌门相对丰度在CK、SHI、WBL组中随着风干的进行呈降低趋势,在PRO组中为升高趋势,风干12 d时依次为1.10%、0.70%、0.82%、0.87%,放线菌门在CK组相对丰度最高,其次是PRO、WBL、SHI组,说明接种不同的乳酸菌发酵剂能改变风干肠在门水平的微生物群落结构。
2.4 風干肠成熟6、12 d时基于属水平的微生物群落结构动态变化
风干12 d时,在属水平上注释到的物种有186 种,其中相对丰度大于1%的有15 种,即乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)、弧菌属(Vibrio)、漫游球菌属(Vagococcus)、发光细菌属(Photobacterium)、变形杆菌属(Proteus)、肠球菌属(Enterococcus)、沙雷氏菌属(Serratia)、耶尔森氏菌属(Yersinia)、片球菌属(Pediococcus)、消化链球菌属(Peptostreptococcus)、魏斯氏菌属(Weissella)、普罗威登菌属(Providencia)、巨型球菌属(Macrococcus)和嗜胨菌属(Peptoniphilus),如图3所示。其中弧菌属、发光细菌属、变形杆菌属、沙雷氏菌属、耶尔森氏菌属和普罗威登菌属为革兰氏阴性菌,属于变形菌门,其余9 个属为厚壁菌门,大量研究表明变形菌门包括很多腐败菌[30]。
由图3可知,与风干6 d相比,风干12 d时,变形菌门的6 个腐败菌属的菌群总相对丰度呈不同程度的降低趋势,在4 组风干肠中相对丰度大小依次为:WBL组(14.91%)CK组(70.66%)>SHI组(63.49%)>PRO组(50.19%),可以看出WBL组乳杆菌目微生物相对丰度为组内最大,腐败微生物属相对丰度最小,说明WBL-45发酵剂在该肉馅体系中具有良好的适应性,使接种的乳酸菌占微生物区系的主导地位,能较好地抑制腐败微生物的生长,适合与FBFA复配用于生产风干肠。乳球菌属相对丰度在4 组风干肠中均随风干时间的延长而呈增加趋势,大量研究表明,乳球菌属具有产生细菌素的能力,能够抑制肉制品中许多革兰氏阳性食源性病原体,如梭状芽孢杆菌、芽孢杆菌和链球菌[31];在风干终点时,SHI、WBL和PRO组乳杆菌属和漫游球菌属相对丰度高于CK组,这是因为SHI、WBL、PRO 3 组商业发酵剂中均含有乳杆菌,特别是PRO-MIX5商业发酵剂中含有2 种乳杆菌(清酒乳杆菌和类植物乳杆菌),所以PRO组中乳杆菌属相对丰度最大(20.71%)。Wang Xiuhui等[7]在中国干腌香肠中检测到大量的乳杆菌属,乳杆菌因发酵碳水化合物产生乳酸和醋酸,提高风干肠风味,在发酵过程中起着重要作用[32]。
2.5 风干肠感官评定结果
由图4可知,WBL、SHI、PRO组风干肠在风味、酸败味、酸味、回味、咀嚼性、颜色、嫩度、总体可接受性方面均优于CK组,说明接种乳酸菌发酵剂能提高风干肠的感官品质,与黄俊逸等[33]的研究结果一致。大多数感官评定员一致认为,WBL组具有风干肠特有的风味、无酸败味、酸味适宜、回味较强、咀嚼性好、嫩度佳、具有风干肠特有的红色、整体可接受性高,这可能是接种的乳酸菌和葡萄球菌共同作用的结果。研究表明,一些乳杆菌属具有脂解和蛋白水解活性,这有利于香肠风味的形成[34-35]。Hu Yingying等[36]研究发现,混和菌株戊糖片球菌、木糖葡萄球菌、弯曲乳杆菌发酵的风干肠可以提高红度值和形成更多的醛类、酮类、醇类、酸类和酯类等风味物质。
3 结 论
研究不同商业复合乳酸菌发酵剂与FBFA协同作用对风干肠微生物及感官品质的影响。结果表明,随着风干过程的进行,样品乳酸菌数、菌落总数、肠杆菌科数、假单胞菌数和葡萄球菌数呈先升高后降低的变化趋势,SHI-59、WBL-45商业复合菌能较好适应肉馅体系,生长繁殖速度快,到风干终点时,WBL组能明显降低风干肠的菌落总数、肠杆菌科数和假单胞菌数(P<0.05),提高风干肠的安全品质,接菌组风干肠的葡萄球菌数显著高于CK组,这有利于风干肠的发色和风味的形成。微生物多样性分析发现,4 组风干肠在门水平的优势菌群是厚壁菌门,在WBL组中的相对丰度最高。SHI、WBL、PRO组中乳杆菌属和漫游球菌属相对丰度大于CK组。感官评定结果表明,商业复合乳酸菌发酵剂PRO-MIX5、SHI-59、WBL-49与FBFA协同作用能提高风干肠的感官品质,WBL组具有风干肠特有的风味,整体可接受性高。
参考文献:
[1] ZHAO Lihua, JIN Ye, MA Changwei, et al. Physico-chemical characteristics and free fatty acid composition of dry fermented mutton sausages as affected by the use of various combinations of starter cultures and spices[J]. Meat Science, 2011, 88(4): 761-766. DOI:10.1016/j.meatsci.2011.03.010.
[2] ARO J M A, NYAM-OSOR P, TSUJI K, et al. The effect of starter cultures on proteolytic changes and amino acid content in fermented sausages[J]. Food Chemistry, 2010, 119(1): 279-285. DOI:10.1016/j.foodchem.2009.06.025.
[3] LI Jing, LI Caichan, LI Shengjie, et al. Effects of temperature on microbial succession and quality of sour meat during fermentation[J]. LWT-Food Science and Technology, 2019, 114: 108391. DOI:10.1016/j.lwt.2019.108391.
[4] LOGARES R, SUNAGAWA S, SALAZAR G, et al. Metagenomic 16S rDNA Illumina tags are a powerful alter native to amplicon sequencing to explore diversity and structure of microbial communities[J]. Environmental Microbiology, 2014, 16(9): 2659-2667. DOI:10.1111/1462-2920.12250.
[5] SULTAN M, SCHULZ M H, RICHARD H, et al. A global view of gene activity and alternative splicing by deep sequencing of the human transcriptome[J]. Science, 2008, 321: 956-960. DOI:10.1126/science.1160342.
[6] L? Xiao, WANG Qian, GE Xueling, et al. Application of high-throughput gene sequencing in lymphoma[J]. Experimental and Molecular Pathology, 2021, 119: 104606. DOI:10.1016/j.yexmp.2021.104606.
[7] WANG Xiuhui, ZHANG Yalin, REN Hongyang, et al. Comparison of bacterial diversity profiles and microbial safety assessment of salami, Chinese dry-cured sausage and Chinese smoked-cured sausage by high-throughput sequencing[J]. LWT-Food Science and Technology, 2018, 90: 108-115. DOI:10.1016/j.lwt.2017.12.011.
[8] 田建军. 传统发酵肉制品中微生物多样性、功能乳酸菌代谢产物及基因序列分析[D]. 呼和浩特: 内蒙古农业大学, 2019.
[9] XIAO Yaqing, LIU Yingnan, CHEN Conggui, et al. Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J]. Food Research International, 2020, 135: 109247. DOI:10.1016/j.foodres.2020.109247.
[10] LI Chunsheng, ZHAO Yue, WANG Yueqi, et al. Microbial community changes induced by Pediococcus pentosaceus improve the physicochemical properties and safety in fermented tilapia sausage[J]. Food Research International, 2021, 147: 110476. DOI:10.1016/j.foodres.2021.110476.
[11] ZHANG Yulong, HU Ping, XIE Yaoyao, et al. Co-fermentation with Lactobacillus curvatus LAB26 and Pediococcus pentosaceus SWU73571 for improving quality and safety of sour meat[J]. Meat Science, 2020, 170: 108240. DOI:10.1016/j.meatsci.2020.108240.
[12] 陈援援, 于德阳, 秦建鹏, 等. 外源抑制物对风干肠微生物群落组成变化的影响[J]. 食品工业科技, 2021, 42(7): 145-149. DOI:10.13386/j.issn1002-0306.2020090228.
[13] 陈援援, 于德阳, 秦建鹏, 等. 外源抑制物对风干肠风味变化的影响[J]. 食品工业科技, 2021, 42(4): 215-225; 231. DOI:10.13386/j.issn1002-0306.2020040146.
[14] 陈援援, 马凯华, 李璐, 等. 外源抑制物对风干肠风干过程中理化性质及安全品质的影响[J]. 肉类研究, 2020, 34(6): 14-20. DOI:10.7506/rlyj1001-8123-20200214-036.
[15] 樊曉盼, 施煜, 刘一鸣, 等. 天然牛肉调味基料的增稠工艺优化[J]. 食品研究与开发, 2019, 40(14): 81-85. DOI:10.3969/j.issn.1005-6521.2019.14.014.
[16] 熊凤娇, 马俪珍, 王洋. 二次回归正交设计优选阻断NDMA形成的亚硝化抑制剂[J]. 肉类研究, 2018, 32(6): 29-34. DOI:10.7506/rlyj1001-8123-201806006.
[17] 朱迎春, 王洋, 樊曉盼, 等. 基于宏基因组学技术分析不同贮藏条件下鲶鱼片中的菌相变化[J]. 中国农业科学, 2017, 50(5): 913-923. DOI:10.3864/j.issn.0578-1752.2017.05.014.
[18] CENCI-GOGA B T, RANUCCI D, MIRAGLIA D, et al. Use of starter cultures of dairy origin in the production of Salame nostrano, an Italy dry-cured sausage[J]. Meat Science, 2008, 78(4): 381-390. DOI:10.1016/j.meatsci.2007.07.001.
[19] HU Yingying, ZHANG Lang, ZHANG Hua, et al. Physicochemical properties and flavour profile of fermented dry sausages with a reduction of sodium chloride[J]. LWT-Food Science and Technology, 2020, 124: 109061. DOI:10.1016/j.lwt.2020.109061.
[20] SPERANZA B, BEVILACQUA A, CORBO M R, et al. A possible approac to assess acidification of meat starter cultures: a case study from some wild strains of Lactobacillus plantarum[J]. Journal of the Science of Food and Agriculture, 2017, 97(9): 2961-2968. DOI:10.1002/jsfa.8135.
[21] RAVYTS F, STEEN L, GOEMAERE, et al. The application of staphylococci with flavour-generating potential is affected by acidifification in fermented dry sausages[J]. Food Microbiology, 2010, 27(7): 945-954. DOI:10.1016/j.fm.2010.05.030.
[22] STAVROPOULOU D A, DE MAERE H, BERARDO A, et al. Species pervasiveness within the group of coagulase-negative staphylococci associated with meat fermentation is modulated by pH[J]. Frontiers in Microbiology, 2018, 9: 2232. DOI:10.3389/fmicb.2018.02232.
[23] STAVROPOULOU D A, DE MAERE H, BERARDO A, et al. Pervasiveness of Staphylococcus carnosus over Staphylococcus xylosus is affected by the level of acidifification within a conventional meat starter culture set-up[J]. International Journal of Food Microbiology, 2018, 674: 60-66. DOI:10.1016/j.ijfoodmicro.2018.03.006.
[24] SUN Jian, CAO Chenchen, FENG Meiqin, et al. Technological and safety characterization of coagulase-negative staphylococci with high protease activity isolated from traditional Chinese fermented sausages[J]. LWT-Food Science and Technology, 2019, 114: 108371. DOI:10.1016/j.lwt.2019.108371.
[25] SUN Xiaohui, HONG Hui, JIA Shiliang, et al. Effects of phytic acid and lysozyme on microbial composition and quality of grass carp (Ctenopharyngodon idellus) fillets stored at 4 ℃[J]. Food Microbiology, 2020, 86: 23-32. DOI:10.1016/j.fm.2019.103313.
[26] QUIJADA N M, DE FILIPPIS F, SANZ J J, et al. Different Lactobacillus populations dominate in “Chorizo de León” manufacturing performed in different production plants[J]. Food Microbiology, 2018, 70: 94-102. DOI:10.1016/j.fm.2017.09.009.
[27] GARC?A C, RENDUELES M, D?AZ M. Microbial amensalism in Lactobacillus casei and Pseudomonas taetrolens mixed culture[J]. Bioprocess and Biosystems Engineering, 2017, 40(7): 1111-1122. DOI:10.1007/s00449-017-1773-3.
[28] HABERMAN Y, TICKLE T L, DEXHEIMER P J, et al. Pediatric Crohn disease patients exhibit specific ileal transcriptome and microbiome signature[J]. Journal of Clinical Investigation, 2014, 124(38): 3617-3633. DOI:10.1172/JCI75436.
[29] HU Yingying, WANG Hui, KONG Baohua, et al. The succession and correlation of the bacterial community and flavour characteristics of Harbin dry sausages during fermentation[J]. LWT-Food Science and Technology, 2021, 138(1): 110689. DOI:10.1016/j.lwt.2020.110689.
[30] 盧烽, 刘凤娇, 胡小松, 等. 葡萄多酚改善高脂饮食诱导的小鼠高血脂及对肠道菌群的调节作用[J]. 中国食品学报, 2021, 21(7): 97-106. DOI:10.16429/j.1009-7848.2021.07.012.
[31] 王舒叆, 王子元, 张敏. 不同抑菌剂对青稞鲜湿面中蜡样芽孢杆菌的抑制作用[J]. 食品科学, 2020, 41(13): 206-211. DOI:10.7506/spkx1002-6630-20190623-271.
[32] DROSINIS E H, PARAMITHIOTIS S, KOLOVOS G, et al. Phenotypic and technological diversity of lactic acid bacteria and staphylococci isolated from traditionally fermented sausages in Southern Greece[J]. Food Microbiology, 2007, 24(3): 260-270. DOI:10.1016/j.fm.2006.05.001.
[33] 黄俊逸, 王凤娜, 吴香, 等. 复合发酵剂的筛选及其对发酵香肠加工过程中品质的影响[J]. 食品科学, 2020, 41(24): 95-101. DOI:10.7506/spkx1002-6630-20191023-241.
[34] EDUARDO D, FUNCK G D, HAUBERT L, et al. Selection of native bacterial starter culture in the production of fermented meat sausages: application potential, safety aspects, and emerging technologies[J]. Food Research International, 2019, 122: 371-382. DOI:10.1016/j.foodres.2019.04.018.
[35] SIDIRA M, KANDYLIS P, KANELLAKI M, et al. Effect of immobilized Lactobacillus casei on volatile compounds of heat treated probiotic dry-fermented sausages[J]. Food Chemistry, 2015, 178: 201-207. DOI:10.1016/j.foodchem.2015.01.068.
[36] HU Yingying, CHEN Qian, WEN Rongxin, et al. Quality characteristics and flavor profile of Harbin dry sausages inoculated with lactic acid bacteria and Staphylococcus xylosus[J]. LWT-Food Science and Technology, 2019, 114: 108392. DOI:10.1016/j.lwt.2019.108392.
收稿日期:2021-08-27
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0401500)
第一作者简介:陈援援(1995—)(ORCID: 0000-0002-3601-7117),女,硕士研究生,研究方向为肉制品安全控制。
E-mail: 1041492856@qq.com
通信作者简介:马俪珍(1963—)(ORCID: 0000-0003-2744-7171),女,教授,博士,研究方向为肉品科学与技术。
E-mail: malizhen-6329@163.com

