磷酸盐-大豆分离蛋白联合处理对草鱼肌原纤维蛋白凝胶化的影响
张钰嘉 万杨卓群 石尚轩 周圣岚 郭金鑫 朱杰


摘 要:為探讨磷酸盐(三聚磷酸钠、六偏磷酸钠、焦磷酸钠(tetrasodium pyrophosphate,TSPP))和大豆分离蛋白(soy protein isolate,SPI)对草鱼肌原纤维蛋白凝胶化的影响,采用热处理方法,将不同质量浓度的磷酸盐、SPI与草鱼肌原纤维蛋白混合制成凝胶。用黏度、嫩度、持水性、显微结构和粗糙度表征凝胶特性。结果表明:磷酸盐可促进蛋白与水的相互作用,有利于蛋白形成稳定、有序的交联网络并保存水分;SPI增大了蛋白间的交联程度,促进凝胶保水能力,提高蛋白凝胶体系的稳定性;磷酸盐、SPI的加入显著提高了凝胶品质,TSPP-SPI联合处理组较其他处理组具有更好的持水性(P<0.05)、嫩度(P<0.05)及适中的黏度(P<0.05),其中,当采用1.2 g/100 mL TSPP、5 g/100 mL SPI体积比1∶3处理时,凝胶具有嫩度大(P<0.05)、持水性好(P<0.05)、黏性适中(P<0.05)、粗糙度小(P<0.05)等特点,该处理方式能够显著提高草鱼肌原纤维蛋白凝胶特性。
关键词:三聚磷酸钠;偏磷酸钠;焦磷酸钠;大豆分离蛋白;草鱼肌原纤维蛋白;凝胶
Effects of Combined Treatment of Phosphates and Soybean Protein Isolate on the Gelation Properties of
Myofibrillar Proteins from Grass Carp
ZHANG Yujia, WAN Yangzhuoqun, SHI Shangxuan, ZHOU Shenglan, GUO Jinxin, ZHU Jie*
(Institute of Biophysics, College of Science, Northwest A&F University, Yangling 712100, China)
Abstract: In order to explore the effects of phosphate (sodium tripolyphosphate, sodium hexametaphosphate, tetrasodium pyrophosphate) and soy protein isolate (SPI) on the gelation properties of grass carp myofibrillar protein (MP), heat-induced gels were prepared from MP with different concentrations of phosphate and 5 g/100 mL soy protein isolate (SPI) added, and their viscosity, tenderness, water-holding capacity (WHC), microstructure and roughness were evaluated. The results showed that phosphate promoted the interaction between protein and water, thus facilitated the formation of stable and ordered cross-linked network and preserved moisture. SPI increased the degree of crosslinking between proteins, promoted gel WHC, and improved the stability of the gel system. The addition of phosphates and SPI significantly improved gel quality. Compared to the other treatments, sodium pyrophosphate-SPI treatment showed better gel WHC (P < 0.05) and tenderness (P < 0.05) as well as medium viscosity (P < 0.05). The gel added with a mixture of 1.2 g/100 mL sodium hypophosphate and
5 g/100 mL SPI at a volume ratio of 1:3 was characterized by high tenderness (P < 0.05), good WHC (P < 0.05), medium viscosity (P < 0.05), and small roughness (P < 0.05) indicating that this treatment could significantly improve the gel properties of MP from grass carp.
Keywords: sodium tripolyphosphate; sodium hexametaphosphate; tetrasodium pyrophosphate; soybean protein isolate; myofibrillar protein from grass carp; gelation
DOI:10.7506/rlyj1001-8123-20210527-157
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2022)02-0021-06
引文格式:
张钰嘉, 万杨卓群, 石尚轩, 等. 磷酸盐-大豆分离蛋白联合处理对草鱼肌原纤维蛋白凝胶化的影响[J]. 肉类研究, 2022, 36(2): 21-26. DOI:10.7506/rlyj1001-8123-20210527-157. http://www.rlyj.net.cn
ZHANG Yujia, WAN Yangzhuoqun, SHI Shangxuan, et al. Effects of combined treatment of phosphates and soybean protein isolate on the gelation properties of myofibrillar proteins from grass carp[J]. Meat Research, 2022, 36(2): 21-26. DOI:10.7506/rlyj1001-8123-20210527-157. http://www.rlyj.net.cn
随着生活水平的提高,人们对深加工水产品(鱼糜产品)的需求也逐年升高[1]。在我国,草鱼属于大宗淡水鱼类,因养殖量巨大且价格低廉,已成为鱼糜制品的主要加工原料之一。肌原纤维蛋白占总肌肉蛋白的55%~65%,不仅作为鱼糜制品的主要营养成分之一,也在生产加工中起着胶凝剂的作用,主要影响肉制品的质构特性和持水能力[2-4]。因此,如何改善肌原纤维蛋白凝胶化已成为鱼糜制品工业关注的热点问题。
磷酸盐和大豆分离蛋白(soy protein isolate,SPI)作为优良的食品添加剂,在鱼糜制品生产加工中起着重要作用。相关研究显示,高钠盐摄入与高血压等心血管疾病直接相关[5-7]。多聚磷酸盐可作为钠盐的替代物,是常见的食品添加剂[8-9],可以显著提高肌球蛋白的黏结性,进而提高蛋白凝胶特性并显著改善肉制品的功能特性[10]。
另外,植物性蛋白(豆类蛋白)被认为是提高肉制品质量和营养价值的潜在替代品[11-13]。SPI的加入可有效改善肉制品的组织结构和乳化性状。相关研究显示,添加SPI后,复合蛋白的持水性、乳化活性/稳定性和硬度均显著高于纯肌原纤维蛋白,且添加量越大,增强效果越显著[14]。
但是,磷酸盐和SPI在作为食品品质改良剂时也同样存在缺点:添加过多磷酸盐会降低肉制品的食用品质,甚至还会危害人体健康[15-16];SPI的变性温度远高于普通肉制品加热的最高温度,使其在加热过程中不能与肌原纤维蛋白充分相互作用[17-18]。本研究拟探讨磷酸盐-SPI联合处理对草鱼肌原纤维蛋白凝胶化的影响,以兼顾二者在优化鱼糜产品凝胶特性中的优势作用。
1 材料与方法
1.1 材料与试剂
于杨凌农业高新技术产业示范区康乐市场选取个体质量为(1.0±0.1) kg、生存状态相近的草鱼15 条,宰后30 min内直接用于肌原纤维蛋白提取,或经液氮速冻后保存于(-80.0±2.0) ℃超低温冰箱,备用。SPI、考马斯亮蓝 北京索莱宝科技有限公司;氯化钠、偏磷酸钠(sodium hexametaphosphate,SHMP) 广东光华科技股份有限公司;焦磷酸钠(tetrasodium pyrophosphate,TSPP) 天津博迪化工股份有限公司;三聚磷酸钠(sodium tripolyphosphate,STPP) 成都科龙化工试剂厂;三羟甲基氨基甲烷盐酸盐(Tris-hydrochloride,Tris-HCl) 美国Sigma公司;所有试剂均为分析纯。
1.2 仪器与设备
KDC-160HR高速冷冻离心机 安徽科大中佳公司;MSC-100恒温振荡金属浴 杭州奥盛仪器有限公司;Multimode-8原子力显微镜 美国Bruker公司;FE20酸度计 瑞士梅特勒-托利多仪器公司;DS-1高速组织捣碎机 上海标本模型厂;C-LM4肌肉嫩度仪 北京天域飞翔公司;NDJ-79A旋转黏度计 上海昌吉地质仪器公司。
1.3 方法
1.3.1 草鱼肌原纤维蛋白复合凝胶制备
参考曾淑薇[19]、张登科[20]等的方法经细微调整后提取草鱼肌原纤维蛋白,使用预冷试剂及冰浴,以保证全程于4 ℃条件下进行。新鲜草鱼经搅碎成鱼糜后与5 倍体积的低盐缓冲液(0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5)均匀混合,8 000×g离心10 min后,用去离子水漂洗3 次;然后用4 倍体积高盐缓冲液(0.45 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5)在4 ℃条件下浸提22 h,4 层纱布过滤,8 000×g离心15 min,沉淀即为草鱼肌原纤维蛋白。用考马斯亮蓝法测定蛋白质量浓度,并用生理盐水稀释至1 mg/mL。取1 mg/mL草鱼肌原纤维蛋白溶液,调节pH值至7.5[21],放入80 ℃恒温水浴加热40 min,冰浴降温形成凝胶,置于4 ℃冰箱中孵育2 h。
将质量浓度均为1.2 g/100 mL的TSPP、SHMP和STPP分别与质量浓度为5 g/100 mL的SPI以体积比1∶2溶于生理盐水,得到磷酸盐-SPI混合液,作为复合处理草鱼肌原纤维蛋白所用试剂。配制0.9、1.2、1.5 g/100 mL的磷酸盐溶液及5 g/100 mL的SPI溶液,作为单一对照处理草鱼肌原纤维蛋白所用试剂。将复合处理所用磷酸盐-SPI混合液或对照处理所用磷酸盐及SPI溶液按照体积比1∶4加入到1 mg/mL肌原纤维蛋白溶液中,调节pH值至7.5,80 ℃加熱40 min制备凝胶,并进行持水性、嫩度、黏度及超微形态学检测。
用质量浓度分别为0.9、1.2、1.5 g/100 mL的磷酸盐与5 g/100 mL SPI联合处理肌原纤维蛋白,步骤同上。选择结果较好的凝胶组作为目标磷酸盐实验组。按磷酸盐种类不同将复合处理分为3 组:1.2 g/100 mL TSPP、5 g/100 mL SPI体积比1∶1、1∶2、1∶3处理组;1.2 g/100 mL SHMP、5 g/100 mL SPI体积比1∶1、1∶2、1∶3处理组;1.2 g/100 mL STPP、5 g/100 mL SPI体积比1∶1、1∶2、1∶3处理组。
1.3.2 凝胶特性与超微结构表征
1.3.2.1 凝胶持水性测定
称取一定质量草鱼肌原纤维蛋白凝胶于10 mL离心管中,4 ℃条件下4 500 r/min离心10 min后除去多余水分,测定凝胶离心前后质量。重复测定3 次取平均值。持水性按下式计算。
式中:m0为离心管质量/g;m1为离心前离心管和凝胶质量/g;m2为离心后离心管和凝胶质量/g。
1.3.2.2 凝胶力学特性测定
取长×宽×高不小于6 cm×3 cm×3 cm的整块凝胶,用直径1.27 cm柱形取样器取样,孔样长度为3 cm。将孔样置于肌肉嫩度仪上,孔样剪切力峰值扣除空载剪切力峰值,即为孔样剪切力测定值。每个处理组取3 块凝胶样,测得凝胶的平均剪切力。
将凝胶样品置于高速组织捣碎机,经粉碎后置于4 ℃恒温容器内,将同轴测量圆筒放入旋转黏度仪测量容器进行测定,取3 次测定平均值为样品黏度。
1.3.2.3 凝胶超微结构表征
将处理后的草鱼肌原纤维蛋白溶液稀释200 倍,取10 μL稀释液滴于新鲜解理的云母片上,置于80 ℃水浴锅中恒温加热40 min,并在4 ℃条件下防尘干燥2 h,最终得到凝胶样品。利用原子力显微镜对凝胶样品进行成像,扫描模式为ScanAsyst智能模式,扫描面积2.0 μm× 2.0 μm,扫描频率0.997 Hz。凝胶表面粗糙度由均方根粗糙度(Rq)表示,由离线软件Nanoscope Analysis V1.10(美国Bruker公司)基于原子力显微镜高度图像进行计算分析。
1.4 数据处理
所有数据均采用Excel 2010软件及Minitab 15软件进行统计分析,利用Excel 2010软件记录数据、绘制图表,利用Minitab 15软件采用方差分析对数据进行差异显著性分析。
2 结果与分析
2.1 不同种类磷酸盐处理后草鱼肌原纤维蛋白凝胶特性
2.1.1 不同种类磷酸盐处理后草鱼肌原纤维蛋白凝胶宏观特性
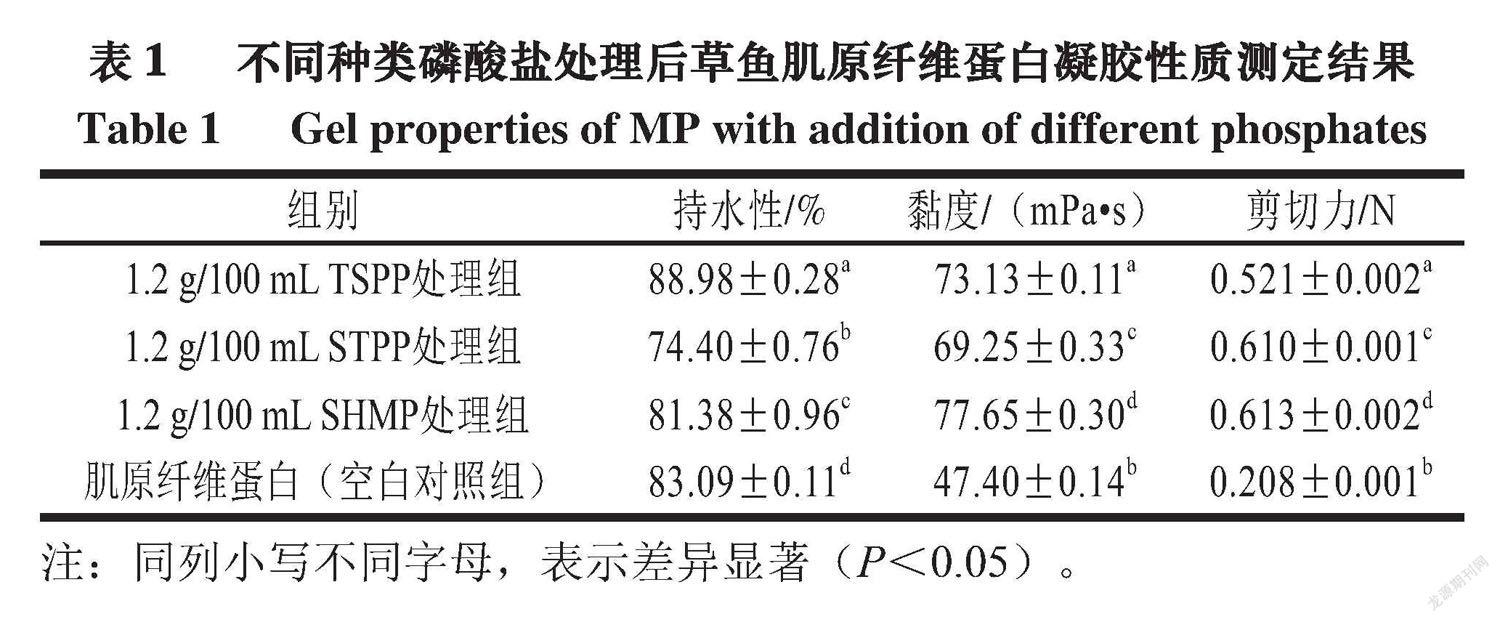
持水性是鱼糜制品的重要物理参数,体现鱼糜蛋白的保水能力,与蛋白体系的交联情况有关[22-23]。黏度表示样品流动阻力的大小,分散体的黏度随着分子尺寸的增加而增加[24]。
2.1.2 不同种类磷酸盐处理后草鱼肌原纤维蛋白凝胶微观表面结构
热诱导凝胶在形成过程中,肌原纤维蛋白的主要成分肌球蛋白受热而变性展开,松散的蛋白进而因降温时的聚合作用相互交联,最终形成较大分子的凝胶体,并把水分子包裹在其中[25]。凝胶基质的结构和物理化学特性的差异主要取决于变性和聚集的相对速率,蛋白的聚集速率相对展开速率越慢,就越有利于蛋白的定向,最终会呈现出更加细致的凝胶网络;反之,则形成粗糙、无序的凝胶结构或凝结物[26]。
由图1可知,1.2 g/100 mL TSPP处理组草鱼肌原纤维蛋白凝胶的表面颗粒更加分散、表面高度差更小,该组蛋白凝胶颗粒的大小(黏度)也较为适中(表1,P<0.05)。与空白对照组相比,不同种类磷酸盐加入均使凝胶表面颗粒明显分散化,呈现出更加规律的排布。由此推断,加入不同种类磷酸盐均可增大草鱼肌原纤维蛋白分子间的静电斥力,聚集速率降低,致使蛋白分子充分展开;之后的热处理则使蛋白缓慢聚集,变性链定向趋于有序化,从而使凝胶的微观表面细致、均匀,形成较为规律的微观结构。磷酸盐改善凝胶性质的另一原因在于離子与带正电荷的相邻肽链发生相互作用,从而稳定蛋白交联,导致更有序和更紧密凝胶网络的形成,使凝胶具有更高的强度和持水性[27]。在pH 7.5条件下,磷酸盐的加入会在蛋白表面形成电子层,促进蛋白肽链间氢键的稳定,从而增强蛋白的溶解度和微观有序程度,使蛋白与水的相互作用增多,有利于蛋白形成稳定、有序的交联网络并保存水分。这一过程在表1中则体现为:相较空白对照组,不同种类磷酸盐加入均使凝胶持水性显著提升。微观表面扫描图(图1)显示,凝胶表面颗粒从聚集成团向分散均匀发生转变。
综合宏观及微观测定结果,较其他种类磷酸盐处理,1.2 g/100 mL TSPP处理组具有最好的凝胶特性(高保水性、高嫩度、黏度适中、表面均匀)。
2.2 不同质量浓度TSPP-5 g/100 mL SPI联合处理后草鱼肌原纤维蛋白凝胶特性
2.2.1 不同质量浓度TSPP-5 g/100 mL SPI联合处理后草鱼肌原纤维蛋白凝胶宏观特性
当添加SPI时,肌原纤维蛋白的热稳定性增加,凝胶的保水能力显著提升。SPI加入提高凝胶品质可能是由于其为周围水分子提供更多的氢键结合位点,增强氢键和二硫键[28-29],使蛋白间交联程度增大,作为肌原纤维蛋白间连接的中间体,提高了蛋白凝胶体系的稳定性,这与草鱼肌原纤维蛋白凝胶宏观测定结果一致。由图2可知,1.2 g/100 mL TSPP-5 g/100 mL SPI联合处理使凝胶剪切力最小,嫩度最大(P<0.05);由图3可知,磷酸盐-SPI复合处理较单一处理,凝胶持水性明显升高,表明复合处理较单一处理对于草鱼肌原纤维蛋白凝胶品质具有显著改善作用,但不同比例的磷酸盐、SPI复合处理对持水性改变不大;由图4可知,随着5 g/100 mL SPI添加量的增大,0.9 g/100 mL TSPP复合处理组凝胶黏度呈上升趋势,而1.2 g/100 mL TSPP复合处理组凝胶黏度呈下降趋势,1.5 g/100 mL TSPP复合处理组凝胶黏度先上升后下降,仅A2组和B3组的黏度较为适中(P<0.05),表明在较低离子强度条件下,SPI可使蛋白分子间交联程度增大,较高离子强度时则降低蛋白交联程度或对交联程度影响无规律。1.2 g/100 mL TSPP-5 g/100 mL SPI联合处理可使草鱼肌原纤维蛋白凝胶具有较好的持水性、嫩度及黏度。磷酸盐-SPI复合处理有助于提高草鱼肌原纤维蛋白凝胶品质。
2.2.2 不同质量浓度TSPP-5 g/100 mL SPI联合处理后草鱼肌原纤维蛋白凝胶微观表面结构
磷酸盐与蛋白的结合能力与其链长有关[30],链长较短的TSPP可能具有更高的反应灵活性。由图1a、d及图5可知,随着TSPP质量浓度的增加,蛋白颗粒从聚结在一起变为更加伸展、分散,这有利于凝胶网络结构趋于形成更为有序、表面更加平缓、多孔且孔径均一的细致结构。其中,1.2 g/100 mL磷酸盐处理后的凝胶表面蛋白较其他质量浓度磷酸盐处理组更规则、平整;SPI使凝胶表面颗粒更分散,磷酸盐使凝胶表面更平整;B3组凝胶品质最优。原子力显微镜扫描图可直观展示样品表面蛋白颗粒分散情况及蛋白颗粒高度,高度差越小、颗粒越分散,则表明样品表面越平整、均匀。与图1a显示的空白对照组表面形貌对比,在加入SPI后,凝胶表面颗粒分布更加均匀,但由于蛋白量的增大,凝胶表面高度差也较大(图6,空白对照组、5 g/100 mL SPI组)。较低质量浓度的磷酸盐(0.9 g/100 mL TSPP)加入后,凝胶表面蛋白趋于分散化(图5B);TSPP处理较SPI、STPP及SHMP处理更有利于蛋白的分散,使凝胶具备更低的表面粗糙度(图1b、c、d、图5a、图6)。不同处理组间对比结果显示,B3组凝胶表面最为平整、有序(图5d、e、f),且凝胶表面粗糙度最低(P<0.05,图6)。
3 结 论
磷酸盐促进了草鱼肌原纤维蛋白凝胶的有序性,SPI增大了蛋白间交联程度,二者共同配合提升了草鱼肌原纤维蛋白凝膠的品质。综合宏观及微观结果,较其他处理组而言,1.2 g/100 mL TSPP、5 g/100 mL SPI体积比1∶3处理组可使草鱼肌原纤维蛋白凝胶具有嫩度大、持水性好、黏性适中、粗糙度小、结构平整有序的特点,表明该种处理方式能够显著提高草鱼肌原纤维蛋白凝胶性质,是更好的草鱼肌原纤维蛋白凝胶处理方案,生产者可考虑采取该种处理方式提高草鱼鱼糜凝胶产品的品质,优化生产工艺。
不同来源的肌原纤维蛋白,其理化性质及含量存在差异,本研究仅探讨了磷酸盐、SPI对草鱼肌原纤维蛋白凝胶化的影响,未涉及其他种类来源的肌原纤维蛋白。在探究其他来源肌原纤维蛋白相关性质时,可采用多种方式(如使用扫描电子显微镜观察、牵拉蛋白凝胶并检测力学特性变化等)研究不同处理条件对不同来源肌原纤维蛋白热凝胶品质的影响。
参考文献:
[1] 中国农业部渔业局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2018: 89.
[2] 刘宏伟. 食品行业的冷链物流[J]. 中国物流与采购, 2004, 17(8): 46-47.
[3] 李立敏, 杨豫菘, 成立新, 等. 茶多酚对羊肉肌原纤维蛋白凝胶特性的影响[J]. 肉类研究, 2020, 34(3): 8-13. DOI:10.7506/rlyj1001-8123-20200131-030.
[4] LIU Ru, ZHAO Siming, LIU Youming, et al. Effect of pH on the gel properties and secondary structure of fish myosin[J]. Food Chemistry, 2010, 121(1): 196-202. DOI:10.1016/j.foodchem.2009.12.030.
[5] CRUZ A G, FARIA J A, POLLONIO M A, et al. Cheeses with reduced sodium content: effects on functionality, public health benefits and sensory properties[J]. Trends in Food Science and Technology, 2011, 22(6): 276-291. DOI:10.1016/j.tifs.2011.02.003.
[6] 张杰, 赵志峰, 郝罗, 等. 减盐策略及低钠盐研究进展[J]. 中国调味品, 2021, 46(3): 179-184. DOI:10.3969/j.issn.1000-9973.2021.03.037.
[7] GARFINKLE M A. Salt and essential hypertension: pathophysiology and implications for treatment[J]. Journal of the American Society of Hypertension, 2017, 11(6): 385-391. DOI:10.1016/j.jash.2017.04.006.
[8] RUBIO-ALIAGA I. Phosphate and kidney healthy aging[J]. Kidney and Blood Pressure Research, 2020, 45(6): 802-811. DOI:10.1159/000509831.
[9] BAUBLITS R T, POHLMAN F W, BROWN A H, et al. Effects of enhancement with varying phosphate types and concentrations at two different pump rates on beef Biceps femoris instrumental color characteristics[J]. Meat Science, 2005, 71(2): 264-276. DOI:10.1016/j.meatsci.2005.03.015.
[10] CLIVE V. 冷藏和冷冻工程技术[M]. 北京: 中国轻工业出版社, 2000.
[11] LIN Duanquan, ZHANG Longtao, LI Runjing, et al. Effect of plant protein mixtures on the microstructure and rheological properties of myofibrillar protein gel derived from red sea bream (Pagrosomus major)[J]. Food Hydrocolloids, 2019, 96: 537-545. DOI:10.1016/j.foodhyd.2019.05.043.
[12] PAN Lihua, FENG Meiqin, SUN Jian, et al. Thermal gelling properties and mechanism of porcine myofibrillar protein containing flaxseed gum at various pH values[J]. CyTA-Journal of Food, 2016, 14(4): 1-8. DOI:10.1080/19476337.2016.1172261.
[13] ZHAO Yinyu, ZHOU Guanghong, ZHANG Wanggang. Effects of regenerated cellulose fiber on the characteristics of myofibrillar protein gels[J]. Carbohydrate Polymer, 2019, 209(1): 276-281. DOI:10.1016/j.carbpol.2019.01.042.
[14] 康伟. 大豆分离蛋白、卡拉胶与肌原纤维蛋白间的相互作用[J]. 食品研究与开发, 2018, 39(8): 30-35. DOI:10.3969/j.issn.1005-6521.2018.08.006.
[15] 蒋爱民, 南庆贤. 畜产食品工艺学[M]. 北京: 中国农业出版社, 2000: 66-69.
[16] 韩敏义, 李巧玲, 陈红叶. 复合磷酸盐在食品中的应用[J]. 中国食品添加剂, 2004(3): 93-96. DOI:10.3969/j.issn.1006-2513.2004.03.025.
[17] RAY M, ROUSSEAU D. Stabilization of oil-in-water emulsions using mixtures of denatured soy whey proteins and soluble soybean polysaccharides[J]. Food Research International, 2013, 52(1): 298-307. DOI:10.1016/j.foodres.2013.03.008.
[18] 王博, 伊東, 谢梦颖, 等. 糖基化大豆分离蛋白对肌原纤维蛋白功能特性的影响[J]. 食品科学, 2017, 38(7): 63-69. DOI:10.7506/spkx1002-6630-201707011.
[19] 曾淑薇, 李吉, 熊善柏, 等. 磷酸盐对草鱼肌原纤维蛋白结构的影响[J]. 食品科学, 2014, 35(23): 48-51. DOI:10.7506/spkx1002-6630-201423010.
[20] 张登科, 张慧恩, 朱艳杰, 等. 超高压处理对养殖大黄鱼肌原纤维蛋白结构的影响[J]. 食品科学, 2019, 40(9): 61-67. DOI:10.7506/spkx1002-6630-20180409-113.
[21] WANG Wenting, PAN Teng, ZHANG Yaqi, at al. Ultrastructure of Longissimus dorsi myofibrillar proteins and heat-induced gels as observed with atomic force microscopy: effects of pH values and sodium ions[J]. International Journal of Food Properties, 2019, 22(1): 34-41. DOI:10.1080/10942912.2019.1568256.
[22] MAJUMDAR R K, SAHA A, DHAR B, et al. Effect of garlic extract on physical, oxidative and microbial changes during refrigerated storage of restructured product from Thai pangas (Pangasianodon hypophthalmus) surimi[J]. Journal of Food Science and Technology, 2015, 52(12): 7994-8003. DOI:10.1007/s13197-015-1952-7.
[23] WANG Lei, CHENG Jiaqi, SU Ruihua, et al. Changing the gel-forming properties of myofibrillar protein by using a gentle breaking method[J]. Journal of Food Science, 2018, 84(9): 2791-2797. DOI:10.1111/1750-3841.14362.
[24] 宁云霞, 鲍佳彤, 杨淇越, 等. 革胡子鲶鱼鱼糜冻藏时间对鱼豆腐品质特性的影响[J]. 肉类研究, 2020, 34(4): 64-70. DOI:10.7506/rlyj1001-8123-20191231-314.
[25] 杨龙江, 南庆贤. 肌肉蛋白的热诱导凝胶特性及其影响因素[J]. 肉类工业, 2001(10): 39-42. DOI:10.3969/j.issn.1008-5467.2001.10.017.
[26] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170. DOI:10.3864/j.issn.0578-1752.2010.01.019.
[27] CHEN Jinyu, REN Yunxia, ZHANG Kunsheng, et al. Site-specific incorporation of sodium tripolyphosphate into myofibrillar protein from mantis shrimp (Oratosquilla oratoria) promotes protein crosslinking and gel network formation[J]. Food Chemistry, 2019, 312(2): 126113. DOI:10.1016/j.foodchem.2019.126113.
[28] NIU Haili, XIA Xiufang, WANG Chao, et al. Thermal stability and gel quality of myofibrillar protein as affected by soy protein isolates subjected to an acidic pH and mild heating[J]. Food Chemistry, 2017, 242: 188-195. DOI:10.1016/j.foodchem.2017.09.055.
[29] LI Junguang, CHEN Yunhao, DONG Xiuping, et al. Effect of chickpea (Cicer arietinum L.) protein isolate on the heat-induced gelation properties of pork myofibrillar protein[J]. Journal Science of Food and Agriculture, 2020, 101(5): 2108-2116. DOI:10.1002/jsfa.10833.
[30] VENKITESHWARAN K, WELLS E, MAYER B K. Kinetics, affinity, thermodynamics, and selectivity of phosphate removal using immobilized phosphate-binding proteins[J]. Environmental Science and Technology, 2020, 54(17): 10885-10894. DOI:10.1021/acs.est.0c02272.
收稿日期:2021-05-27
基金項目:陕西省重点研发计划项目(2018NY-110);西北农林科技大学大学生创新创业训练计划项目(X20190712520)
第一作者简介:张钰嘉(2000—)(ORCID: 0000-0001-8496-7830),女,本科生,研究方向为肌肉与肉品生物物理学。
E-mail: zyj7314@nwafu.edu.cn
通信作者简介:朱杰(1980—)(ORCID: 0000-0002-8008-4771),男,教授,博士,研究方向为肌肉与肉品生物物理学。
E-mail: jiezhu@nwafu.edu.cn

