加热方式对大蒜挥发性物质的影响
范波,蔡燚,王鹏,韩颖,易宇文*
(1.成都工业学院,成都 611730;2.四川旅游学院,成都 610100)
大蒜俗称蒜头、胡蒜、独蒜,是百合科葱属植物蒜(AlliumsativumL.)的鳞茎的统称。大蒜起源于欧洲中部、南部,早期在地中海及其附近的古埃及、古罗马、古希腊等地栽培。西汉时期,张骞将大蒜从西域引入我国陕西关中地区,后遍及全国。目前,我国是全球大蒜栽培面积较广和产量较多的国家之一。大蒜主要作为调味品使用,此外大蒜中的生物活性物质具有保鲜、抗菌、抗癌、抗氧化等作用[1-3]。目前关于大蒜的研究主要集中在栽培、深加工和药用等方面[4-6]。在烹饪中,大蒜作为调味品,生食和熟食其性味差异极大。生食时味辛辣,气味刺激性强烈;加热成熟后味微甜,辛辣味消失。大蒜在加热后其挥发性物质有哪些变化目前未见相关报道。研究食品风味的方法包括智能感官和分子感官。智能感官如电子鼻、电子舌和电子眼。电子鼻(electronic nose,E-nose)是一种模拟人类生理嗅觉,评价食品气味的检测技术。它利用传感器阵列对不同气味物质的响应值并结合参数模型来识别物质,能够避免生理嗅觉的缺陷,保证测试结果的稳定性和重复性,没有繁琐的前处理,无需破坏样品,检测速度快,结果易读。目前主要应用于调味品等研究领域[7]。分子感官包括气相、液相色谱法、气-质联用法(gas chromatography-mass spectrometry,GC-MS)、液-质联用法、气相色谱-嗅闻技术(gas chromatography-olfactometry,GC-O)。气-质联用技术(GC-MS)是气相色谱加质谱技术的简称,二者结合可以实现复杂有机化合物的分离和定性,作为分析挥发性物质的有效工具,广泛应用于调味品等领域[8]。
本文拟利用色差仪、电子鼻和气质联用仪结合主成分等方法分析比较未加热(A)、炒制(B)、蒸制(C)成熟的大蒜在颜色、整体气味轮廓和具体气味物质方面的差异,以期为大蒜深加工及在烹饪中的应用提供参考。
1 材料与方法
1.1 材料与仪器设备
1.1.1 材料
紫皮大蒜:四川雅安汉源;精炼一级大豆油:金龙鱼。
1.1.2 仪器设备
FOX 4000型电子鼻 法国Alpha MOS公司;NR200型3nh色差仪 深圳市三恩驰科技有限公司;Clarus 680气相色谱仪;Clarus SQ8T质谱仪;HST40带捕集阱的顶空进样器;PE Elite-5MS色谱柱(30 m×0.25 mm×0.25 μm) 美国PerkinElmer公司;BL-200F分析天平(200 g/0.001 g) 美国西特公司;其他实验室常用设备。
1.2 样品处理方法
将大蒜去皮,用搅拌机搅拌成蒜泥,备用。取蒜泥200 g,加入20 g大豆精炼油,拌匀,分成两份(每份110 g),均用保鲜膜包好,防止水分蒸发,分别编号为A(未加热)、C。在蒸锅中加入适量水,放入一个不锈钢盘一起加热,当温度达到100 ℃时,倒掉不锈钢盘中的水,然后将C样品平铺在不锈钢盘中,并用保鲜膜包裹,保持100 ℃,5 min,取出备用。在炒锅中倒入10 g大豆精炼油,加热至150 ℃(正常烹饪时的油温),然后加入100 g蒜泥,不停翻炒,保持150 ℃,5 min,取出备用,编号为样品B。
1.3 色差分析
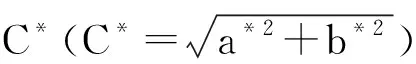
1.4 电子鼻分析
取样品2.000 g置于10 mL样品瓶中,密封,放入50 ℃顶空加热器,加热300 s,用注射器吸取500 μL注入电子鼻检测器。
电子鼻手动进样,进样速度500 μL/s,数据采集时间120 s,数据采集延迟180 s,每个样品平行测试5次,取后3次传感器在120 s时获得的稳定信号进行分析。
1.5 GC-MS分析
取样品2.000 g,置于顶空瓶中,密封。将顶空瓶放入自动进样器,待检测。
萃取温度50 ℃,进样针温度55 ℃,传输线温度60 ℃,萃取时间20 min;干吹时间2 min,解吸时间0.2 min,加压/释压时间2 min;捕集阱保持时间3 min;捕集阱循环次数2次。
GC条件:载气(氦气99.999%)流速1 mL/min,分流比5∶1。进样口温度:240 ℃;升温程序:40 ℃,保持2 min,以6 ℃/min升温至 170 ℃,保持 5 min,以10 ℃/min升温至 250 ℃,保持1 min。
MS条件:EI离子源,电子轰击能量70 eV,离子源温度230 ℃;全扫描;质量扫描范围:45~450 m/z;扫描延迟66 s;标准调谐文件。
定性分析:挥发性成分的定性以检索NIST 2011谱库,选取正反匹配均大于700,同时与文献值进行比对,结合人工解析质谱图同时进行确定。
定量分析:峰面积归一化法,计算相对百分含量。
1.6 数据处理
2 结果与分析
2.1 色差仪分析
3个样品的色差分析检测结果见表1。

表1 色差分析结果Table 1 The results of color difference analysis
从明度指数L*看,A、C在明亮维度上比较接近,而B的明亮指数偏低,这可能是在炒制时氧化及美拉德反应的结果。红绿指数(a*)显示A、C为负数,色相以微绿为主,B为正数,色相以偏红为主;黄蓝指数(b*)显示3个样品均偏黄,但程度不一,A、C更为接近。色彩饱和度指数(C*)显示B样品更为饱和,颜色深;A、C的饱和度接近。色调角指数(H*)显示A、C较为接近,且与B差异较为明显。
2.2 电子鼻主成分分析(PCA)
3个样品电子鼻检测结果主成分分析(PCA)见图1。

图1 电子鼻主成分分析Fig.1 Principal component analysis of electronic nose
由图1可知,PC1和PC2分别为80.92%和12.55%,累计为93.47%。陈丽丽等[10]认为第一、二主成分累计超过80%即可反映样品的主要风味轮廓。这说明在对原始数据进行线性变换和降维时, 其核心成分被有效保留,能够反映样品的主要风味轮廓。图1中A样品分布在Y轴的右面,B、C分布在Y轴的左面,说明A与B、C样品差异明显,这与生食大蒜时气味刺激,而大蒜煮熟后强烈的刺激味消失一致。B、C样品分别分布在X轴的上下,说明炒制的蒜泥和蒸制的蒜泥在气味上有差异。李琴等[11]认为如果PC1和PC2差异大(PC2相对于PC1很小), 而样品差异主要体现在PC2上,则样品之间差异较小。B、C样品的差异主要来源于PC2,PC2仅为12.55%,说明炒制蒜泥和蒸制蒜泥在气味上虽有差异但较小,这可能与加热时温度差异有关。
2.3 GC-MS分析
2.3.1 离子流图比较
PE Elite-5MS(30 m×0.25 mm×0.25 μm)色谱柱分离结合质谱检测得到的样品离子流图见图2。
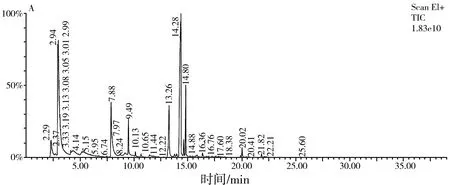
图2 离子流图比较Fig.2 Comparison of ion current diagrams
由图2可知,样品A、B、C分离后分别得到24,29,23种挥发性物质。A样品出峰时间集中在2~15 min之间,26 min以后无有效峰出现。B样品出峰时间集中在2~15 min之间,但30 min以后仍有有效峰出现。样品C出峰时间集中在2~15 min之间,35 min之后仍有有效峰出现,这可能能够说明B、C较为相似,与电子鼻检测有类似之处。
2.3.2 3种样品挥发性物质比较分析
3个样品挥发性物质的GC-MS分析结果见表2。
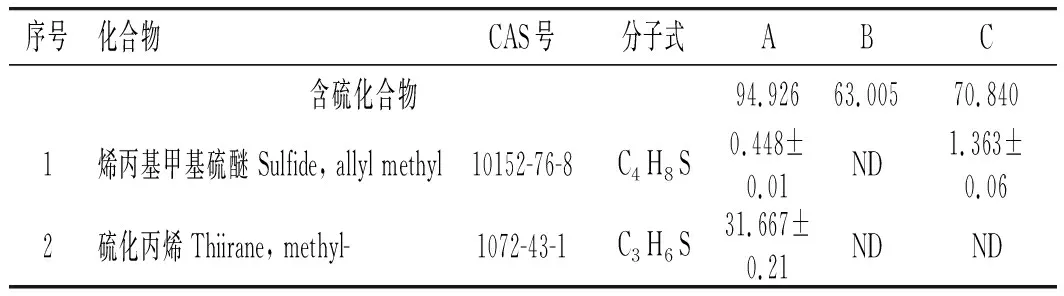
表2 3个样品的GC-MS分析结果Table 2 The analysis results of three samples by GC-MS
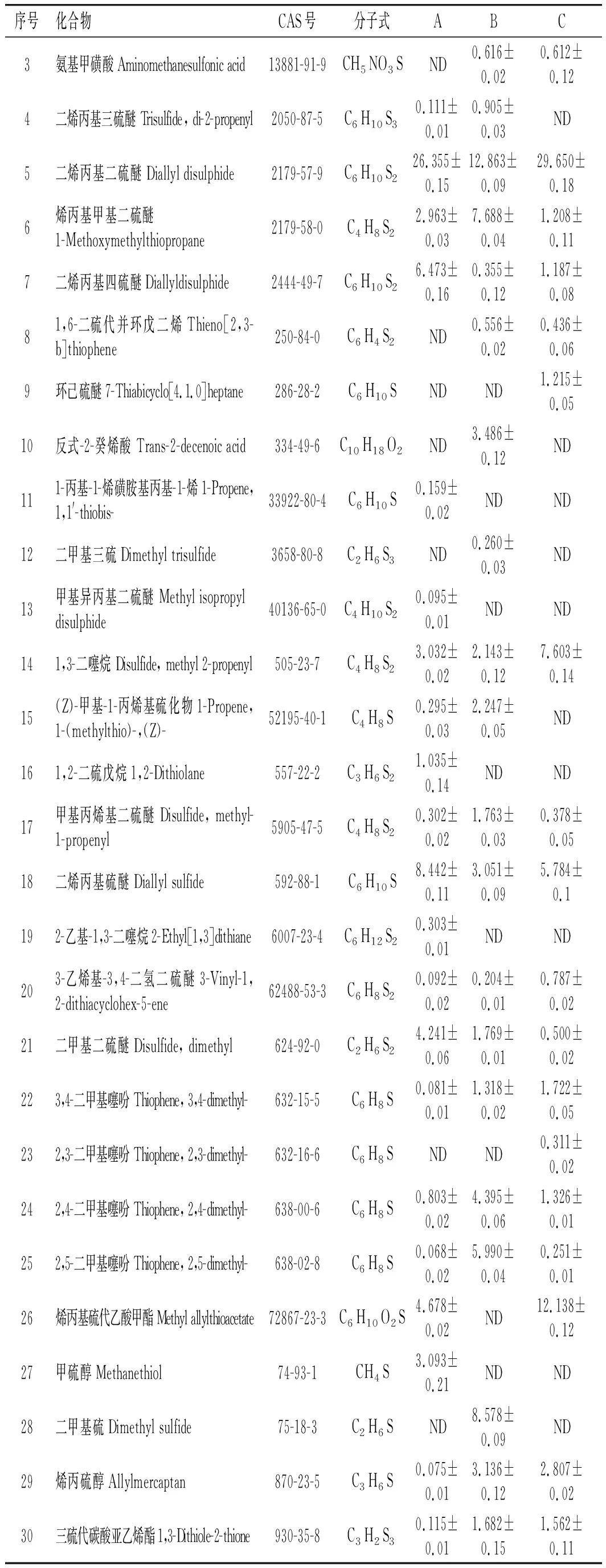
续 表
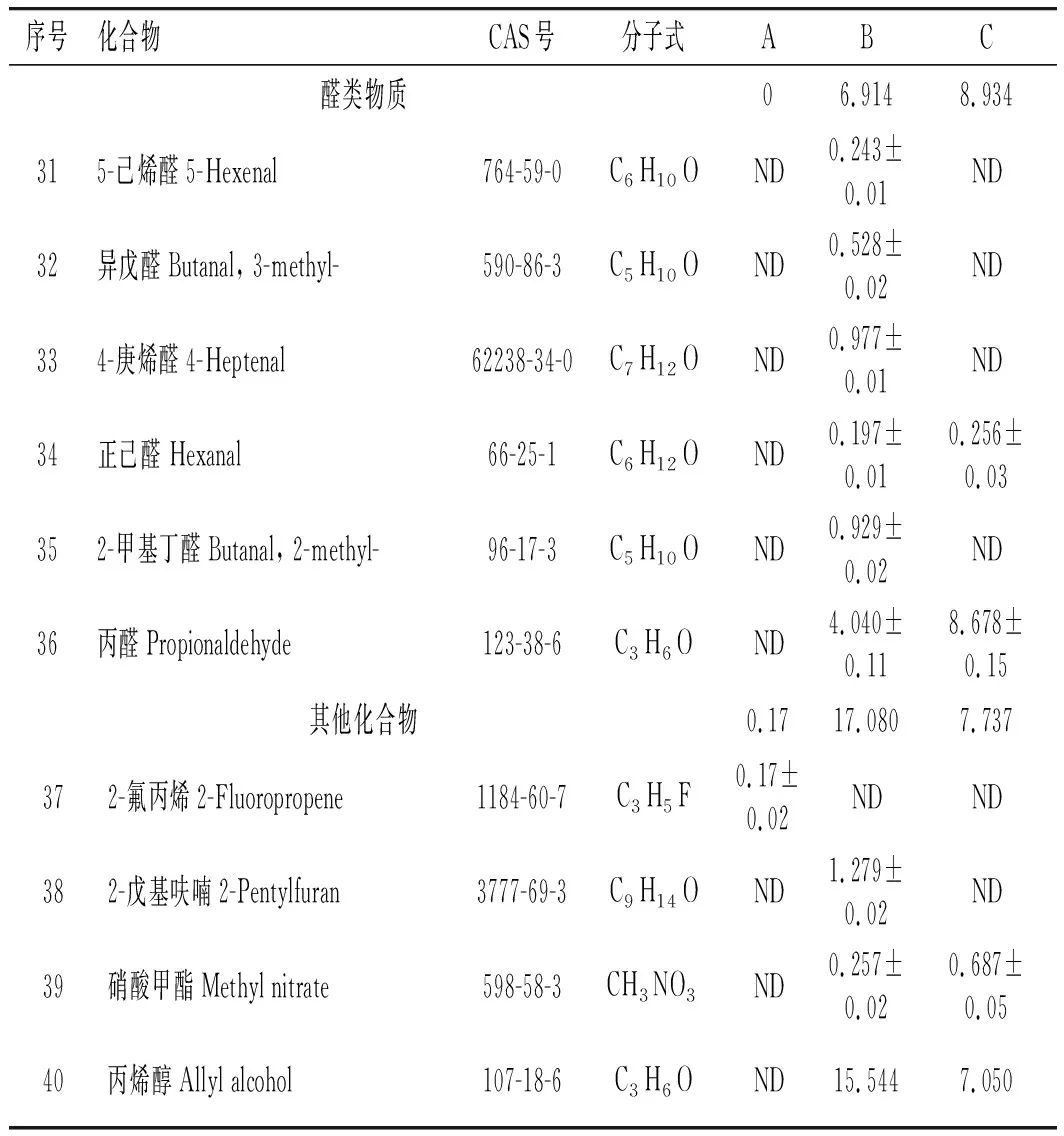
续 表
由表2可知,3个样品共鉴定出40种化合物,包括含硫化合物30种,醛类化合物6种,其他化合物4种。A、B、C样品分别检测到24,29,23种物质,占总含量的95.096%、86.999%、87.511%。样品A鉴定出含硫物质23种,占94.926%;其他1种。样品B鉴定出含硫化合物20种,占63.005%;醛类物质6种,占6.914%;其他3种,占17.080%。蒸制样品(C)共鉴定出含硫物质19种,占70.840%;醛类物质2种,占8.934%;其他物质2种,占7.737%。含硫化合物是未加热和加热大蒜的主要挥发性物质。
样品A含量最高的是硫化丙烯(31.667%),其次为二烯丙基二硫醚(26.355%),最低的为2,5-二甲基噻吩(0.068%)。硫化丙烯是一种具有大蒜特有气味的物质,是大蒜的有效挥发性物质。样品B含量最高的物质为丙烯醇(15.544%),其次为二烯丙基二硫醚(12.863%),最低的为正己醛(0.197%)。丙烯醇是一种具有淡臭味的物质。样品C含量最高的是二烯丙基二硫醚(29.650%),其次是烯丙基硫代乙酸甲酯(12.138%),最低的为2,5-二甲基噻吩(0.251%)。二烯丙基二硫醚是大蒜的主要挥发性物质。二烯丙基二硫醚具有生蒜的辛辣味,它是有大蒜素受热降解的产物。大蒜素受热降解的产物包括二烯丙基二硫醚、二烯丙基硫醚、二烯丙基三硫醚、二氧化硫等化合物。丙烯醇、丙醛是大蒜受热后生成的含量较高的共有物质。
2.3.3 3种样品挥发性物质差异分析
维恩图分析结果见图3。

图3 样品挥发性成分比较维恩图Fig.3 Venn diagram for comparison of volatile components in samples
维恩图是一种展示在不同的事物群组(集合)之间的“大致关系”的方法,它常常被用来帮助推导关于集合运算的一些规律。图3中,A、B、C 3个样品共有物质13种(均为含硫化合物),分别为二烯丙基二硫醚、烯丙基甲基二硫醚、二烯丙基四硫醚、1,3-二噻烷、甲基丙烯基二硫醚、二烯丙基硫醚、3-乙烯基-3,4-二氢二硫醚、二甲基二硫醚、3,4-二甲基噻吩、2,4-二甲基噻吩、2,5-二甲基噻吩、烯丙硫醇、三硫代碳酸亚乙烯酯。样品A特有物质7种(6种含硫化合物和1种烯类物质),硫化丙烯(31.667%)是样品A中含量最高的物质,甲硫醇(3.093%)也是含量较高的物质。样品B特有物质8种(2种含硫化合物,4种醛类物质,呋喃类和酸类物质各1种),丙烯醇(15.544%)是含量最高的物质,二甲基硫(8.578%)、反式-2-癸烯酸(3.486%)含量也较高。样品C特有物质2种(均为含硫化合物),环己硫醚(1.215%)和2,3-二甲基噻吩(0.311%)。A、C共有物质2种,分别是烯丙基甲基硫醚、烯丙基硫代乙酸甲酯。B、C共有物质6种,分别是氨基甲磺酸、1,6-二硫代并环戊二烯、正己醛、硝酸甲酯、丙烯醇、丙醛。A、B共有物质2种,分别是二烯丙基三硫醚、(Z)-甲基-1-丙烯基硫化物。不同加热温度下,大蒜的挥发性物质有一定的差异,加热后的样品共有物质较多。
2.4 讨论
2.4.1 含硫化合物
组织未被破坏的大蒜刺激性气味并不强烈。当大蒜组织被破坏时会生成大量的含硫化合物,这些含硫化合物是大蒜刺激性气味的主要来源。大蒜含硫化合物的形成主要是蒜氨酸分解成次磺酸,次磺酸转化成大蒜素,大蒜素进一步作用生成硫化丙烯、二烯丙基类化合物和二氧化硫等化合物[12]。
硫化丙烯是样品A中检测到的特有物质,含量高(31.667%)。硫化丙烯是一种具有广谱抗菌效果的物质,对痢疾杆菌、乙型脑炎病毒、结核杆菌、念球菌、葡萄球菌等几十种流行病毒和致病菌具有良好的抗菌效果。刘春菊等[13]比较未经处理的大蒜、醋浸大蒜和热风干燥的蒜片,发现硫化丙烯是未经处理的大蒜检出的特有物质,而在醋浸大蒜和热风干燥大蒜中均未检出。在本实验中,加热处理的两个样品中也均未检测出硫化丙烯,这与刘春菊等的研究结果一致。导致这种现象可能与硫化丙烯沸点低(75~77 ℃)有关。基于这一性质,生食大蒜更有利于保持更多生物活性物质。
二烯丙基二硫醚是3个样品中均检测到的物质,其含量分别为26.355%、12.863%和29.650%,含量高。二烯丙基二硫醚属于链状含硫化合物,阈值低(4.3 μg/kg),具有强烈的大蒜香味,无催泪作用。二烯丙基二硫醚的形成可能是C-S键龟裂,形成了丙烯基自由基和烷硫基,这些物质与其他小分子挥发性物质形成了二烯丙基硫化物。烯丙醇也可与烯丙基硫自由基、烯丙基硫醇或蒜氨酸/脱氧蒜氨酸生成二烯丙基硫化物[14]。样品B中二烯丙基二硫醚含量大幅减少,而样品C中含量有一定幅度的增加。这可能是在适宜温度(100 ℃左右)条件下大蒜中的C-S键龟裂促使二烯丙基二硫醚形成;而当温度超过150 ℃时,二烯丙基二硫醚(沸点138~139 ℃)开始挥发。
二烯丙基四硫醚是3个样品的共有物质,其在样品A中含量为6.473%,含量较高。加热样品(B、C)中含量较低。二烯丙基四硫醚在大多数大蒜鲜品中均有检出,但含量均不高(大多低于5%),而本实验检测到二烯丙基四硫醚含量较高,这可能与大蒜的产地不同有关。
环状含硫化合物1,3-二噻烷是3个样品中共有的、相对含量较高(>2%)的物质,其具有大蒜和洋葱的气味。刘春菊等的研究表明,由于1,3-二噻烷等环状含硫化合物对热不稳定,在受热的情况下会转化成挥发性物质或非挥发性物质而使含量降低。但本实验中1,3-二噻烷的含量有升有降,这与刘春菊等的结论有出入,其具体原因需要进一步研究。
二烯丙基硫醚是大蒜的主要挥发性物质之一,3个样品中含量均大于3%。二烯丙基硫醚是一种具有汽油味的物质,在未经加工的大蒜和深加工的大蒜中均有检出,其含量在深加工中呈下降趋势,这说明深加工可能对二烯丙基硫醚有一定的破坏作用。
烯丙基硫代乙酸甲酯在未加热样品(A)和蒸制样品(C)中有检出,且含量较高(>4%),而样品B中未检出。王茂瑞[15]通过分析不同切割伤程度的大蒜表明,烯丙基硫代乙酸甲酯在切割0 h和6 h的样品中有检出,但6 h以后的样品中均未检出。这可能是烯丙基硫代乙酸甲酯长时间暴露在空气中,生成了其他物质,这与本实验中检测到烯丙基硫代乙酸甲酯的含量有一定相似性。在本实验中,样品B长时间在高温和高氧环境中,导致在样品中并未检测出此物质;而在用保鲜膜包裹的A、C样品中均有检出。
二甲基硫是一种具有成熟(加热)大蒜风味的物质。3个样品中仅有样品B中有检出,且含量较高(8.578%)。二甲基硫可能是大蒜中含硫氨基酸经高温后发生降解的产物。
加热会导致大蒜中含硫化合物含量下降,加热温度越高,含硫化合物含量下降得越快。
2.4.2 醛类化合物
样品A未检测到醛类物质,样品B、C分别检测出6种和2种;丙醛是加热样品中检测到的共有物质,且含量高,分别为4.040%(B)和8.678%(C)。丙醛的形成途径可能是大蒜组织受到破坏时细胞组织中的异蒜氨酸被释放出来,其在酶的作用下会生成具有催泪成分的LF3(C3H6OS),LF3(C3H6OS)在蒜氨酸酶和催泪因子合成酶(LFS)的作用下生成了丙醛[16];也有可能是亚油酸和n-3型脂肪酸作用生成了丙醛[17]。丙醛具有水果味,其阈值较高(9.5~37 μg/kg),故对风味贡献较小。
2.4.3 其他化合物
丙烯醇仅在加热样品中有检出,且含量较高。样品B、C的含量分别为15.544%和7.050%。陈海涛等比较新鲜大蒜和油炸大蒜发现,新鲜大蒜中丙烯醇含量高,而油炸处理的大蒜中含量低。在本实验中,新鲜大蒜并未检测到丙烯醇,而油炸和蒸制的样品中均检测到,这与陈海涛等的研究结果不一致,其原因需要进一步研究。丙烯醇具有淡臭味,其阈值较高,对样品风味的形成贡献较小。
3 结论
色差仪分析表明样品B颜色深,饱和度高;A、C颜色浅,饱和度低。电子鼻主成分分析显示B、C在风味轮廓上更为相似,与A差异大。GC-MS分析显示3个样品中共检测到40种化合物,样品A、B、C分别检测到24,29,23种化合物,相对含量分别为95.096%、86.999%和87.511%;含硫化合物是3个样品的主要挥发性物质,分别占相对含量的94.926%、63.005%和70.840%。维恩图分析显示3个样品中共有化合物13种,A、B、C特有挥发性物质分别为7,8,2种;A、B共有物质2种,B、C共有物质6种,A、C共有物质2种;二烯丙基二硫醚是A、B、C样品共有物质中含量最高的物质,是大蒜主要的挥发性物质。加热会导致大蒜含硫化合物含量下降;不同加热温度下,大蒜的挥发性物质有一定的差异;加热后的样品共有物质较多;丙烯醇、丙醛是大蒜受热后生成的含量较高的物质,生蒜含有更多生物活性物质。实验结果对大蒜的深加工和食用有一定的参考价值。

