3D打印微创导向模板插植放射治疗联合深部热疗治疗局部晚期宫颈癌的疗效分析
侯光营 苗珺珺 胡建伟 郜蕾 张永侠 袁香坤
宫颈癌是我国常见的妇科恶性肿瘤之一,根据2018 FIGO分期标准,ⅡB~ⅣA期患者约占85%[1]。目前局部晚期宫颈癌的标准治疗是同步放化疗+近距离放疗[2]。同步放化疗虽然能提高宫颈癌的治疗效果,但是对局部晚期宫颈癌疗效较差[3]。3D打印模板技术根据患者肿瘤大小、位置等信息,打印出高度个体化的模板以引导近距离治疗。近期有研究发现,3D打印模板引导的插植放射治疗在局部晚期宫颈癌治疗中显示了较好的剂量学优势[4]。微波深部热疗利用微波加热深部组织,通过热生物效应达到治疗肿瘤的目的。有研究报道,放疗联合微波深部热疗可进一步提高宫颈癌的局部控制率[5]。然而,目前鲜见有关3D打印模板引导的插植放射治疗与微波深部热疗联合治疗宫颈癌的报道。本研究通过探讨3D打印微创导向模板插植放射治疗联合深部热疗应用于局部晚期宫颈癌的近期疗效,以期明确其临床应用价值。
1 资料与方法
1.1 病例选择
选取2018年6月至2020年12月于河北省沧州中西医结合医院治疗的80例宫颈癌患者为研究对象。纳入标准:⑴初治,根据2018 FIGO分期标准为ⅡB~ⅣA期;⑵根据RECIST 1.1标准,至少有一个可测量病灶且病灶最大径≥4 cm;⑶预期生存期>3个月;⑷体力状况(PS)评分为0分或1分。排除标准:⑴有放疗禁忌证;⑵无法耐受同步放化疗;⑶合并其他恶性肿瘤。本研究经河北省沧州中西医结合医院伦理委员会批准(伦理号:2018074),所有患者入组前均签署知情同意书。
1.2 治疗方法
1.2.1 同步放化疗 所有患者均采用相同的外照射及同步化疗,同步放化疗后将入组患者按1∶1随机分为联合治疗组和单纯治疗组。外照射采用Elekta(瑞典医科达公司)6 MV-X电子直线加速器行盆腔野三维适形调强放疗,50.4 Gy/28次,5次/周。同步化疗:40 mg/m2顺铂,1次/周,共3~5次。
1.2.2 后装放射治疗 两组患者接受15次外照射后进行近距离放射治疗。采用Elekta高剂量率192Ir后装放疗机,大体肿瘤靶区照射剂量为30~36 Gy,5~6次,6 Gy/次,1次/周。所有治疗计划均满足放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)关于宫颈癌根治性放疗的剂量要求[6]。其中,单纯治疗组患者采用传统通用施源器行三维腔内后装放疗。联合治疗组患者于3D打印微创导向模板[7]引导下进行放射治疗,具体步骤:⑴根据患者阴道长短、宽度选择不同型号的阴道3D定位模板进行CT模拟定位。⑵定位图像传入Oncentra Brachy TPS计划系统,结合治疗前盆腔MR勾画肿瘤靶区及危及器官,在三维空间上设计模拟针道及预留备用针道,见图1。数字建模后图像通过启麟数据云平台Ucloud V2.3.7上传至计划系统Prowess Panther,V4.72。⑶将数据导入模板制作系统Unicorn 3D template system V3.1,建立三维模型,输入3D打印机(EP-A650),打印出与患者阴道适形且带有针道位置信息的3D微创导向模板,见图2。⑷治疗前留置导尿管及椎管内麻醉,将3D打印微创导向模板插入阴道,确保模板与皮肤贴合固定。将插植针插入预设主要导向针道。根据CT扫描结果调整插植针位置及深度。⑸将CT图像传入Oncentra Brachy TPS计划系统,重建治疗靶区、针道、危及器官数字模型,制定放疗计划并实施治疗,见图3。
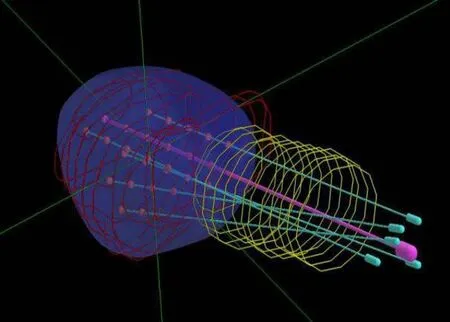
图1 三维模拟针道设计Fig.1 Design of 3D simulation needle track
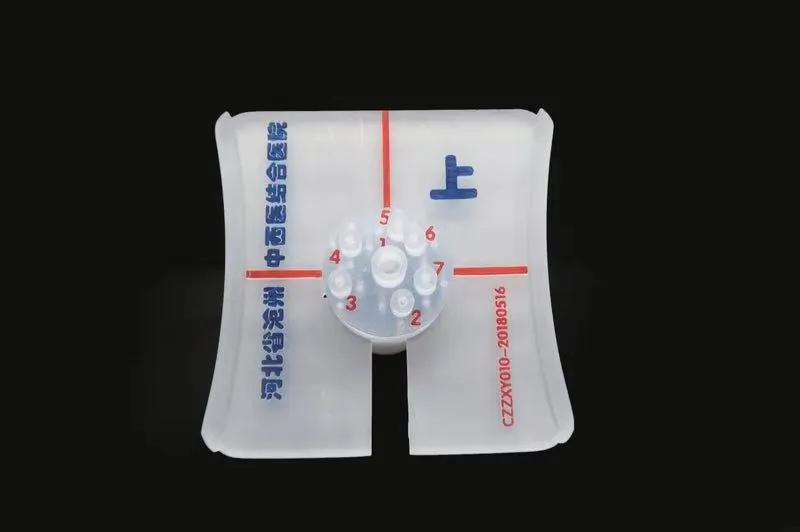
图2 打印完成的3D微创导向模板Fig.2 Printed 3D-printed minimally invasived-guited template
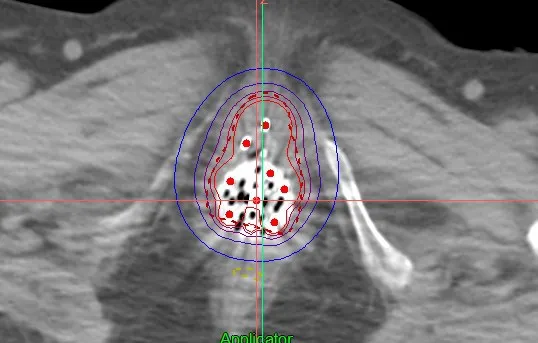
图3 插植治疗的剂量分布Fig.3 Dose distribution of implantation radiotherapy
1.2.3 微波深部热疗 联合治疗组患者于每次插植治疗结束2 h内,采用微波肿瘤热疗仪(江苏诺万医疗设备有限公司,注册证编号为国械注准20193091535,型号规格为N-9001型)进行微波深部热疗,机头为Φ30宫颈辐射器,治疗温度为(40±1)℃,60 min/次,工作频率为60~100 W。
1.3 观察指标及疗效判定
观察两组患者后装近距离放射治疗计划中高危临床靶区(HR-CTV)的V100、D90、周围危及器官膀胱和直肠D2cm3等指标,以及放射性膀胱炎和放射性直肠炎的发生情况。其中V100定义为100%处方剂量所覆盖的靶区体积占靶区总体积的百分比;D90为90%的靶区体积接受的放疗剂量;D2cm3为2 cm3体积所接受的照射剂量。
治疗结束2个月后,所有患者均复查盆腔核磁并进行体格检查,采用WHO标准进行疗效评价,其中完全缓解(complete remission,CR)定义为靶病灶消失且维持4周以上;部分缓解(partial remission,PR)定义为靶病灶2个最大垂直径乘积之总和减少≥50%且维持4周以上;疾病进展(progressive disease,PD)定义为肿瘤面积增加>25%且维持4周以上;疾病稳定(stable disease,SD)定义为肿瘤病灶变化介于PR和PD之间。不良反应采用RTOG急性放射损伤分级标准进行评估。
1.4 统计学方法
应用SPSS 19.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,分类资料的比较采用χ2检验,靶区及危及器官的剂量学分析采用配对样本t检验,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线特征
共80例患者符合标准纳入研究,其中联合治疗组和单纯治疗组每组40例。两组患者年龄、肿瘤分期、病理类型、化疗次数和肿瘤最大径等一般资料比较,差异均无统计学意义(均P>0.05),见表1。

表1 两组患者的基线资料比较Tab.1 Comparison of baseline data between the two groups
2.2 近期疗效
治疗结束2个月后进行疗效评估,联合治疗组获CR 37例(92.5%,37/40),PR 3例(7.5%,3/40);单纯治疗组获CR 29例(72.5%,29/40),PR 8例(20%,8/40),SD 3例(7.5%,3/40)。联合治疗组的局部CR率明显高于单纯治疗组(χ2=4.242,P=0.039),但PR率和SD率无明显差异(χ2=2.635,P=0.193;χ2=3.117,P=0.241)。
2.3 剂量分布
本研究共制定439次后装放疗计划,其中单纯治疗组共施行通用施源器三维腔内后装放疗230次;联合治疗组施行组织间插植放疗共209次,其中1例患者因不能耐受椎管内麻醉,局麻下行3次插植治疗后退出联合治疗。与单纯治疗组治疗计划比较,联合治疗组 HR-CTV 的 V100、D90均明显升高[(79.83±6.31)%vs(87.35±4.38)%,t=6.685,P<0.001;(5.89±0.24)Gyvs(6.32±0.21)Gy,t=7.584,P<0.001]。联合治疗组危及器官直肠D2cm3的平均剂量明显低于单纯治疗组[(3.25±0.36)Gyvs(3.50±0.27)Gy,t=-3.406,P=0.002],但膀胱D2cm3的平均剂量与单纯治疗组比较差异无统计学意义[(4.37±0.25)Gyvs(4.42±0.18)Gy,t=-0.961,P=0.343]。同一患者在3D打印个体化模板引导下后装治疗与通用施源器后装治疗的靶区剂量分布情况见图4。
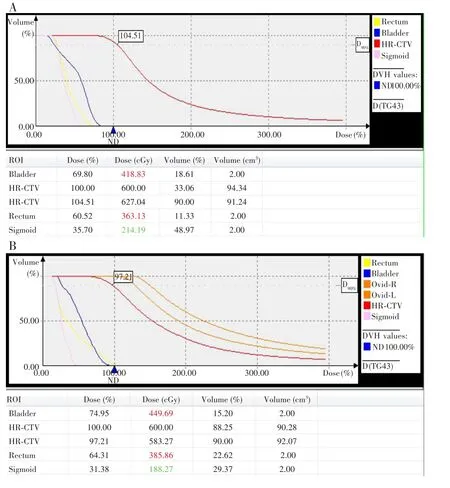
图4 不同引导方式下的近距离放射治疗的剂量体积直方图Fig.4 Dose-volume histogram of brachytherapy under different guidance modes
2.4 不良反应
两组患者治疗期间的放射治疗不良反应均以1~2级为主,经对症处理后可缓解,未影响后续治疗。与单纯治疗组比较,联合治疗组患者1~2级放射性直肠炎和放射性膀胱炎以及3级放射性膀胱炎发生率差异均无统计学意义(均P>0.05);但3级放射性直肠炎发生率明显低于单纯治疗组(2.5%vs15.0%,χ2=3.914,P=0.048)。见表2。

表2 两组患者不良反应发生情况[n(%)]Tab.2 Adverse reactions between the two groups[n(%)]
3 讨论
局部晚期宫颈癌的主要治疗手段为同步放化疗联合近距离放疗,其中近距离治疗是标准宫颈癌根治性放疗的重要组成部分[8]。近距离后装放射治疗能将施源器直接作用于病灶,提高肿瘤的受照射剂量,从而达到更好的治疗效果。但有研究发现,传统通用施源器对局部大肿块宫颈癌的靶区覆盖往往不理想[9-10]。YOSHIDA等[11]也认为单纯腔内放疗适用于HR-CTV体积<16.1 cm3的肿瘤,但对于较大肿瘤腔内放疗剂量曲线分布欠佳。目前研究显示,组织间插植在局部肿块巨大、宫旁及盆壁受侵患者中具有优势。但是传统的徒手三维插植腔内近距离放疗以参考点评价和分析剂量,极易造成剂量分布不均,正常组织受照剂量超量,肿瘤区漏照射等问题[12]。目前,基于3D打印模板引导的插植近距离放射治疗在剂量学方面的优势,使其成为宫颈癌近距离放射治疗领域研究的热点之一。有研究报道,在局部晚期宫颈癌中,采用3D打印微创导向模板引导的组织间插植近距离放疗,靶区覆盖率较好,且能保证靶区覆盖适形度,显示了高度的个性化治疗特点[13]。王凤玫等[14]应用3D打印技术引导宫颈癌个体化近距离放疗也取得了良好的局部控制和安全性,纳入的25例患者有效率高达84.00%,且未见2级以上不良反应发生。
肿瘤热疗的基本原理是利用物理能量加热肿瘤组织使之达到治疗温度,能促使肿瘤细胞凋亡,且对正常组织损伤轻微。放疗与深部热疗的联合在肿瘤生物学方面有协同和互补优势,研究发现热疗与放化疗的联合可显著提高宫颈癌患者的5年控制率[15]。众所周知,肿瘤在发生发展过程中处于不同细胞周期,可将其分为G1期、S期、G2期、M期、G0期。放疗对处于G2/M期的肿瘤细胞较敏感,而热疗对处于S期的肿瘤细胞较敏感,这也是放疗与热疗合理结合可增加肿瘤治疗效果的理论基础[16]。LUTGENS等[17]发现热疗联合放疗明显提高局部晚期宫颈癌的局部控制率和远期生存,3年局部复发率显著降低,且不提高3~4级不良反应的发生率。本课题组前期研究观察了3D打印微创导向模板在术后中心型复发性宫颈癌三维插植后装治疗中的疗效,发现该法不仅定位准确,可重复治疗,而且插植操作时间短,有效降低了直肠和膀胱的受照剂量,总体并发症少而轻,且肿瘤缩小明显,展现了良好的应用前景[18]。在此基础上,本研究进一步将3D打印微创导向模板引导的组织间插植近距离放疗与微波深部热疗联合应用于局部晚期宫颈癌患者的治疗,并与传统通用施源器行三维腔内后装放疗相比,结果联合治疗也显示了良好的近期疗效和剂量优势。首先,联合治疗组患者局部控制率明显提高,CR率明显高于单纯治疗组;其次,联合治疗组的靶区剂量更优化,其中HR-CTV的V100、D90均较单纯治疗组明显升高,在危及器官的照射剂量上,膀胱未显示明显优势,但直肠受照剂量明显降低;再次,总体上两组患者的不良反应均较轻微,且经对症处理后可缓解,但联合组的3级放射性直肠炎发生率更低,进一步说明了联合组在直肠照射中具有剂量优势。
综上所述,3D打印微创导向模板引导的组织间插植近距离放疗联合微波深部热疗治疗局部晚期宫颈癌较传统三维后装治疗可获得更好的近期疗效,靶区照射剂量更高,危及器官直肠的受照剂量更低,具有良好的临床应用前景。但本研究为单中心、小样本回顾性研究,且因随访时间较短,其远期疗效尚未明确,仍需后续研究进一步探索。

