海菜花结合酚的组成、抗氧化活性及其对DNA损伤的保护作用
刘 青,张天阳,洪 玥,李媛丽,李 望,高春燕,2,卢跃红,2,
(1.大理大学公共卫生学院,云南大理 671000;2.北方民族大学生物科学与工程学院,宁夏银川 750021)
海菜花(Ottelia acuminata(Gagnep.)Dandy,O.acuminata),又称异叶水车前、小海带、龙爪菜等,系水鳖科,水车前属[1],沉水植物,生长在池塘和淡水湖泊内,喜温暖;是云贵高原和中国西南地区特有的水生植物[2-3],云南为海菜花的主要分布区。海菜花营养丰富且齐全[4],含多种矿物质元素[5],全株蛋白质含量24.12%、脂肪含量7.14%、粗纤维含量8.43%[6],游离酚提取物总酚含量为257.62~388.19 mg/g Extract[7]。在云南,海菜花是一种美味的食用蔬菜;同时也是一味传统白族中药,用于治小便不利、便秘、热咳、咯血、哮喘、淋症、水肿等多种疾病[8];另外,海菜花还具有净化水质的作用[9]。海菜花是一种极具开发潜力的植物资源[10]。
植物多酚是植物中分布最广的次生代谢产物之一,主要以结合酚和游离酚的形态存在,具有抗氧化活性[11]、抗炎活性[12-13]、抗菌活性[14]、抗肿瘤活性[15]、保护DNA损伤[16]、延缓衰老[17]、调节肠道微生物[18]等作用及功效。近几年来,植物多酚的组成与功效引起了广大科研工作者的极大兴趣。
目前,海菜花在云南主要作为一种食用蔬菜大面积栽培[19],对其研究大多集中在其生物学特性[20-24]、生态学保护利用方面[25-26],而对其营养组成、多酚的组成与功效方面的报道还比较少。本课题组2019年报道了海菜花游离酚提取物的多酚组成及部分功能活性[7]。本研究拟对海菜结合酚的组成、抗氧化活性以及对DNA损伤的保护作用进行研究,为海菜花的合理食用、药用提供理论依据,对于海菜花的保护、利用、开发以及促进当地经济发展具有重要的意义。
1 材料与方法
1.1 材料与仪器
海菜花 于2020年10月在云南省大理白族自治州大理市洱源县邓川镇采集,将采集的海菜花分为花、茎、叶三部分,各部分样品分别进行除杂、清洗、冷冻干燥、粉粹,并密封储存于4 ℃冰箱备用;福林-酚试剂、标准品(绿原酸、咖啡酸、槲皮素-3-O-葡萄糖苷、木犀草素、阿魏酸)、pBR322质粒DNA(0.5 μg/L)、DPPH(1,1-二苯基-2-三硝基苯肼)、Trolox 标准品(6-羟基-2,5,7,8-四甲基色烷-2-羧酸)、ABTS(2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐) 美国 Sigma试剂公司;没食子酸(GaLLic-Acid) 成都市科龙化工试剂厂;乙腈和色谱甲醇美国Fisher公司;乙酸乙酯、浓盐酸、乙醇等 为国产分析纯。
RE-3000旋转蒸发器 上海亚荣生化仪器厂;水浴震荡(HZS-HA) 哈尔滨市东明医疗仪器厂;真空冷冻干燥机(Scientz-ND系列) 宁波新芝生物科技有限公司;722N可见分光光度计 上海菁华科技仪器有限公司;AgiLent 1260高相液相色谱仪(带紫外检测器)、色谱柱(ZORAAX SA-C18,5 μm,250 mm×4.6 mm) 美国AgiLent公司;DYY-6C型电泳仪北京市六一仪器厂;G:AOX-F3凝胶成像系统 基因有限公司。
1.2 实验方法
1.2.1 结合酚的提取与纯化 参照郭琦等[27]的方法稍作修改,分别称取花、茎、叶不同部位样品5 g左右,用80%的甲醇提取3次后,残渣用含有EDTA和抗坏血酸的NaOH溶液避光水解4 h,水解结束后调pH至1,抽滤,乙酸乙酯萃取,收集乙酸乙酯相,旋转蒸发除去乙酸乙酯后得结合酚粗提取液。粗提液用95%乙醇激活的X-5大孔树脂水浴振荡吸附24 h(25 ℃,120 r/min)后抽滤,收集大孔树脂,加入70%乙醇,相同条件下水浴振荡解析24 h,抽滤,收集滤液,35 ℃旋转蒸发除去乙醇,真空冷冻干燥,得纯化的结合酚提取物,-20 ℃冰箱保存备用。
1.2.2 总酚含量测定 参照文献[28]的方法稍作修改,分别吸取不同体积(80~320 μL)的没食子酸标准溶液(100 μg/mL)加 100 μL 福林-酚试剂(1 mg/mL),混匀,3 min后,加2 mL 7.5% Na2CO3,纯水定容至5 mL,避光反应40 min后,于760 nm波长测吸光度值。得标准曲线方程为A=0.0729C+0.062(R2=0.9916)。分别测定花、茎、叶结合酚提取物吸光度值,代入标曲计算得到样品中的总酚含量。样品中的总酚含量以每克海菜花结合酚提取物中没食子酸相当的质量表示(mg GAE/g Extract)。
1.2.3 总黄酮含量测定 参照乌仁格格[29]的方法稍加修改。分别吸取不同体积(0.5~2.5 mL)的儿茶素标准溶液(100 μg/mL)加甲醇补足至 2.5 mL,加 0.15 mL NaNO3(5%),摇匀静置 6 min,加 0.15 mL AlCl3(10%),摇匀避光静置 6 min,加 2 mL NaOH(4%),纯水定容至5 mL,静置15 min后,于510 nm波长测吸光度值。得标准曲线方程为A=7.3829C+0.0161(R2=0.9978)。准确吸取 100 μL海菜花结合酚(10 mg/mL),测定总黄酮含量。样品中的总黄酮含量以每克海菜花提取物中儿茶素相当的质量表示(mg CAE/g Extract)。
1.2.4 酚类化合物单体分析 采用高效液相色谱(HPLC)对结合酚的组成进行分析。液相色谱条件:流速 0.8 mL/min,柱温 37 ℃,进样量 10 μL,波长280 nm;流动相A为100%色谱乙腈,流动相B为1%乙酸超纯水溶液(乙酸/H2O,1/100,v/v)。梯度洗脱程序:0~11 min:A由 2%升至 17%,B由 98%降至 83%;11~17 min:A由 17%升至 24%,B由 83%降至76%;17~22 min:A由24%升至26%,B由76%降至 74%;22~28 min:A由 26%升至 28%,B由74%降至 72%;28~33 min:A由 28%降至 18%,B由72%升至82%;33~35 min:A由18%降至10%,B由82%升至90%;35~38 min:A由10%降至2%,B由90%升至98%。以绿原酸、咖啡酸、槲皮素-3-O-葡萄糖苷、木犀草素、阿魏酸为标准品,设5个不同的浓度梯度(20.0、40.00、60.00、80.00、100.00 μg/mL),分别进行HPLC分析,确定出峰时间及峰面积值。以标品浓度为横坐标,峰面积为纵坐标分别绘制标准曲线。样品用色谱甲醇稀释成2.0 mg/mL,过0.22 μm微孔滤膜,进样分析。将峰面积代入标准曲线方程分别计算样品中各单体酚的含量。
1.2.5 抗氧化活性测定
1.2.5.1 DPPH自由基清除能力 参照Tan等[30]的方法,稍加修改。将结合酚提取物用甲醇配制成35 μg/mL的溶液,吸取 0.5 mL与3.5 mL DPPH甲醇溶液(60 μmol/L)混匀,暗室反应 30 min 后,于517 nm波长测吸光值,并计算清除率。

式中:A1为0.5 mL甲醇+3.5 mL DPPH溶液的吸光度值;A2为0.5 mL样品+3.5 mL甲醇溶液的吸光度值;A3为0.5 mL样品+3.5 mL DPPH溶液的吸光度值。
以 Trolox(10~100 μmol/L)绘制标准曲线,得回归方程为:A=0.6172C-4.1529(R2=0.9965),A 为清除率,C为浓度。样品对DPPH自由基清除能力的结果以毫摩尔Trolox等量每克海菜花结合酚提取物表示(mmol TE/g Extract)。
1.2.5.2 铁还原抗氧化能力 参照Song等[31]的方法,分别吸取100 μL不同浓度梯度的FeSO4·7H2O(100~1000 μmol/L)标准液加 1.4 mL FRAP 工作液[30 mmol/L TPTZ:0.3 mol/L pH 3.6乙酸钠缓液:20 mmol/L FeCl3,1:10:1(v:v:v)]和 2 mL 纯水,混匀,在37 ℃下水浴30 min,于593 nm波长测吸光值。得回归方程:A=0.0006C+0.0034(R2=0.9937),A为吸光度值,C为FeSO4·7H2O浓度。将结合酚提取物用甲醇配制成250 μg/mL的溶液进行测定。样品的FRAP结果以mmol Fe2+每克海菜花结合酚提取物表示(mmoL Fe2+/g Extract)。
1.2.5.3 Trolox等量抗氧化活性 参考张天阳等[32]的方法稍作修改。分别吸取不同浓度梯度的Trolox 25 μL(100~1000 μmol/L),加 2 mL ABTS+·工作液反应6 min后,于734 nm波长测吸光度值,以纯甲醇为空白对照,绘制标准曲线,得回归方程:A=-0.0004C+0.6679(R2=0.9995),A 为吸光度值,C 为Trolox浓度。将海菜花提取物用甲醇配制成1.0 mg/mL的溶液进行测定。测定结果以毫摩尔Trolox等量每克海菜花结合酚提取物表示(mmol TE/g Extract)。
1.2.5.4 羟基自由基清除活性 参照卢跃红等[33]的方法稍加修改。以Trolox为阳性对照,100 μL不同浓度的结合酚溶液(0.25~4.0 mg/mL)或Trolox溶液(0.5~8.0 μg/mL)与 1.5 mL PBS 缓冲液(10 mmol/L)、150 μL 脱 氧核糖(25 mmol/L) 、150 μL 的 FeCl3(1 mmol/L)、150 μL EDTA(1.04 mmol/L)、150 μL H2O2(15 mmol/L)和 150 μL 抗坏血酸(1 mmol/L),充分混匀,在37 ℃下水浴30 min后,加1 mL三氯乙酸(2.8%)和1 mL硫代巴比妥酸(0.5%),沸水浴15 min,于532 nm波长测定吸光度值。对照管用PBS溶液代替样品或Trolox。

式中:A样表示样品的吸光度值;A对表示对照管的吸光度值。
1.2.5.5 DNA损伤的保护作用 参照林琳等[34]的方法稍加修改。反应体系:1 μL DNA、11 μL PBS 溶液、5 μL海菜花结合酚提取物或VC与3 μL AAPH溶液充分混匀后,37 ℃水浴避光反应45 min。反应结束后,吸取 4 μL 反应液与 2 μL loading buffer(含0.15%溴酚蓝、10 mmol/L EDTA 和40%蔗糖)混匀,吸取4 μL混合液置于1.0%琼脂糖凝胶中,电泳(60 V、50 min)。待电泳结束后,凝胶成像系统进行半定量分析,计算双螺旋百分比。

式中:A0为双螺旋构象的灰度值;A1为开环型构象的灰度值;A2为线性构象的灰度值。
1.3 数据处理
所有实验均重复3次,实验数据使用Excel和SPSS 19.0进行分析,采用方差分析进行显著性检验,组间差异采用Tukey多重检验,P<0.05认为差异具有统计学意义,结果用均值±标准差表示。
2 结果与分析
2.1 总酚和总黄酮含量
海菜花不同部位结合酚提取物的总酚含量和黄酮含量测定结果见表1。由表可知,花、茎、叶的总酚含量依次为 366.35±6.37、259.60±2.60、209.72±3.14 mg GAE/g Extract,总酚含量花>茎>叶,三者之间的差异具有统计学意义(P<0.05);总黄酮含量依次为466.08±4.05、305.72±7.92、156.69±2.34 mg CAE/g Extract,其花>茎>叶,三者之间的差异具有统计学意义(P<0.05)。本研究中,海菜花不同部位结合酚提取物的总酚含量与黄酮含量总体趋势一致,即花含量最高,其次为茎,叶最低。本研究测定的海菜花结合酚总酚含量略低于Lu等[7]报道的海菜花游离酚总酚含量(257.62~388.19 mg/g Extract),不同部位游离酚总酚含量与本研究测定的不同部位结合酚含量总体趋势一致,均是花的高于茎的,茎的高于叶的。这表明海菜花不同部位的结合酚含量有差异。

表1 海菜花结合酚提取物总酚和总黄酮含量Table 1 Total phenolic content and flavonoid content of bound phenolics from O.acuminata extract
2.2 海菜花结合酚组成与含量
绿原酸、咖啡酸、槲皮素-3-O-葡萄糖苷、阿魏酸和木犀草素5种标准品的标准曲线方程分别为:y=20.19x+52.38,y=21.07x+58.205,y=5.4105x+17.274,y=34.816x+105,y=21.049x+42.551,R2均大于 0.998,标准品在测定的浓度范围内呈良好的线性关系。不同部位结合酚的组成及含量见表2。由表2可知,含量最高的是咖啡酸(86.51~102.28 mg/g Extract);含量第二的是槲皮素-3-O-葡萄糖苷(5.50~28.01 mg/g Extract);其余三种酚类物质的含量为0.31~3.09 mg/g Extract。同一种酚类物质在不同部位的分布具有显著差异(P<0.05)。其中,咖啡酸、槲皮素-3-O-葡萄糖苷和阿魏酸均是叶含量最高,其次是花,茎最低;对于绿原酸,茎含量最高,其次是花,叶最低;木犀草素只在花中检出。本课题组的另一篇文献报道了海菜花游离酚提取物中主要含有木犀草素、木犀草素-7-O-葡萄糖苷、槲皮素-3-O-葡萄糖苷、咖啡酰苹果酸、绿原酸等酚类化合物[8],部分酚类化合物与本研究鉴定的一致,但在含量上差异较大,这可能是由于同种原料中游离酚和结合酚的种类和含量不同造成的[35]。三个不同部位总单体酚含量范围为95.22~134.82 mg/g Extract,叶最高,其次为花,茎最低,三者之间的差异具有统计学意义(P<0.05)。

表2 海菜花结合酚提取物的组成及含量Table 2 Composition and content of bound phenolics extracts from O.acuminata
2.3 抗氧化活性
海菜花不同部位结合酚的抗氧化活性见表3。由表3可知,海菜花花、茎、叶的Trolox等量抗氧化活性(TEAC)依次为 1.25±0.06、1.20±0.12、1.19±0.26 μmol TE/g Extract,不同部位之间差异无统计学意义(P>0.05);DPPH自由基清除能力依次是0.74±0.13、0.94±0.01、0.84±0.10 mmol/g Extract,三个部位之间无显著性差异(P<0.05);铁离子还原能力(FRAP)依次为 3.61±0.05、4.39±0.03、4.75±0.35 mmol Fe2+/g Extract,叶和茎的FRAP显著高于花(P<0.05);对羟基自由基(·OH)的清除活性 IC50值分别为0.70、1.26、0.34 mg/mL,抑制作用叶强于花,花强于茎,三者之间的差异具有统计学意义(P<0.05)。三者的抑制作用弱于阳性对照Trolox(IC50值2.81×10-3mg/mL)。植物多酚的抗氧化活性与酚的含量和酚类物质的种类有关[36],本研究中,4种不同的抗氧化体系研究表明,叶的抗氧化活性最强,这一结果与上述研究结果“叶中总单体酚含量最高”相一致。
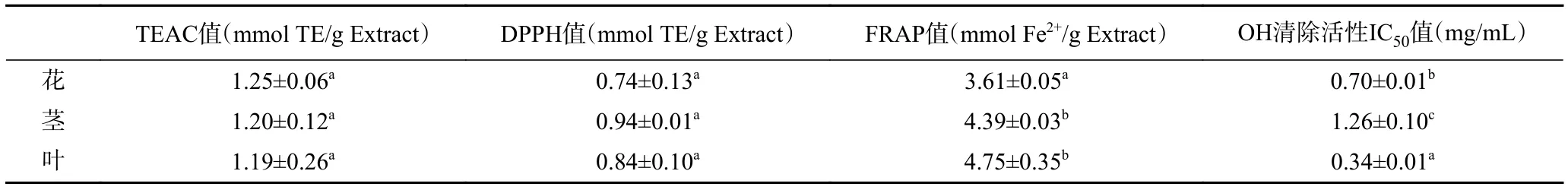
表3 海菜花结合酚提取物的抗氧化活性Table 3 Antioxidant activity of bound phenolics extracts from O.acuminata
2.4 对ROO·介导的DNA损伤的保护作用
海菜花结合酚提取物对ROO·介导的DNA损伤的保护作用见图1。由图1(左侧)电泳结果可知,第1泳道正常DNA主要以正常的双螺旋分子为主,第2泳道添加了自由基后,由于受到自由基的攻击,双螺旋DNA转变为开环或线性构象,第3~10泳道,添加了不同浓度的海菜花结合酚或VC溶液后,与第2泳道相比,双螺旋构象的DNA分子条带随结合酚或VC溶液浓度的增加逐渐增多。表明海菜花结合酚或VC对ROO·介导的DNA损伤具有明显的保护作用。图1(右侧)的半定量分析可知,在浓度12.5~500 μg/mL 范围内,VC、花、茎、叶结合酚的DNA双螺旋百分比范围依次为22.00%~48.25%、22.74%~50.07%、18.25%~53.28%、25.93%~53.60%,且大体上在12.5~100 μg/mL浓度范围内,随着浓度的增加,保护作用均逐渐增强,即保护作用呈现浓度剂量依赖关系。当叶、茎、花结合酚浓度分别为200、500、300 μg/mL时,其 DNA双螺旋百分比分别达到最大(53.60%、53.28%、50.07%),均高于阳性对照VC的最大双螺旋百分比48.25%。由此可见,对ROO·介导的DNA氧化损伤的保护作用叶>茎>花>VC。叶结合酚对DNA损伤的保护作用最强与本文上述的研究结果“叶的抗氧化活性最强、总单体酚含量最高”一致。植物多酚对DNA损伤的保护作用不但与其酚类物质的含量有关,而且与酚类物质的种类有关[37-38],叶结合酚较强的DNA损伤保护作用可能与其含有较高的咖啡酸和槲皮素素-3-O-葡萄糖苷含量也有关系。咖啡酸具有3,4-二羟基结构,可通过递氢的方式清除被氧化DNA所形成的过氧自由基,稳定氧原子上的单电子,易生成稳定的半醌式自由基[39],使得咖啡酸具有较强的清除过氧自由基的能力。据报道咖啡酸[40]、槲皮素素-3-O-葡萄糖苷[41]能有效抑制过氧自由基引起的DNA氧化损伤。
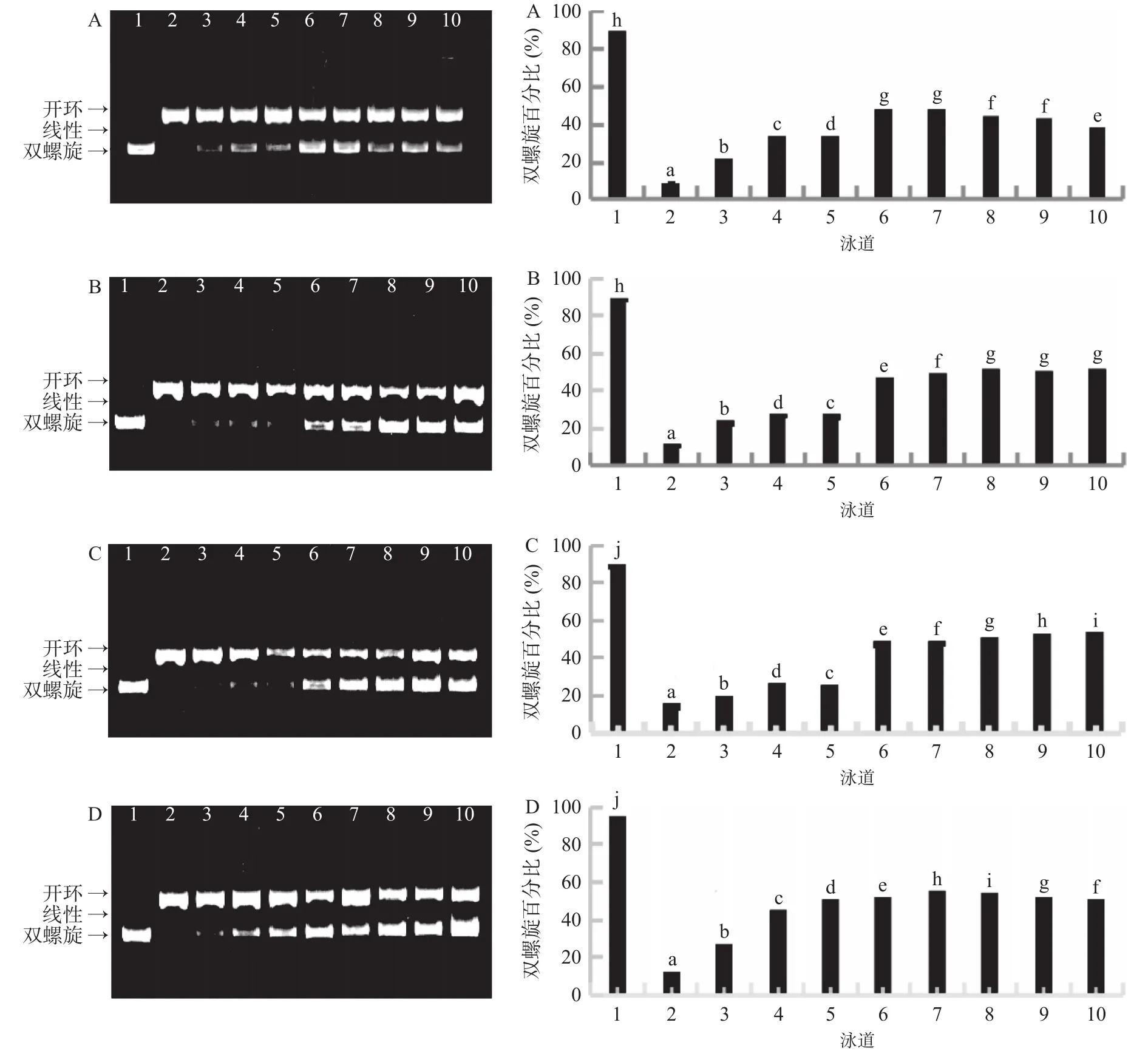
图1 海菜花结合酚提取物对DNA损伤的保护作用Fig.1 DNA damage protective effect of bound phenolics extracts from O.acuminata
3 结论
海菜花结合酚酚类化合物含量丰富,主要含咖啡酸、槲皮素-3-O-葡萄糖苷、阿魏酸、绿原酸和木犀草素5种。不同部位的酚类化合物含量和组成不同。海菜花结合酚具有较强的抗氧化活性以及对ROO·介导的DNA损伤的保护作用。其中,叶结合酚的抗氧化活性及对DNA损伤的保护作用最强。本研究可为海菜花的保护、开发和利用提供一定的理论依据。

