枸杞多糖在siNrf2胸主动脉血管内皮细胞氧化应激损伤中的作用
朱玲勤,胡小辉,高媛媛,薛姝婧,李光华,
(1.宁夏医科大学公共卫生与管理学院,银川 700004;2.宁夏医科大学基础医学院生理学系,银川 750004)
Keap1/Nrf2信号通路在机体抗氧化应激过程中具有很好的保护作用,它的激活可以使机体的氧化与抗氧化系统保持动态平衡状态。不仅如此,有研究表明[1-3],Keap1/Nrf2信号通路的激活还可在机体抗肿瘤、抗凋亡、抗炎症反应以及神经系统保护等方面发挥重要作用。但过度的氧化应激会使机体的抗氧化与氧化系统的调控失衡,致机体的内稳态遭到破坏,氧化应激对机体组织细胞的损伤作用会明显增加。
枸杞作为一种食药两用的传统中药,其自身具有润肺止咳和养肝明目等功效。枸杞多糖(lycium barbarum polysaccharide,LBP)是从枸杞子中提取的活性成分,研究[4-9]表明,LBP具有多种药理和生物活性,如抗炎、抗氧化、抗凋亡、免疫调节和其他药理作用。本课题组前期研究[10]结果表明,力竭运动会导致大鼠胸主动脉血管内皮细胞(RTAEC)损伤增加、血管顺应性降低,而LBP对大鼠胸主动脉内皮细胞损伤有一定的保护作用,但其发挥保护作用的机制如何,成为本研究的重点内容及创新点。本研究旨在探讨LBP是否通过增强心血管内皮细胞中Keap1/Nrf2抗氧化应激信号通路的表达,提高心血管内皮的抗氧化能力,改善机体的氧化应激状态,进而达到保护心血管系统的作用机制。
1 材料与方法
1.1 主要试剂与仪器
RTAEC购自上海赛齐生物工程有限公司;siRNA及荧光siRNA转染试剂盒(广州锐博生物科技有限公司);LBP(纯度90%,宁夏启元药业);血管紧张素Ⅱ(AngⅡ)、ELISA试剂盒(武汉云克隆科技股份有限公司);酶标仪(美国赛默飞世尔科技有限公司);电泳仪(美国Bio-Rad公司);化学发光成像仪[美国通用电气公司(GE)]。
1.2 细胞转染
应用小干扰RNA[siRNA(50 nmol)]转染大鼠胸主动脉内皮细胞,沉默RTAEC中的Nrf2基因。
1.2.1 转染效率的检测 荧光标记的siRNA是检测转染效率、优化转染方法最常用的一种方法,按照使用说明将产品配制成20μmol的储存液,由于荧光易于衰减,整个过程在黑暗的环境中进行。在LP2000的协助下转染带有荧光标记的siRNA(50 nmol)于内皮细胞中。具体步骤如下:(1)按照细胞传代的方法制备单细胞悬液,全自动细胞计数仪进行细胞计数,使细胞数在1×105个/mL左右,接种到24孔板,每孔100μL,然后每孔再加400μL完全培养基,最后放入培养箱培养24 h;(2)次日按照说明书稀释荧光siRNA原液:吸取30μL的无血清无双抗的培养基,向其中加入1.25μL 20μmol siRNA原液,轻晃使其混匀;(3)复合物制备:向步骤2配制成的液体中缓慢加入3μL LP2000,轻晃,静置15 min,目的是使其形成转染复合物;(4)将24孔板取出,弃去培养液,先加入465.75μL无双抗培养基,将步骤3中的复合物沿边缘缓慢加入,轻晃放入培养箱继续培养;(5)荧光显微镜下观察拍照。分为:空白对照组(RTAEC细胞不做任何处理)、阴性对照组[LP2000(LipofectamineR)(-)组,无LP2000协助,只进行荧光素Cy3标记的siRNA转染]、阳性对照组[LP2000(+)组,在LP2000协助下与荧光素Cy3标记的siRNA同时进行转染]。
1.2.2 测定最佳沉默效果分组 分为5个组分别为:空白对照组(细胞不做任何处理)、siNC组(siNC在LP2000协助下转染)、siRNA3组(siRNA3在LP2000协助下转染)、siRNA4组(siRNA4在LP2000协助下转染)、siRNA5组(siRNA5在LP2000协助下转染)。
1.2.3 沉默Nrf2基因分组 (1)空白对照组:细胞不做任何处理;(2)AngⅡ组:先用完全培养基培养细胞2 h,然后用含AngⅡ(10-6mol·L-1)的完全培养基培养细胞24 h;(3)AngⅡ+LBP组:先用含LBP(3 200μg·mL-1)的完全培养基培养细胞2 h,然后用含AngⅡ(10-6mol·L-1)的完全培养基培养细胞24 h;(4)siNC组:siNC在LP2000协助下转染;(5)siNC+AngⅡ+LBP组:siNC在LP2000协助下转染,然后用含LBP(3 200μg·mL-1)的完全培养基培养细胞2 h,然后用含AngⅡ(10-6mol·L-1)的完全培养基培养细胞24 h;(6)siRNA组:siRNA在LP2000协助下转染;(7)siRNA+AngⅡ+LBP组:siRNA在LP2000协助下转染,用含LBP(3 200μg·mL-1)的完全培养基培养细胞2 h,再用含AngⅡ(10-6mol·L-1)的完全培养基培养细胞24 h。
1.3 Western blot检测Nrf2、P-Nrf2的蛋白表达水平
对贴壁培养的细胞进行PBS清洗、胰酶消化后,进行低温高速离心,弃掉上清,加入裂解液提取蛋白,使用BCA蛋白定量试剂盒测量蛋白质浓度,完成定量,配制10%的SDS-PAGE,蛋白上样进行电泳,转膜,10%脱脂牛奶封闭1 h,PBST洗膜结束,将膜与其针对的一抗(Nrf2 1∶700)(PNrf2 1∶700)过夜,次日,复温1~2 h,用5%脱脂牛奶配制相应二抗[Goat AntiMouse IgG(1∶5 000)或Goat Anti-Rabbit IgG(1∶5 000)],进行孵育1 h,PBST清洗3次,进行条带曝光,获取蛋白免疫印迹条带图,用Image J软件进行WB灰度值量化分析计算,根据测定出的数值,以靶蛋白灰度值/管家蛋白灰度值的比值进行表示,最后应用统计软件进行统计分析。
1.4 ELISA检测GSH、丙二醛(MDA)、总抗氧化能力(T-AOC)、过氧化氢酶(CAT)的含量
在水合氯醛麻醉下,打开大鼠胸腔,用5 mL注射器从左心室取出3~5 mL血液以防止溶血。将样品转移到15 mL离心管中。30 min后,样品在4℃、5 035×g下离心。3 min后,取血清并储存于-80℃用于后续实验。收集细胞上清液,在4℃下以5 035×g离心3 min,并在-80℃下储存用于测试。将标准品和样品装入酶板,在37℃下孵育1 h。洗涤后,将底物溶液装入板中,于37℃下避光孵育15 min。将终止溶液装入板中后测量450 nm处的光密度(OD)值并计算样品浓度:用标准品及样本OD值作图,如设置复孔,则应取其平均值计算。以标准品的浓度为纵坐标(对数坐标),OD值为横坐标,在半对数坐标纸上绘出标准曲线(最佳方程式应依回归方程计算的R2值来定,以R2值越趋近于1为好)。根据样品OD值,由标准曲线查出相应的浓度,乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.5 RT-qPCR检测Nrf2基因表达水平
收集单层培养的细胞提取RNA,1 000 r·min-14℃离心5 min,弃掉上清,依次加RZ裂解液、氯仿、乙醇、去蛋白液RD、乙醇漂洗液RW,最后加入50μL无酶水,放置2~3 min后,12 000·min-14℃离心2 min。为防止降解速度过快,将提取的RNA原液在-80℃保存,备用。将原液取出制备cDNA,测定浓度及纯度的测定,八连管中加样,上机检测;先加水,依次为Mix,最后加RNA原液;反转录反应时间和温度条件如下:37℃下15 min(反转录反应),85℃下5 s(反转录酶的失活反应),4℃无限循环;将反转录产物做好标记放入-80℃冰箱保存。将RT反应液取出进行扩增,离心备用;进行引物的溶解,向八连管中加样,先加水,依次为RT反应液、前向引物、反向引物,最后加TB;加样完毕,轻柔混匀后上机进行反应,条件如下(表1):反应结束,第一步计算△Ct=Ct(目的)-Ct(内参);第二步计算△△Ct=△Ct(样本)-△Ct(对照);最后按照2-△△Ct计算目的基因mRNA表达水平。

表1 qPCR扩增反应条件
1.6 统计学方法
采用SPSS 22.0统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析。检验水准α=0.05。
2 结果
2.1 转染效率的检测
结果显示,带有荧光标记的siRNA与RTAEC共同培养24 h后,在转染浓度50 nmol时,内皮细胞中带有荧光标记的siRNA表达最高,表明后续相关转染实验均以此条件为标准进行。图1暗场显示siRNA转染成功的细胞,在荧光显微镜下观察到的带有红色荧光。明场显示透光显微镜下的总细胞。由此可计算出转染效率,即暗场中的红色细胞/明场中总细胞数的百分比。计算结果表明,本次转染实验的转染效率为80%以上,可以满足并进行后续相关实验。
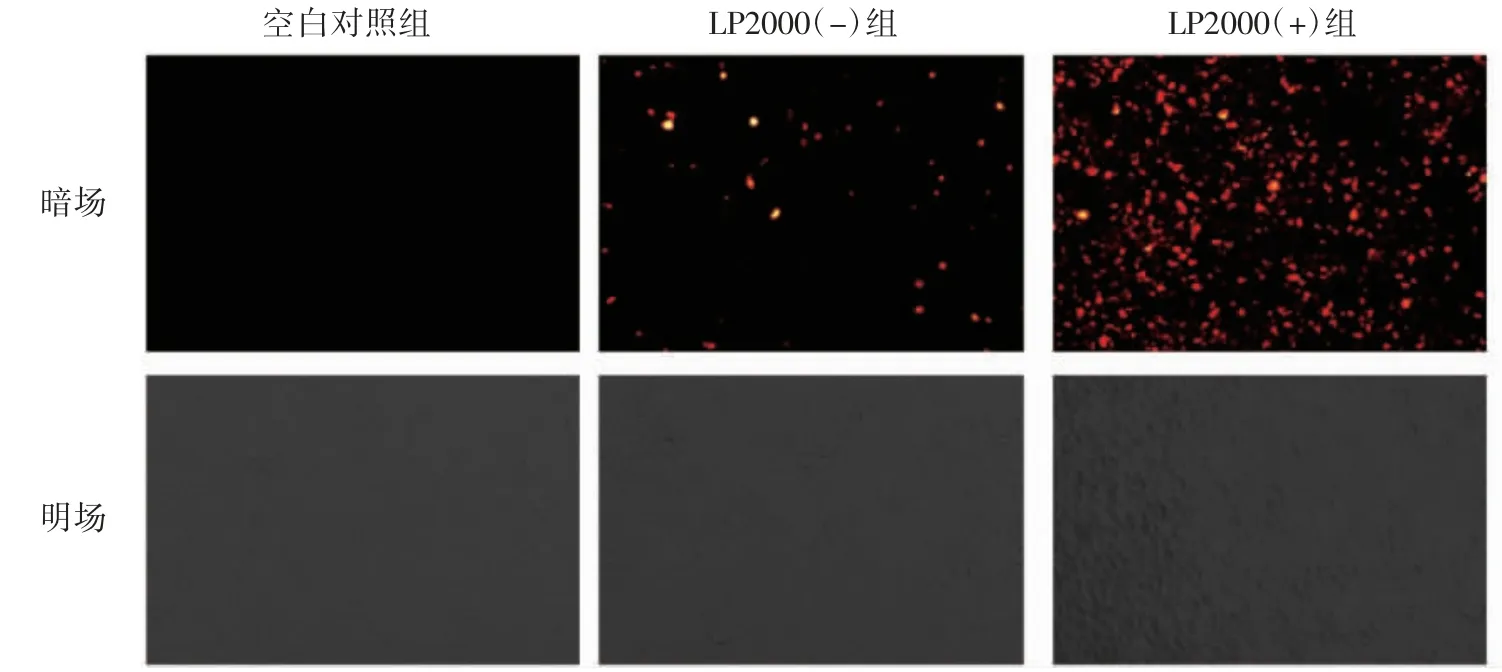
图1 转染效率的检测结果(×400)
2.2 Nrf2、P-Nrf2蛋白表达、磷酸化及基因表达水平
图2结果显示,与空白对照组比较,siRNA5组的Nrf2蛋白表达水平降低(P<0.05),与siNC比较,siRNA5组的Nrf2蛋白表达降低(P<0.05),且siRNA3磷酸化Nrf2(P-Nrf2)的蛋白表达水平降低(P<0.05),siRNA5组的P-Nrf2的蛋白表达水平降低(P<0.01)。与空白对照组比较,siRNA3组、siRNA4组及siRNA5组的Nrf2的mRNA表达均降低(P均<0.05)。
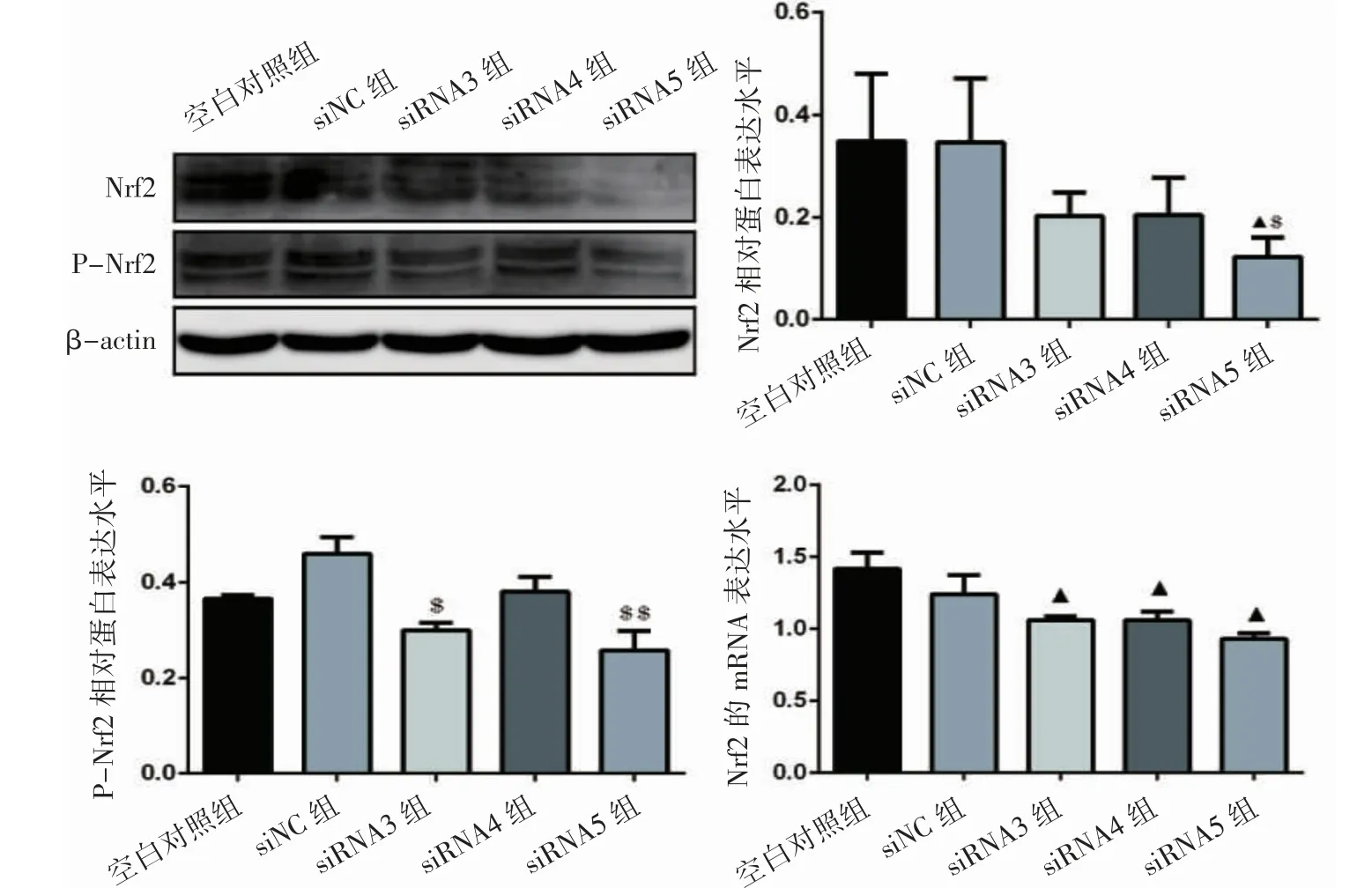
图2 Nrf2、P-Nrf2蛋白表达、磷酸化及基因表达水平
2.3 Nrf2沉默对RTAEC中Nrf2、P-Nrf2表达的影响
图3结果显示,与AngⅡ+LBP组比较,siNC+AngⅡ+LBP组的Nrf2蛋白表达水平下降(P<0.05)。2.4 Nrf2沉默对LBP降低RTAEC上清液中GSH、MDA、T-AOC、CAT的含量的影响
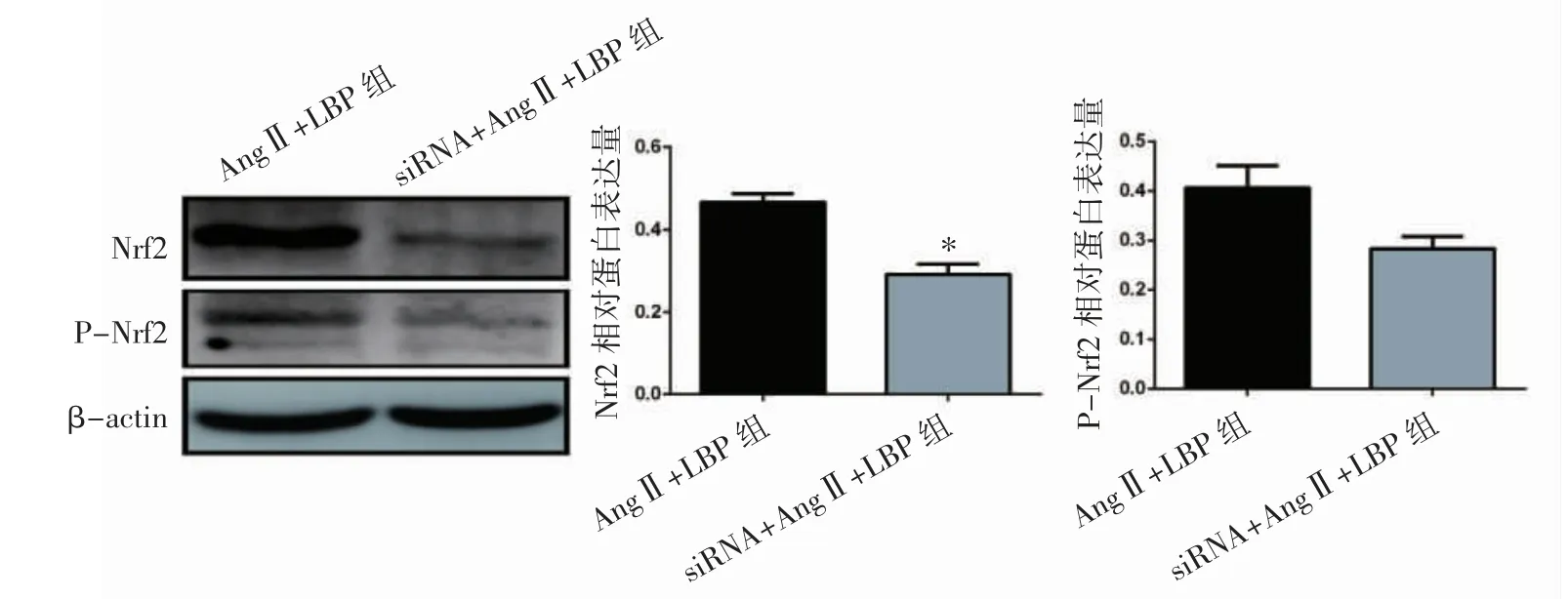
图3 siNrf2对RTAEC中Nrf2、P-Nrf2表达的影响
图4结果显示,与空白对照组比较,AngⅡ组CAT、T-AOC表达水平降低(P均<0.05)。与AngⅡ组比较,AngⅡ+LBP组CAT、T-AOC、GSH表达水平升高(P均<0.05)。与AngⅡ+LBP组比较,siRNA+AngⅡ+LBP组的CAT、T-AOC、GSH表达水平降低(P均<0.01),MDA的表达水平升高(P<0.05)。与siNC组比较,siNC+AngⅡ+LBP组MDA表达水平下降(P<0.05),T-AOC表达水平升高(P<0.05)。与siNC+AngⅡ+LBP组比较,siRNA+AngⅡ+LBP组GSH表达水平下降(P<0.05)。

图4 siNrf2对LBP降低RTAEC上清液中GSH、MDA、T-AOC、CAT含量的影响
3 讨论
心血管系统氧化应激损伤主要表现为内皮细胞形态和功能的改变,同时,也是多种心血管疾病发生与演变的开始。内皮细胞不仅是心血管系统的屏障,还具有强大的内分泌功能,参与各种生化和生物力学信号传导,当机体在各种内外环境不利因素的刺激下,机体会产生大量应激激素及其氧化代谢产物,从而影响血管内皮的形态及功能,表现出血管张力受损、血压及凝血机能失衡,从而促进了血管疾病的发生与发展。研究[11]表明,机体氧化应激所致的内皮细胞损伤是心血管疾病发生的重要机制之一。
课题组前期研究[12]结果表明,氧化应激状态下,大鼠血液中AngⅡ的水平显著升高,且大鼠胸主动脉血管对去甲肾上腺素(NE)的反应性明显增加,而LBP有很好的干预逆转作用。那么,LBP在上述研究中所表现的对心血管系统的保护作用是否与内皮细胞之间存在某种密切联系。因此,课题组前期进行了实验研究:当机体遭受体内外各种应激(压力、手术、创伤、疼痛、剧烈运动等)刺激时,心血管系统血液循环状态会产生一系列变化,如血流速度加快,对心血管内皮细胞冲击作用增强,使其发生损伤、脱落,导致心血管系统的异常改变,而LBP通过提高胸主动脉内皮细胞中的抗氧化应激信号通路的蛋白表达水平,来增强机体内皮抗氧化能力,进而改善心血管系统的抗氧化应激状态起到保护心血管系统的作用。
因此,本研究以AngⅡ制备细胞氧化应激模型,通过沉默RNA技术降低Nrf2的表达水平。结果发现,与空白对照组比较,AngⅡ组的T-AOC、CAT表达水平降低。与AngⅡ组比较,AngⅡ+LBP组GSH、CAT、T-AOC表达水平升高。与AngⅡ+LBP组比较,siRNA+AngⅡ+LBP组的GSH、CAT、T-AOC表达水平均降低,MDA的表达水平升高。表明LBP减轻机体内皮细胞的氧化应激状态可能是通过增强Nrf2蛋白表达水平来实现的。
综上所述,本课题通过前期的体内实验表明,LBP对抗应激状态、保护心血管机能是通过改善内皮细胞的抗氧化应激系统中Keap1/Nrf2的抗氧化应激蛋白表达水平来实现的,以及本次研究中的体外细胞实验的结果表明,LBP对抗AngⅡ所产生的应激状态,很可能是通过提高抗氧化应激系统中的Nrf2蛋白表达水平来实现的,进而提高内皮细胞的抗氧化应激的能力,缓解机体的氧化应激状态和血管心肌的损伤,最终起到保护心血管系统的功能,相关机制的明确还需今后在蛋白、分子水平进一步探讨。

