低水平林丹暴露对大鼠卵巢及子宫功能形态的影响
苏瑀晗,曹红亭,孙祖越,周 莉,周 健,汪 岭,李晓玉,宋琦如
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.上海市计划生育科学研究所药理毒理学研究室,上海 200032)
林丹(又称γ-六六六)是有机氯农药六六六的γ异构体,也是国际上公认的环境内分泌干扰物[1],曾被广泛用于除草剂和杀虫剂。目前,林丹虽禁止用于农业用途,但仍被用作疥疮和虱子的药物治疗,且由于其高脂溶性、难降解、易残留等特点,至今仍能在土壤、水体等环境介质中检测到林丹残留[2-3],林丹的特性也导致它们在环境中持久存在,并通过食物链的生物放大作用在人体内蓄积[4-5]。因此,环境中残留的低水平林丹仍有可能对人体和环境产生不良影响。研究[6-7]表明,林丹等有机氯农药会对生殖激素的分泌及代谢产生影响,导致生殖功能紊乱。林丹还具有内分泌干扰作用,可能与女性子宫内膜异位症、子宫癌、卵巢癌发生的增加有关。林丹残留具有潜在危害,因此研究环境中残留的低水平林丹对生殖毒性的作用具有现实意义。本实验旨在研究低水平林丹暴露对于雌性成年大鼠体质量、器官系数、雌性激素分泌水平以及卵巢及子宫形态的影响,探讨林丹对雌性生殖器官形态及功能的综合影响,为评价林丹的毒理学作用及环境中林丹残留对人类生殖系统潜在危害提供理论依据。
1 资料与方法
1.1 实验材料
1.1.1 主要试剂与仪器 林丹(批号:C14073000,Dr.Ehrenstorfer GmbH)、雌二醇(货号:mx1704091,北京biotopped公司)、玉米油(市售)、10%水合氯醛(货号:mx150204,北京索莱宝公司)、多聚甲醛固定液(上海尚宝生物科技有限公司)、孕酮(P)试剂盒(货号:XYR9700821,上海大实验室)、促性腺激素释放激素(GnRH)试剂盒(货号:mx175223,上海大实验室)、卵泡刺激素(FSH)试剂盒(货号:mx1653,上海大实验室)。离心机(上海Heal force公司)、图像采集系统显微镜(德国Leica公司)、分析天平(瑞士Mettler Toedo公司)。
1.1.2 实验动物 选择健康清洁级周龄雌性SD大鼠45只,体质量180~200 g,购于宁夏医科大学实验动物中心,动物许可证号:SCXK(宁)2020-0001。各组大鼠饲养环境温度为20~24℃,相对湿度为60%~80%,自由摄食进水。
1.2 实验方法
1.2.1 动物分组及染毒 实验大鼠经适应性饲养1周后,按照随机化原则分为5组(n=9)。依据陈心悦等[8]的研究(我国七大水系沉积物中林丹残留浓度约为2μg·g-1)将实验组分别设为林丹低剂量组(3 mg·kg-1,1/40LD50)、中剂量组(6 mg·kg-1,1/20LD50)、高剂量组(13 mg·kg-1,1/10LD50)。参考曹红亭等[7]、宋琦如等[9]文献,将雌二醇设为阳性对照组(100μg·kg-1)、玉米油设为溶剂对照组(10 mg·kg-1),将林丹及雌二醇溶于玉米油配制成相应溶剂,每天经口灌胃染毒1次,连续染毒8周。
1.2.2 体质量及器官系数测定 大鼠处死前称重,10%水合氯醛麻醉后处死。无菌条件下,剖腹取子宫和卵巢,剔除脂肪组织,将分离的组织于生理盐水中洗净、滤纸吸干,记录器官湿重,计算器官系数。器官系数的计算公式:器官系数(%)=器官湿重(g)/体质量(g)×100%。
1.2.3 血清性激素水平的测定 染毒末,称量体质量,依据体质量计算10%水合氯醛麻醉剂量。麻醉后开胸腔取心尖血,经3 500 r·min-1离心10 min后,取上清液置于-80℃保存。使用酶联免疫吸附试剂盒检测血清中GnRH、FSH、P水平,具体操作依据试剂盒说明书进行。
1.2.4 子宫和卵巢组织病理学观察 将离体的大鼠子宫及两侧卵巢于4%多聚甲醛固定液中放置24 h后,经脱水、包埋,行5μm切片,HE染色后置于光镜下观察其组织形态变化。
1.3 统计学方法
采用SPSS 23.0统计学软件进行数据分析。数据以均数±标准差(±s)表示,对数据进行正态性检验和方差齐性检验,多组比较采用单因素方差分析,多重比较用LSD-t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 一般情况
实验期间未出现大鼠死亡现象。溶剂对照组大鼠状态良好、被毛光滑、食欲较好、无异常现象;实验组大鼠随染毒时间增加出现烦躁、被毛凌乱失去光泽等现象,高剂量组表现尤为明显;阳性对照组大鼠也出现烦躁不安、被毛凌乱等现象,程度与林丹高剂量组相似。
2.2 体质量
林丹各剂量组大鼠体质量增长量与阳性对照组相比差异均无统计学意义(P均>0.05);林丹低剂量组大鼠体质量增长量与溶剂对照组相比差异无统计学意义(P>0.05),但林丹中、高剂量组大鼠体质量增长量均低于溶剂对照组(P均<0.05),见表1。
表1 林丹暴露对雌性大鼠体质量的影响(±s,g)
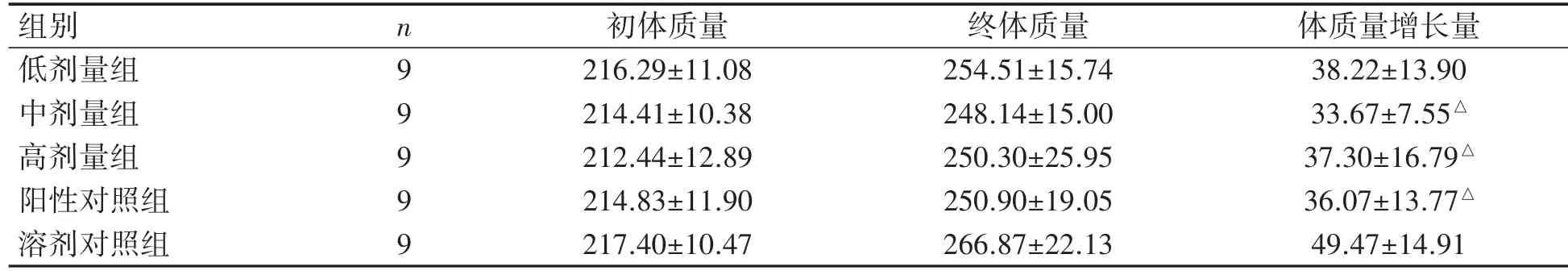
表1 林丹暴露对雌性大鼠体质量的影响(±s,g)
与溶剂对照组比较△P<0.05。
组别 n 初体质量 终体质量 体质量增长量低剂量组 9 216.29±11.08 254.51±15.74 38.22±13.90中剂量组 9 214.41±10.38 248.14±15.00 33.67±7.55△高剂量组 9 212.44±12.89 250.30±25.95 37.30±16.79△阳性对照组 9 214.83±11.90 250.90±19.05 36.07±13.77△溶剂对照组 9 217.40±10.47 266.87±22.13 49.47±14.91
2.3 卵巢及子宫器官系数
林丹各剂量组大鼠子宫、卵巢质量及子宫、卵巢系数与溶剂对照组和阳性对照组相比差异均无统计学意义(P均>0.05),见表2。
表2 林丹暴露对雌性大鼠子宫及卵巢系数的影响(±s)
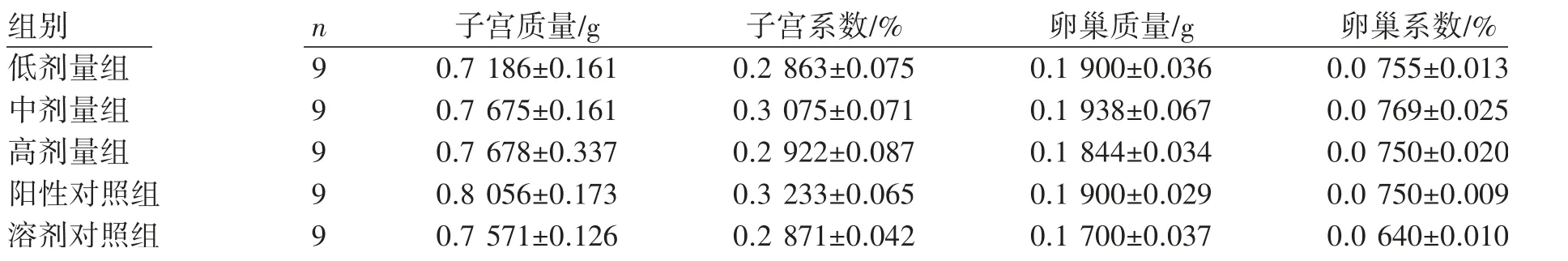
表2 林丹暴露对雌性大鼠子宫及卵巢系数的影响(±s)
组别 n 子宫质量/g 子宫系数/% 卵巢质量/g 卵巢系数/%低剂量组 9 0.7 186±0.161 0.2 863±0.075 0.1 900±0.036 0.0 755±0.013中剂量组 9 0.7 675±0.161 0.3 075±0.071 0.1 938±0.067 0.0 769±0.025高剂量组 9 0.7 678±0.337 0.2 922±0.087 0.1 844±0.034 0.0 750±0.020阳性对照组 9 0.8 056±0.173 0.3 233±0.065 0.1 900±0.029 0.0 750±0.009溶剂对照组 9 0.7 571±0.126 0.2 871±0.042 0.1 700±0.037 0.0 640±0.010
2.4 各组大鼠血清性激素水平的变化
林丹各剂量组血清GnRH、FSH、P激素分泌水平均低于溶剂对照组(P均<0.05);林丹各剂量组血清GnRH、FSH、P激素分泌水平与阳性对照组相比差异均无统计学意义(P均>0.05),见表3。
表3 林丹暴露对大鼠血清GnRH、FSH、P浓度的影响(±s)
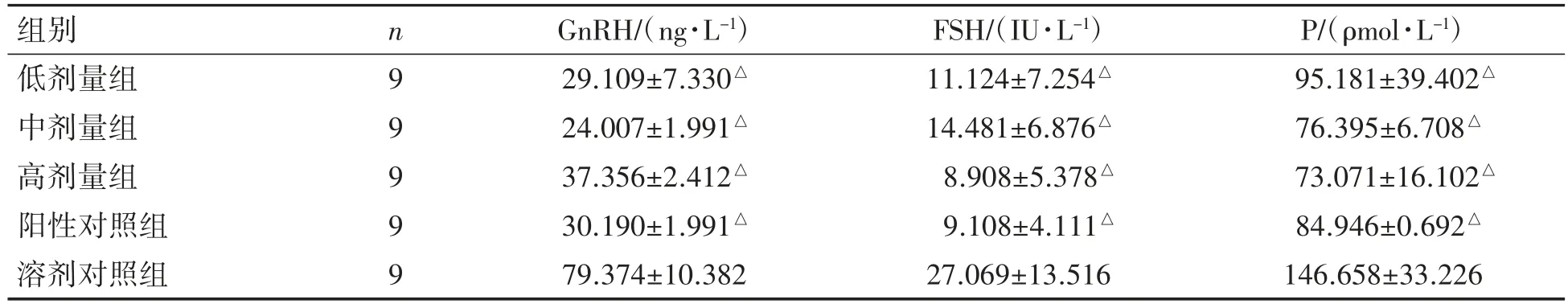
表3 林丹暴露对大鼠血清GnRH、FSH、P浓度的影响(±s)
与溶剂对照组比较△P<0.05。
组别 n GnRH/(ng·L-1) FSH/(IU·L-1) P/(ρmol·L-1)低剂量组 9 29.109±7.330△ 11.124±7.254△ 95.181±39.402△中剂量组 9 24.007±1.991△ 14.481±6.876△ 76.395±6.708△高剂量组 9 37.356±2.412△ 8.908±5.378△ 73.071±16.102△阳性对照组 9 30.190±1.991△ 9.108±4.111△ 84.946±0.692△溶剂对照组 9 79.374±10.382 27.069±13.516 146.658±33.226
2.5 卵巢及子宫组织形态学变化
HE染色镜下观察,溶剂对照组卵巢组织发育完整,可见各级卵泡。溶剂对照组可见卵泡颗粒细胞结构完整,排列紧密,胞核大小均一。林丹染毒组可见卵泡结构受损、闭锁卵泡明显增多、颗粒细胞数量减少、排列稀疏、胞核大小不一且伴有不同程度损伤,随着染毒剂量升高,各级卵泡损伤越发明显。阳性对照组卵泡损伤程度与林丹高剂量组相似,见图1。
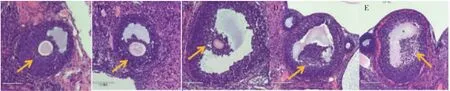
图1 各组大鼠卵巢中卵泡及颗粒细胞形态学变化(HE×200)
HE染色镜下观察,溶剂对照组子宫组织形态正常,子宫内膜、肌层及外膜组织结构清楚,上皮细胞排列紧密,胞核大小均一。可见林丹染毒组中除低剂量组均有明显程度的损伤。子宫内膜出现不同程度的胞核假复层现象,上皮组织增生,上皮细胞排列不均,胞核大小不一,并且随染毒剂量升高,子宫上皮出现腺体数量减少,见图2。
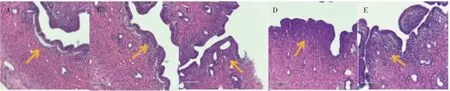
图2 各组大鼠子宫内膜上皮细胞形态学变化(HE×200)
3 讨论
体质量是反映处理因素对动物影响的综合指标。研究发现,林丹作为环境内分泌干扰物,可影响动物食欲,使体质量降低,生长发育缓慢,尤其对动物早期的生长发育影响较大[9]。器官系数是一个较为灵敏的客观指标,能够反映毒物对动物靶器官的综合毒性[10]。通过计算子宫及卵巢的器官系数可以体现林丹对生殖器官的毒性作用。本实验研究结果表明,林丹中、高剂量组、阳性对照组大鼠体质量与溶剂对照组相比差异有统计学意义,推测林丹通过干扰动物食欲,从而使动物体质量下降。
卵巢的主要功能是通过下丘脑-垂体-性腺轴调节,合成并分泌性激素。其中下丘脑分泌GnRH调控垂体的分泌功能,FSH及P对排卵及卵泡生长发育等内分泌活动进行调控[10]。本实验研究结果表明,林丹暴露可使血液中GnRH、FSH、P激素分泌水平发生变化,且FSH、P激素分泌水平随着染毒剂量增加而下降。有文献[11]报道,林丹可使血清中促黄体生成素(LH)浓度升高,提示其具有干扰性激素作用,为本实验研究结果提供一定支持。在本实验中,林丹与雌二醇的激素分泌干扰作用水平相当。
卵巢作为林丹的靶器官之一,林丹的外源性暴露会导致各级卵泡发育不良,对卵泡发育、排卵以及激素分泌等多种内分泌过程产生不良影响[12],促进闭锁卵泡的形成,使卵泡细胞失去再生能力,进而消耗卵泡储备,导致原发性卵巢功能不全[13-15]。子宫作为繁育子代和产生月经的场所,正常状态下,其内膜呈周期性变化。林丹外源性暴露会造成子宫内膜形态及功能的异常变化,进而诱导子宫内膜异位症发生[12]。本实验研究结果表明,低水平林丹暴露会导致大鼠各级卵泡结构受损、闭锁卵泡增加、子宫内膜增厚、腺体萎缩减少,造成子宫及卵巢的组织形态损伤,进而干扰其内分泌功能。
颗粒细胞是卵巢的主要功能单位,对卵泡的发育有重要影响,且其功能状态直接影响卵泡的生长启动、发育、黄体形成等卵巢活动[10]。研究[16]表明,正常状态下卵巢颗粒细胞的凋亡与再生处于平衡状态,共同维持卵巢内环境的稳定。当受到林丹外源性暴露时,卵巢内环境平衡被打破,可能造成机体损害或疾病发生。通过观察闭锁卵泡的超微结构,发现细胞凋亡的特征结构为卵泡细胞中存在卵泡空泡、染色质浓集、凋亡小体等形态改变[17]。因此,将卵泡闭锁视为卵巢颗粒细胞凋亡的结果[18-20]。在本实验中,通过对比观察各组间卵巢组织HE染色切片中闭锁卵泡的数量,发现随着暴露剂量增加,林丹低、中、高剂量组中闭锁卵泡数量也逐渐增加,因而推测低水平林丹暴露会诱导颗粒细胞走向凋亡。
本实验中,低水平林丹暴露引起血清性激素GnRH、FSH、P分泌水平下降,使子宫、卵巢等生殖器官发生组织形态及功能改变。表明低水平林丹暴露可对雌性大鼠生殖系统造成一定损害,林丹可能通过诱导颗粒细胞凋亡,进而引起生殖系统损伤,其具体机制有待进一步研究。

