硒化大蒜多糖对小鼠腹腔巨噬细胞功能的影响
邱树磊,陈晓兰,杨海峰,陈玉库,胡元亮,高永旭,武彩红
(1.江苏农牧科技职业学院,泰州 225300;2.南京农业大学,南京 210095)
天然植物中的多糖具有增强巨噬细胞活性并促进巨噬细胞分泌生物活性因子的功能[1-2]。硒作为动物代谢的必需微量元素,在抗氧化、增强免疫、抗肿瘤等方面发挥着重要的作用[3]。研究发现,对多糖进行适当的分子修饰可以提高中药多糖的免疫增强活性和抗病毒、抗氧化活性等[4]。尤其是近年来通过化学修饰方法得到的硒化多糖备受关注,因其与亚硒酸钠等无机硒相比,不仅兼具硒和多糖的双重功效,还克服了硒难以吸收、毒性蓄积等弊端,且生物活性高于硒和多糖[5]。南京农业大学中兽医实验室前期研究证实,经硝酸-亚硒酸钠进行硒化修饰得到的硒化大蒜多糖sGPS3、sGPS5和sGPS6的免疫增强活性较好,能提高鸡外周血淋巴细胞的增殖能力及鸡新城疫疫苗的免疫效果[6-7]。目前,对硒化大蒜多糖免疫调节作用的研究多集中在其对抗体水平和外周血淋巴细胞等免疫指标的影响方面,而对硒化大蒜多糖的具体免疫调节机制研究较少。
巨噬细胞具有识别异物、吞噬病原体、捕获抗原、分泌多种活性因子等功能,是动物体非常重要的一种免疫活性细胞,在免疫系统中发挥重要作用,在细胞免疫学和分子免疫学等免疫调节机制的研究中备受关注,其中小鼠腹腔巨噬细胞具有容易获得、便于培养、操作简单等优点而成为常用的细胞模型[8-10]。为进一步揭示硒化大蒜多糖的免疫调节机制,本研究以小鼠腹腔巨噬细胞为研究对象,以可以激活巨噬细胞的脂多糖(LPS)为对照,通过中性红法、CCK-8法分别检测sGPS3、sGPS5和sGPS63种硒化大蒜多糖对小鼠腹腔巨噬细胞吞噬功能及増殖能力的影响,检测了活性最好的硒化大蒜多糖对巨噬细胞上清液中一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)、白介素-1β(IL-1β)、白介素-6(IL-6)、白介素-12(IL-12)含量的影响,通过小鼠腹腔巨噬细胞吞噬鸡红细胞实验、小鼠碳粒廓清实验测定其吞噬指数与吞噬百分率,以明确硒化大蒜多糖对小鼠腹腔巨噬细胞功能的影响,为硒化大蒜多糖的作用挖掘和临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 硒化大蒜多糖制备 大蒜购自泰州某农贸市场,产地山东。将大蒜通过水提醇沉、去蛋白、过DEAE-52纤维素柱后得到大蒜多糖(GPS,糖含量为94.5%),再根据Qiu等[6]的方法用硝酸-亚硒酸钠对大蒜多糖进行硒化修饰,其中,sGPS3反应条件:每500 mg GPS,加亚硒酸钠400 g,于50 ℃条件下反应10 h;sGPS5反应条件:每500 mg GPS,加亚硒酸钠300 g,于70 ℃条件下反应10 h;sGPS6反应条件:每500 mg GPS,加亚硒酸钠400 g,于70 ℃条件下反应6 h。
1.1.2 主要试剂及仪器 PBS、RPMI 1640培养液、0.09%中性红溶液、6%淀粉肉汤、10 μg/mL LPS均参考赵晓娟[11]的方法进行配制;RPMI 1640培养基购自Gibco公司;中性红、LPS均购自Sigma公司;胎牛血清(FBS)购自杭州四季青生物有限公司;亚硒酸钠购自上海凌峰化学试剂有限公司;CCK-8购自北京索莱宝科技有限公司;细胞因子TNF-α、IFN-γ、IL-1β、IL-6、IL-12 ELISA试剂盒购自R&D公司。电子天平(FA1104N)购自上海精密科学仪器有限公司;倒置显微镜(TS-100)购自Nikon公司;CO2培养箱(SC010W-2)购自Revco公司;酶标仪(DG-3022)购自国营华东电子管厂。
1.1.3 试验动物 200只清洁级ICR小鼠,4~6周龄,体重(20±2) g,雌雄各半,购自江苏农牧科技职业学院实验动物中心。
1.2 方法
1.2.1 小鼠腹腔巨噬细胞的制备 参考潘维华等[12]的方法于试验前3 d在小鼠腹腔中央与右后肢连线的中点处注射6%淀粉肉汤1 mL。3 d后,颈椎脱臼法处死小鼠,用75%酒精浸泡5 min。在超净台内,于小鼠下腹部剪开一小口,撕开皮肤,完全暴露腹膜,向腹腔注射PBS 5 mL,轻揉腹部5 min后,打开腹腔,将内脏推向一侧,用吸管回收腹腔液于离心管中,用同体积的PBS冲洗腹腔2次,合并腹腔液,1 000 r/min离心8 min,弃上清,细胞用PBS洗涤2次,加入含10% FBS的RPMI 1640培养液调整细胞密度为2.5×106/mL,加入96孔板,每孔100 μL。5% CO2培养箱38 ℃贴壁培养3 h。
1.2.2 硒化大蒜多糖对小鼠腹腔巨噬细胞吞噬功能的影响 参考Adel[13]的方法,以硒化大蒜多糖对小鼠腹腔巨噬细胞的最大安全浓度为起始浓度,用无血清的RPMI 1640培养液倍比稀释为100、50、25、12.5、6.25 μg/mL 5个浓度,在预先加入100 μL 2.5×106/mL小鼠腹腔巨噬细胞的96孔板中,每孔加入100 μL各浓度的sGPS3、sGPS5、sGPS6,另设10 μg/mL LPS组(LPS,加LPS 100 μL)和细胞对照组(CC,加培养液100 μL),每组4个重复孔,5% CO2培养箱38 ℃培养48 h,弃上清,每孔加入终浓度为0.09%的中性红溶液100 μL,反应4 h后,在显微镜下观察巨噬细胞的形态变化,然后用PBS洗细胞3次,加入100 μL二甲基亚砜,静置过夜,用酶标仪检测A490 nm值。
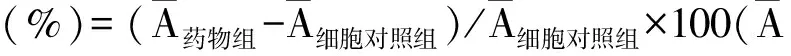
1.2.4 硒化大蒜多糖对小鼠腹腔巨噬细胞分泌NO及细胞因子的影响 通过1.2.2和1.2.3筛选出活性最好的硒化大蒜多糖。用100、50、25、12.5、6.25 μg/mL活性最好的硒化大蒜多糖按照1.2.2细胞分组方法处理细胞,5% CO2培养箱38 ℃培养48 h后,小心吸取细胞上清,分别收集于EP管中,置于-70 ℃保存待测。 按照ELISA试剂盒说明书分别检测上清中NO、TNF-α、IFN-γ、IL-1β、IL-6和IL-12含量。
1.2.5 硒化大蒜多糖对体内巨噬细胞吞噬功能的影响 将160只小鼠随机均分成4组,参考刘奇等[15]、乌英等[16]的方法,分别灌胃高(2 mg/mL)、中(1 mg/mL)、低剂量活性最好的硒化大蒜多糖(0.5 mg/mL)和生理盐水(空白对照组)0.5 mL,1次/d,连续5 d。在试验第6天,每组随机抽取10只经尾静脉注入用生理盐水稀释3倍的印度墨汁,按每克体重0.01 mL计算,于注入后2和10 min分别从内眦静脉丛采血20 μL,并将其加到2 mL 0.1% NaCO3溶液中,用分光光度计测定其在D600 nm值。采血后,处死小鼠,取出肝脏和脾脏,称重,计算吞噬指数A。
式中,t1为第1次采血时间;t2为第2次采血时间;D1为第1次血液的D600 nm值,D2为第2次血液的D600 nm值
同时,在试验第6天,每组随机抽取10只小鼠,腹腔注射20%(V/V)鸡红细胞悬液1 mL,30 min后处死,然后注入2 mL生理盐水,取腹腔液滴片,37 ℃温箱孵育30 min,用1∶1(V/V)甲醇和丙酮进行固定,Giemsa染色,体视显微镜下镜检,计数100个巨噬细胞,计算吞噬率及吞噬指数B。
吞噬指数B=被吞噬的鸡红细胞总数/100
吞噬率(%)=(吞噬鸡红细胞的巨噬细胞数/100)×100%
1.3 数据统计与分析
用SPSS 18.0软件进行单因素方差分析(One-Way ANOVA),Duncan氏法进行多重比较,结果用平均值±标准差表示。P<0.05表示差异显著。
2 结 果
2.1 硒化大蒜多糖对小鼠腹腔巨噬细胞吞噬功能的影响
由表1可知,3种硒化大蒜多糖中,除6.25 μg/mL sGPS3组外,100、50、25、12.5、6.25 μg/mL sGPS3、sGPS5和sGPS6组的A490 nm值均显著大于对照组(P<0.05),其中6.25~50 μg/mL sGPS6组A490 nm值均显著高于sGPS3和sGPS5组(P<0.05),50~100 μg/mL sGPS6组A490 nm值显著高于LPS组(P<0.05)。
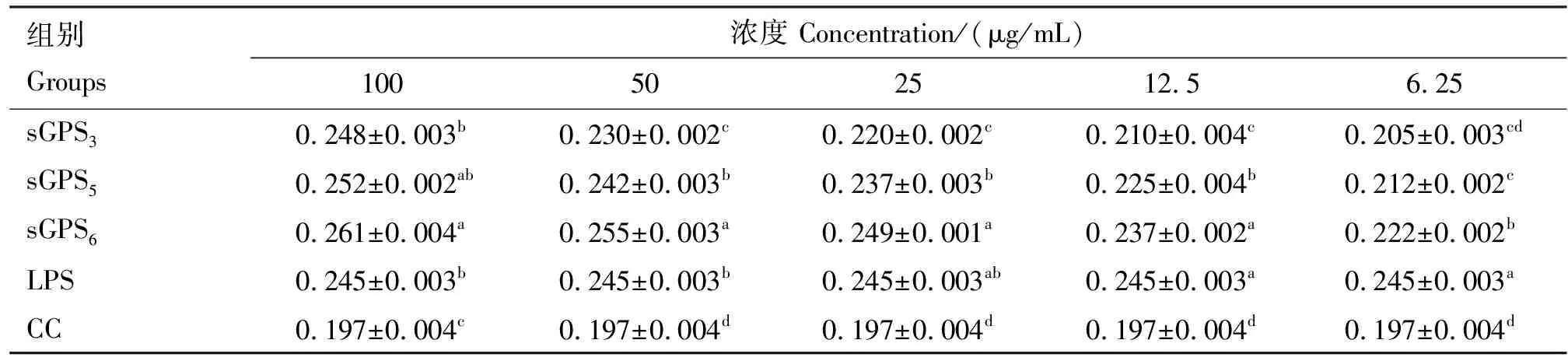
表1 各组巨噬细胞A490 nm值
2.2 硒化大蒜多糖对小鼠腹腔巨噬细胞增殖能力的影响
由表2可知,100、50、25、12.5、6.25 μg/mL sGPS3、sGPS5和sGPS6组A450 nm值均显著大于对照组(P<0.05),其中sGPS6组所有浓度A450 nm值均显著高于sGPS3和sGPS5组(P<0.05);6.25~25 μg/mL sGPS3组、sGPS5组的A450 nm值显著低于LPS组(P<0.05);100 μg/mL sGPS5组、50~100 μg/mL sGPS6组的A450 nm值显著高于LPS组(P<0.05)。
各浓度范围sGPS3、sGPS5、sGPS6组的小鼠腹腔巨噬细胞增殖率见图1。由图1可知,在6.25~12.5 μg/mL时,sGPS3、sGPS5、sGPS6组的小鼠腹腔巨噬细胞增殖率均显著低于LPS组(P<0.05),sGPS3、sGPS5、sGPS63组之间差异均显著(P<0.05),sGPS6组最高,其次为sGPS5和sGPS3组;在25 μg/mL时,sGPS3、sGPS5组的巨噬细胞增殖率均显著低于LPS组(P<0.05),sGPS6组与LPS组差异不显著(P>0.05);在50 μg/mL时,sGPS6组的巨噬细胞增殖率均显著高于其余各组(P<0.05),sGPS3、sGPS5、LPS组之间差异不显著(P>0.05);在100 μg/mL时,sGPS5、sGPS6组的巨噬细胞增殖率均显著高于LPS组(P<0.05),sGPS3与LPS组差异不显著(P>0.05)。
通过以上硒化大蒜多糖对小鼠腹腔巨噬细胞吞噬功能和增殖能力的结果,确定选择活性最好的sGPS6用于后续试验。
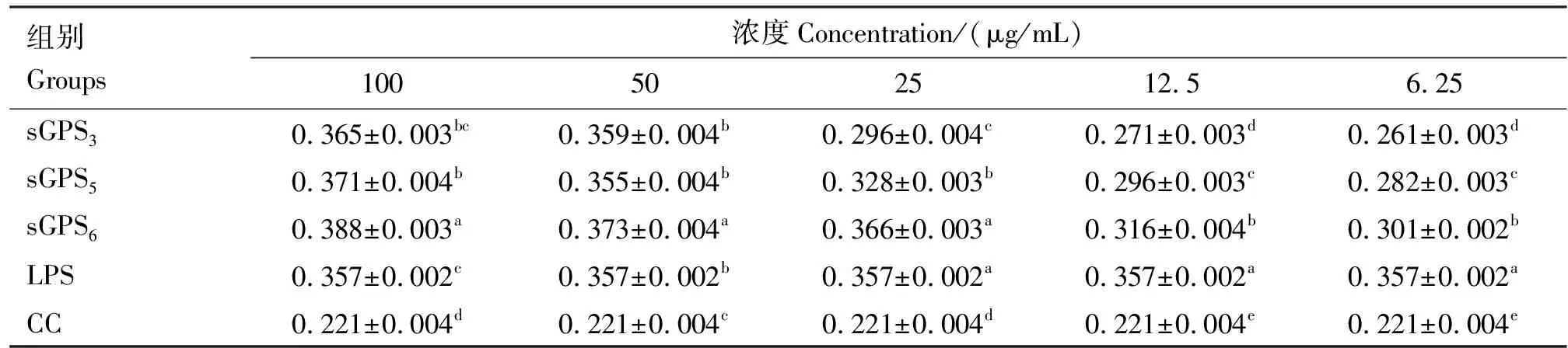
表2 各组巨噬细胞A450 nm值
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图1 各组巨噬细胞增殖率Fig.1 The proliferation rate of macrophages in each group
2.3 sGPS6对小鼠腹腔巨噬细胞上清中NO及细胞因子含量的影响
不同浓度sGPS6对小鼠腹腔巨噬细胞上清中NO及细胞因子含量的影响见图2。由图2可知,LPS组、12.5~100 μg/mL sGPS6组NO、TNF-α、IL-1β、IL-6含量及25~100 μg/mL sGPS6组IFN-γ、IL-12含量均显著高于对照组(P<0.05)。
100 μg/mL sGPS6组NO、TNF-α和IL-12含量均显著高于LPS组(P<0.05)(图2A、2B、2F);所有浓度sGPS6组IFN-γ含量均显著低于LPS组(P<0.05)(图2C);6.25~25 μg/mL sGPS6组IL-1β含量显著低于LPS组(P<0.05),100 μg/mL sGPS6组高于LPS组,但差异不显著(P>0.05)(图2D);6.25~50 μg/mL sGPS6组IL-6含量显著低于LPS组(P<0.05),100 μg/mL sGPS6组与LPS组差异不显著(P>0.05)(图2E);6.25 μg/mL sGPS6组IL-12含量显著低于LPS组(P<0.05),12.5~50 μg/mL sGPS6组与LPS组差异不显著(P>0.05),100 μg/mL sGPS6组显著高于LPS组(P<0.05)(图2F)。
2.4 sGPS6对小鼠腹腔巨噬细胞吞噬指数及吞噬率的影响
sGPS6对小鼠碳廓清实验吞噬指数A及对小鼠巨噬细胞吞噬鸡红细胞实验吞噬指数B和吞噬率的影响见表3。由表3可知,高(2 mg/mL)、中(1 mg/mL)、低(0.5 mg/mL)剂量sGPS6组的吞噬指数A均显著高于空白对照组(P<0.05),高剂量sGPS6组显著高于低剂量组(P<0.05);高、中剂量sGPS6组的吞噬指数B显著高于空白对照组(P<0.05),低剂量sGPS6组与空白对照组差异不显著(P>0.05),高剂量sGPS6组的吞噬指数B高于中、低剂量组,但差异不显著(P>0.05)。 高、中、低剂量sGPS6组的吞噬率均显著高于空白对照组(P<0.05),高剂量sGPS6组显著高于中、低剂量组(P<0.05)。
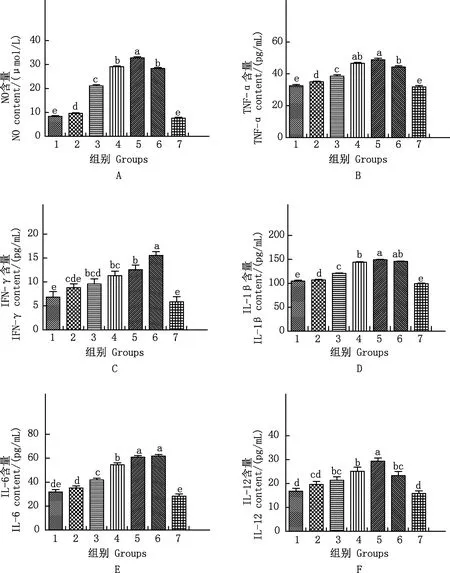
1~7,分别代表6.25、12.5、25、50、100 μg/mL sGPS6组及LPS、CC组1-7, Represent 6.25, 12.5, 25, 50, 100 μg/mL sGPS6, LPS and CC groups图2 各组巨噬细胞上清中NO及细胞因子含量Fig.2 The contents of NO and cytokines in macrophage supernatant in each group
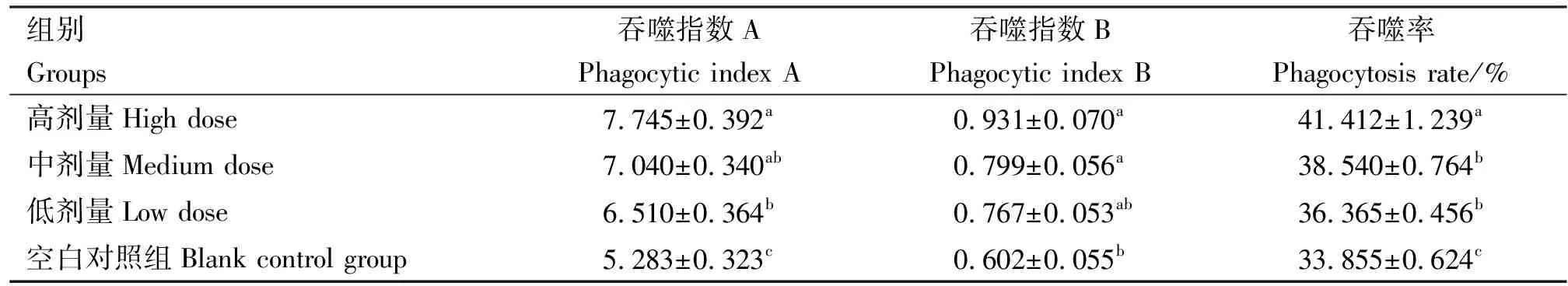
表3 sGPS6对巨噬细胞吞噬指数及吞噬率的影响
3 讨 论
3.1 硒化大蒜多糖对小鼠腹腔巨噬细胞吞噬功能的影响
巨噬细胞具有吞噬功能,因此,常把巨噬细胞的吞噬能力测定作为评价巨噬细胞功能及机体非特异性免疫状态的指标之一[17]。 本试验结果显示,3种硒化大蒜多糖中,所有浓度sGPS5、sGPS6组的A490 nm值均显著大于对照组,其中50~100 μg/mL sGPS6组A490 nm值均显著高于LPS组。说明硒化大蒜多糖能提高小鼠腹腔巨噬细胞的吞噬功能,sGPS6组活性最强,在高浓度时效果优于LPS。由此可见,硒化大蒜多糖可能通过提高巨噬细胞吞噬功能来增强免疫作用,且其增强免疫活性的效果与硒化修饰条件有关,并与浓度呈正相关。与刘佳等[18]的研究结果硒化乳酸菌胞外多糖能增强小鼠腹腔巨噬细胞对中性红的吞噬能力一致。
3.2 硒化大蒜多糖对小鼠腹腔巨噬细胞增殖能力的影响
植物多糖主要是通过影响巨噬细胞的增殖和细胞吞噬活性等来实现对免疫功能的调节作用,因此,常把巨噬细胞的增殖情况作为评价巨噬细胞功能的指标之一[19]。本试验结果显示,3个硒化大蒜多糖所有浓度组的A450 nm值均显著大于对照组,100 μg/mL sGPS5组、50~100 μg/mL sGPS6组的A450 nm值均显著高于LPS组,说明硒化大蒜多糖能提高小鼠腹腔巨噬细胞的增殖能力,且sGPS5、sGPS6组在高浓度时效果优于LPS。小鼠腹腔巨噬细胞增殖率的比较发现,50 μg/mL sGPS6组的巨噬细胞增殖率显著高于其余各组,100 μg/mL sGPS5、sGPS6组的巨噬细胞增殖率均显著高于LPS组。说明硒化大蒜多糖能提高小鼠腹腔巨噬细胞的增殖率,sGPS5、sGPS6组在高浓度时效果优于LPS,sGPS6在3个硒化大蒜多糖中增殖率最高。可见,硒化大蒜多糖可通过提高巨噬细胞增殖能力来实现其对免疫功能的调节,且其对巨噬细胞增殖率的影响与硒化修饰条件有关,并与浓度呈正相关。
3.3 sGPS6对小鼠腹腔巨噬细胞上清中NO和细胞因子含量的影响
NO是巨噬细胞活化后分泌的主要活性物质之一,不仅能杀死非特异性细菌和肿瘤,还参与T、B淋巴细胞介导的免疫调节[20]。本试验结果显示,12.5~100 μg/mL sGPS6组小鼠腹腔巨噬细胞上清中NO含量显著高于对照组,100 μg/mL sGPS6组NO含量显著高于LPS组。说明sGPS6能提高小鼠腹腔巨噬细胞上清NO含量,在100 μg/mL时优于LPS。这可能是硒化大蒜多糖增强机体免疫功能的作用机制之一,为进一步研究硒化大蒜多糖的抗菌、抗肿瘤作用提供了思路。
巨噬细胞活化后除分泌NO外,还会分泌多种细胞因子,如TNF-α、IFN-γ、IL-1β、IL-6和IL-12等,具有广泛的生物学活性[21]。本试验结果显示,除6.25 μg/mL组外,其余浓度sGPS6组小鼠腹腔巨噬细胞上清中TNF-α、IFN-γ、IL-1β、IL-6、IL-12含量均高于或显著高于对照组;100 μg/mL sGPS6组TNF-α、IL-12含量均显著高于LPS组,说明sGPS6能提高小鼠腹腔巨噬细胞上清中细胞因子含量,100 μg/mL sGPS6优于LPS或与LPS作用相当。吴秀钦等[22]研究结果显示,硒化修饰太子参多糖能促进巨噬细胞分泌细胞因子;顾丽霞等[23]研究结果也显示,硒化低聚氨基多糖能促进小鼠巨噬细胞RAW264.7分泌TNF-α、IL-6及IL-10并提高其mRNA表达水平。 说明硒化大蒜多糖的免疫增强活性的产生可能与诱导巨噬细胞分泌细胞因子有关。
3.4 sGPS6对体内巨噬细胞吞噬功能的影响
通过小鼠碳廓清实验和巨噬细胞吞噬鸡血红细胞实验,可以测定小鼠经过刺激后是否引起小鼠巨噬细胞吞噬能力的改变,从而判断小鼠固有免疫的敏感性,通常以吞噬率和吞噬指数作为评价指标。本试验结果显示,高、中、低剂量sGPS6组的吞噬指数A、B和吞噬率均显著高于空白对照组,说明sGPS6能提高小鼠腹腔巨噬细胞的吞噬指数和吞噬率。宋玉龙等[24]研究结果也显示,硒化修饰太子参多糖能提高免疫损伤小鼠腹腔巨噬细胞的吞噬指数。表明硒化大蒜多糖不仅可以直接作用于体外的小鼠腹腔巨噬细胞,还可以体内给药的方式来促进巨噬细胞的功能。
4 结 论
本试验结果表明,硒化大蒜多糖能增强小鼠腹腔巨噬细胞的吞噬活性和增殖能力,并且25~100 μg/mL sGPS6能提高小鼠腹腔巨噬细胞上清中NO、TNF-α、IL-1β、IL-6、IFN-γ和IL-12含量,0.5~2 mg/mL sGPS6能提高小鼠腹腔巨噬细胞的吞噬指数和吞噬率。结果可为硒化大蒜多糖的临床应用提供参考依据,同时也为其抗菌、抗肿瘤等作用的挖掘提供思路。

