Ⅰ群禽腺病毒血清11型的分离鉴定及致病性试验
兰 虹,任广彩,叶俊贤,熊 挺,何献铭,刘郁夫,2,杨泽坤,郝文茜,陈瑞爱,2,,4
(1.华南农业大学兽医学院,广州 510642;2.岭南现代农业科学与技术广东省实验室肇庆分中心,肇庆 526238;3.华农(肇庆)生物产业技术研究院有限公司,肇庆 526238;4.肇庆大华农生物药品有限公司,肇庆 526238)
禽腺病毒(Fowl adenovirus,FAdV)属于禽腺病毒科禽腺病毒属成员,是呈二十面体对称的无囊膜线性双股DNA病毒,其基因组线性长度为43~45 kb,病毒直径为70~100 nm[1]。腺病毒的核衣壳有3个主要结构蛋白:六邻体蛋白(Hexon)、纤突蛋白(Fiber)和五邻体蛋白(Penton)[2-3]。Hexon蛋白是腺病毒科各属病毒最主要的结构蛋白,每个Hexon蛋白表面携带有病毒主要的属种特异性抗原决定簇,是诱导机体产生中和抗体的靶目标,含有病毒主要的保护性抗原基因簇,与病毒的致病性密切相关[4-5]。根据群特异性抗原的不同,FAdV可分为Ⅰ、Ⅱ、Ⅲ 3个亚群,Ⅰ亚群FAdV具有共同的群抗原,基于限制性内切酶片段图谱和核酸序列等分子生物学标准将Ⅰ群FAdV分为A~E 5个种[6],每个种内的病毒根据血清交叉中和试验结果进一步分为12个血清型(1~7、8a、8b、9~11)[7]。
FAdV-4、FAdV-8a、FAdV-8b和FAdV-11为中国FAdV流行的主要血清型,大部分毒株会造成包涵体肝炎(inclusion body hepatitis,IBH),剖检肝脏黄染、肿大、表面有密集的小出血点或出血斑,严重者可见灰黄色坏死灶,部分毒株还会有心包积液的症状[8]。IBH特征性病理变化为肝脏组织切片在显微镜下可观察到嗜碱性核内包涵体[9-10]。研究表明,FAdV的发生可能与机体的免疫抑制有关,病禽常伴发传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)与鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)继发感染,CIAV继发感染可增强某些腺病毒引起的肝炎症状和致死力,此外,当FAdV与IBDV共同感染时,腺病毒的感染性增强[11-12]。由于FAdV属于免疫抑制病原,既可水平传播,又可垂直传播,且可间歇性排毒,因此,该病是目前国内养殖户最为关注的疫病之一。本研究以从江苏省南通市某鸡场分离到的FAdV-11毒株为研究主体,通过全基因组测序分析其遗传进化情况,并通过SPF鸡致病性试验研究该毒株的致病力,以期为FAdV的分子流行病学研究和临床防控措施提供参考。
1 材料与方法
1.1 病料样品及试验动物
病料组织来源于江苏省南通市某鸡场疑似FAdV感染的鸡的肝脏,于-80 ℃保存。SPF鸡胚和SPF鸡均购自新兴大华农禽蛋有限公司。
1.2 主要试剂
AxyPrep体液病毒DNA/RNA提取试剂盒购自爱思进生物技术(杭州)有限公司;ExTaq酶购自宝日医生物技术(北京)有限公司;Trans2K DNA Marker购自北京全式金生物技术有限公司;TRIzol®Reagent(15596-026)购自Invitrogen公司;无水乙醇、氯仿均购自浙江宁波萃英化学技术有限公司;反转录试剂5×EasyQuick RT MasterMix购自北京康为世纪生物科技有限公司;ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;4%多聚甲醛组织固定液购自广州赛国生物科技有限公司。
1.3 病毒分离与增殖
将肝脏组织剪碎后按1∶3的比例加入灭菌PBS进行研磨制成悬液,反复冻融3次,并于4 ℃、8 000×g离心15 min,取上清液,加入终浓度为1 000 U/mL的青、链霉素,经0.22 μm微孔滤膜过滤除菌,无菌检验合格后保存备用。
将上述制备好的病料研磨液离心,上清经卵黄囊途径接种7日龄SPF鸡胚,0.2 mL/枚,同时设置对照组,注射等量灭菌PBS,置于37 ℃温箱孵育,每12 h照胚观察一次,连续观察192 h,弃去24 h内死亡鸡胚,收集攻毒组24 h后死亡鸡胚的尿囊液,将收集的尿囊液过滤除菌后重新接种至新的SPF鸡胚中,盲传至第3代,观察第3代死亡鸡胚的肝脏组织,并收集死亡鸡胚尿囊液保存备用。
1.4 病毒PCR鉴定及纯净性检测
用AxyPrep体液病毒DNA/RNA提取试剂盒抽提第3代鸡胚尿囊液中的DNA,利用基因组的保守序列设计1对Ⅰ群FAdV通用鉴定引物进行PCR扩增,引物序列为:FAdV-F:5′-GTGGTRT-CCATGTTGGT-3′;FAdV-R:5′-ATGTACGCYT-CCGCCCTC-3′,预期扩增片段长约494 bp。PCR扩增体系20 μL:2×ExTaq酶10 μL,上、下游引物各0.5 μL,DNA模板1 μL,加灭菌ddH2O补足体系。PCR反应程序:95 ℃预变性5 min;95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min。PCR产物进行1.0%琼脂糖凝胶电泳检测。
利用Trizol法提取第3代鸡胚尿囊液中的总RNA。采用PCR/RT-PCR方法检测P3代尿囊液的外源病原体,检测的禽DNA病毒有传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)和CIAV。检测的禽RNA病毒有:IBDV、新城疫病毒(Newcastle disease virus,NDV)、传染性支气管炎病毒(Infectious bronchitis virus,IBV)、网状内皮组织增殖病病毒(Reticuloendotheliosis virus,REV)、禽流感病毒(Avian influenza viruses,AIV)、禽呼肠孤病毒(Avian reovirus,ARV)。检测的禽支原体有:鸡毒支原体(Mycoplasmagallisepticum,MG)、滑液囊支原体(Mycoplasmasynoviae,MS)。此部分鉴定引物均为本实验室常用鉴定引物,敏感性和特异性已得到验证[13]。
本研究所涉及的引物均由生工生物工程(上海)股份有限公司合成,将鉴定为FAdV阳性的PCR产物送苏州金唯智生物科技有限公司进行高通量测序。
1.5 电镜负染
用50 μL纯水重悬病毒粒子,在玻片上以1%磷钨酸负染30 s,包埋在200目聚乙烯醇缩甲醛铜网上,用电子显微镜观察病毒粒子的形态。
1.6 相似性与遗传进化分析
利用MegAlign软件将NCBI网站上下载的FAdV参考毒株序列与本研究分离的毒株全基因序列进行序列比对分析,并用Mega 6.0软件,通过Neighbor-Joining法构建病毒全基因组和Hexon基因遗传进化树,Bootstrap值重复1 000次。
1.7 致病性试验
20只10日龄SPF鸡随机分为攻毒组和对照组,10只/组。 攻毒组以胸肌注射的方式接种第15代死亡鸡胚尿囊液,1 mL/只(105.33EID50/0.2 mL),对照组注射等量无菌生理盐水,连续观察10 d。隔离饲养,记录鸡的发病情况及临床表现。分别在攻毒后3、5、7、10 d采集鸡喉头、泄殖腔拭子,加入灭菌PBS,反复冻融3次后离心取上清提取病毒DNA,通过实时荧光定量PCR检测腺病毒的排毒情况。 引物序列为:52K-fw:5′-ATGGCKCAGATGGCYA-AGG-3′;52K-rv:5′-AGCGCCTGGGTCAAACCGA-3′。
采集发病死亡鸡及观察期结束后存活鸡(存活鸡均处死)的心脏、肝脏、脾脏、肺脏、肾脏、腺胃、肌胃组织研磨后提取DNA,利用实时荧光定量PCR方法检测病毒载量,一部分组织研磨处理后离心取上清,重新接种SPF鸡胚进行病毒分离;再另取各鸡的肝脏、肾脏、心脏组织,用4%多聚甲醛固定,制作石蜡切片,用HE染色后进行组织病理学检查。
2 结 果
2.1 病毒分离与鉴定
处理后的病料研磨液离心上清通过卵黄囊途径接种7日龄SPF鸡胚,收获病死胚尿囊液,处理后盲传至第3代,可见接毒鸡胚144 h后开始出现死亡,剖检可见接毒鸡胚肝脏肿大,质脆,遍布出血斑点(图1A),对照组鸡胚发育正常,无明显眼观病变(图1B)。提取第3代增殖尿囊液的DNA,PCR产物经凝胶电泳后得到大小约494 bp的特异性扩增条带(图2),与预期大小相符。
2.2 病毒纯净性检测
P3代鸡胚尿囊液经PCR/RT-PCR检测,结果显示ILTV、CIAV、IBDV、IBV、AIV、REV、ARV、NDV、MS和MG均为阴性(图3)。
2.3 电镜负染
将病毒粒子进行负染,在透射电子显微镜下可见球型、无囊膜,直径为70~90 nm,具有FAdV典型的二十面体结构(图4)。将该分离毒株命名为JSNT-1。
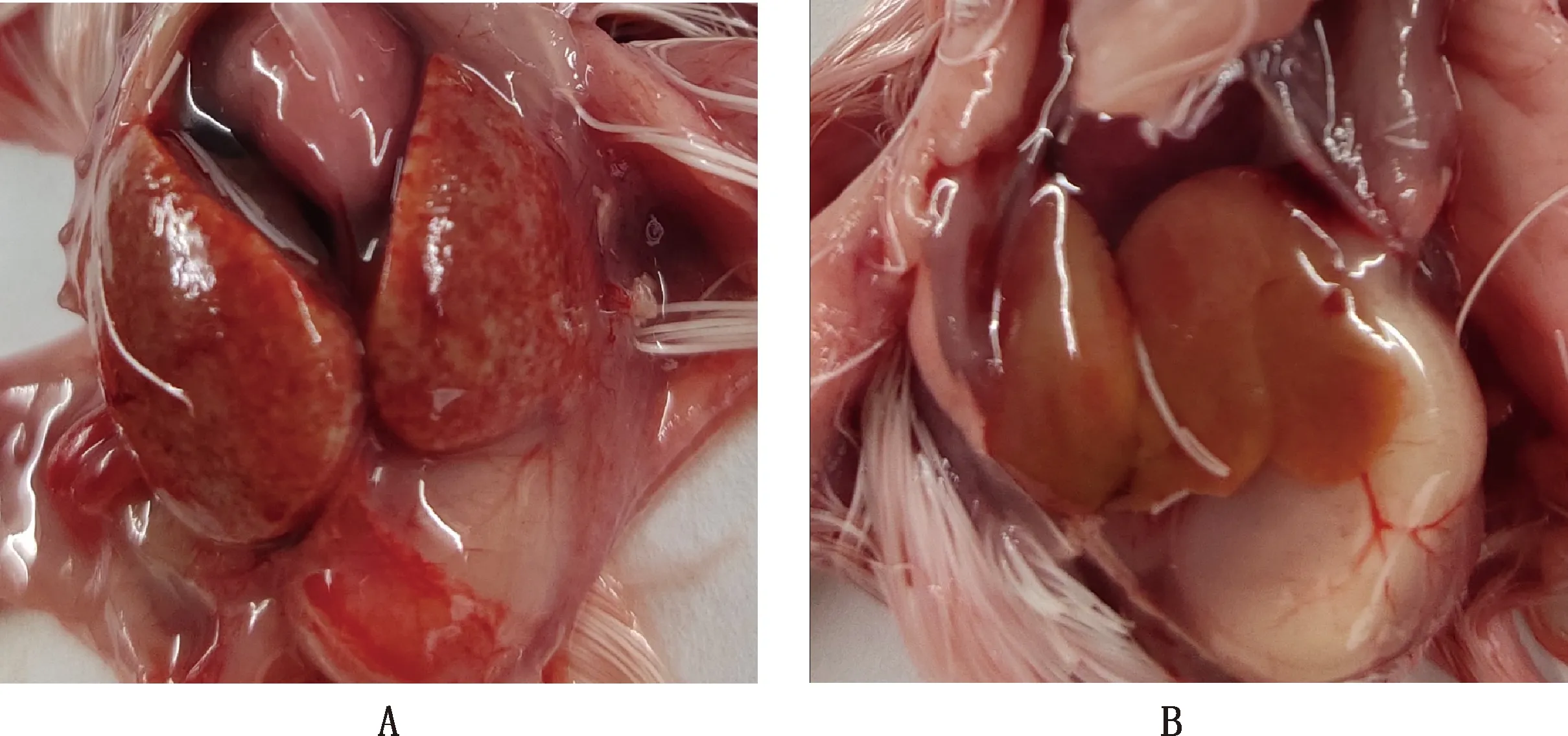
A,攻毒组;B,对照组A,Challenge group;B,Control group图1 鸡胚肝脏病变Fig.1 Chick embryo liver lesion
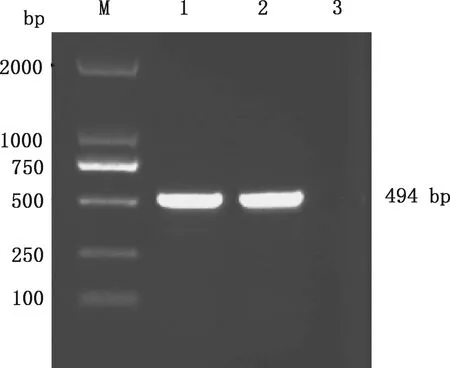
M,Trans2K DNA Marker;1,阳性对照;2,第3代鸡胚尿囊液;3,阴性对照M,Trans2K DNA Marker;1,Positive control;2,The third generation chicken embryo allantoic fluid;3,Negative control图2 鸡胚尿囊液PCR扩增结果Fig.2 PCR result of virus isolated from chick embryo allantoic

M,Trans2K DNA Marker;1,FAdV鉴定引物;2,阴性对照;3~15,分别是CIAV、IBV 1号、IBV 2号、A型AIV、H5亚型AIV、H9亚型AIV、IBDV、REV、ARV、NDV、ILTV、MS、MG鉴定引物M,Trans2K DNA Marker;1,FAdV identification primers;2,Negative control;3-15,CIAV,IBV No.1,IBV No.2,Avian influenza A virus,H5 subtype AIV,H9 subtype AIV,IBDV,REV,ARV,NDV,ILTV,MS and MG identification primers,respectively图3 外源病原体PCR扩增结果Fig.3 PCR amplification results of foreign pathogens
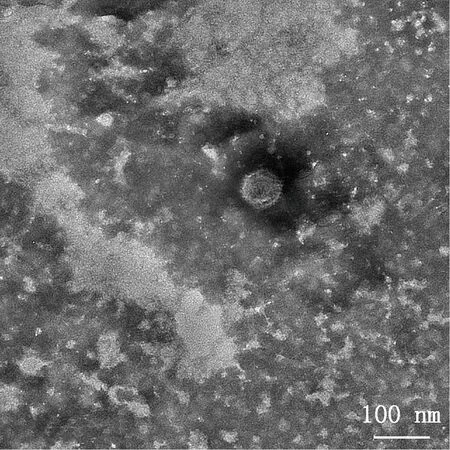
图4 病毒粒子电镜观察(70 000×)Fig.4 Electron microscope observation of virus particle (70 000×)
2.4 全基因组遗传进化分析
利用Mega 6.0将JSNT-1株全基因组(全长43 491 bp,GC含量53%)与不同血清型FAdV毒株进行遗传进化分析。结果显示,JSNT-1处于D型FAdV分支上,在这个分支内,JSNT-1与加拿大ON P2(KU310942.1)、加拿大ON NP2(KP231537.1)、墨西哥MX95-S11(KU746335.1) FAdV-11型毒株亲缘关系更近, 而与日本SR48(KT862806.1)、 英国685(KT862805.1) FAdV-2毒株,日本SR49(KT862807.1) FAdV-3毒株,加拿大A-2A(AF083975.2) FAdV-9毒株的亲缘关系相对较远(图5)。
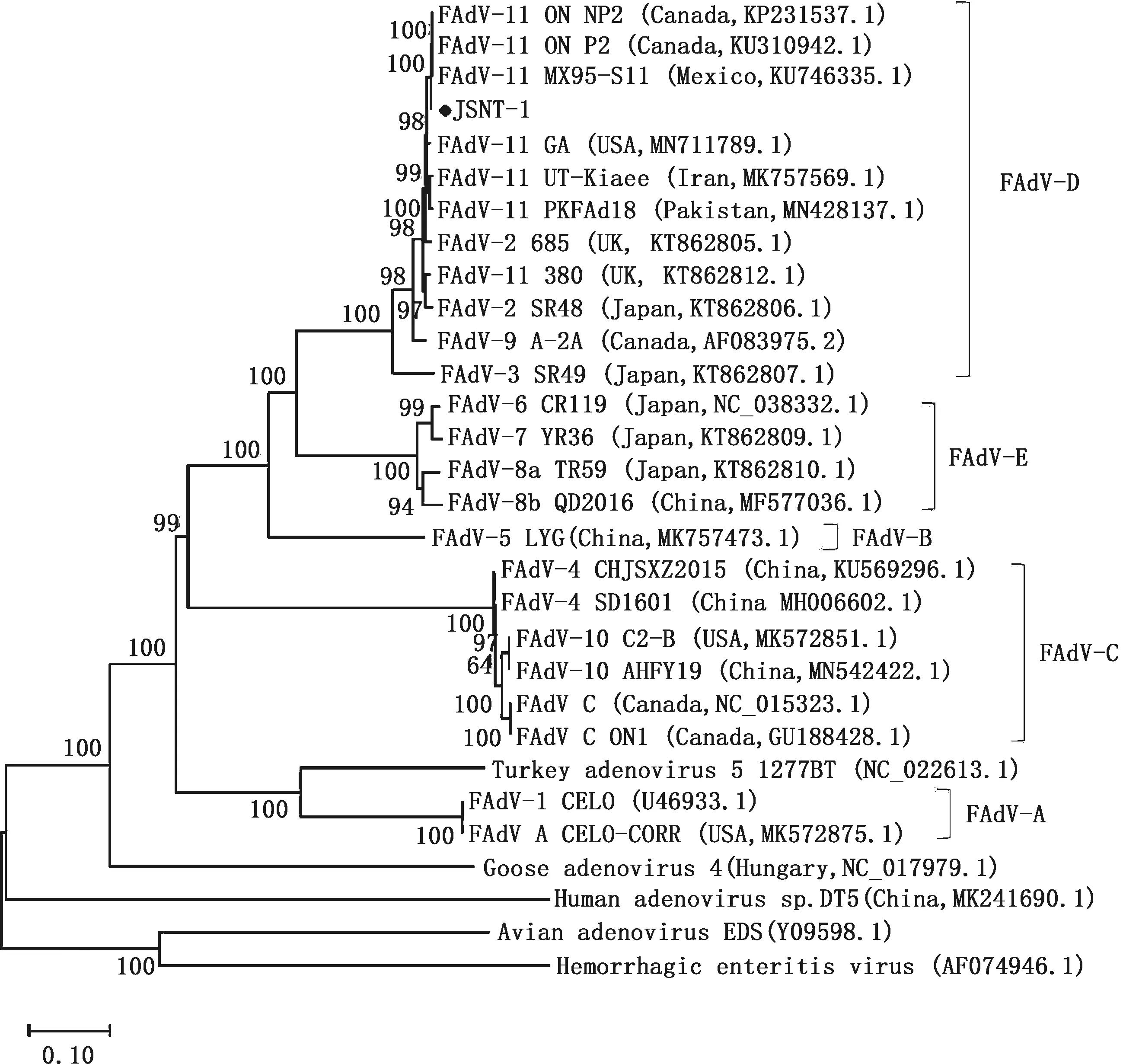
图5 基于JSNT-1株全基因组核苷酸的遗传进化树Fig.5 Phylogenetic tree based on the whole genomic sequence of JSNT-1 isolate
2.5 Hexon基因遗传进化分析
JSNT-1株Hexon基因全长2 853 bp,共编码950个氨基酸。将JSNT-1株与GenBank中毒株进行核苷酸序列比对发现,JSNT-1与中国JL/1407、加拿大ON P2和ON NP2、墨西哥MX95-S11毒株处于同一分支,同属FAdV-11血清型(图6)。用MegAlign比对JSNT-1与22个相关毒株的氨基酸序列相似性显示,JSNT-1与参考毒株的相似性为77.2%~100%;与D种参考毒株相似性为89.4%~100%,其中与FAdV-11型中国分离株JL/1407、HBQ 12、LN/1507,加拿大分离株ON P2、ON NP2,墨西哥分离株MX95-S11氨基酸相似性最高,为100%,与FAdV-11血清型伊朗分离株UT-Kiaee、巴基斯坦分离株PKFAd18、美国分离株GA、英国分离株380相似性分别为99.6%、99.5%、98.4%和98.5%,分别存在4、5、16和15个点突变,与FAdV-2血清型加拿大分离株A-2A相似性最低,为89.4%(图7)。
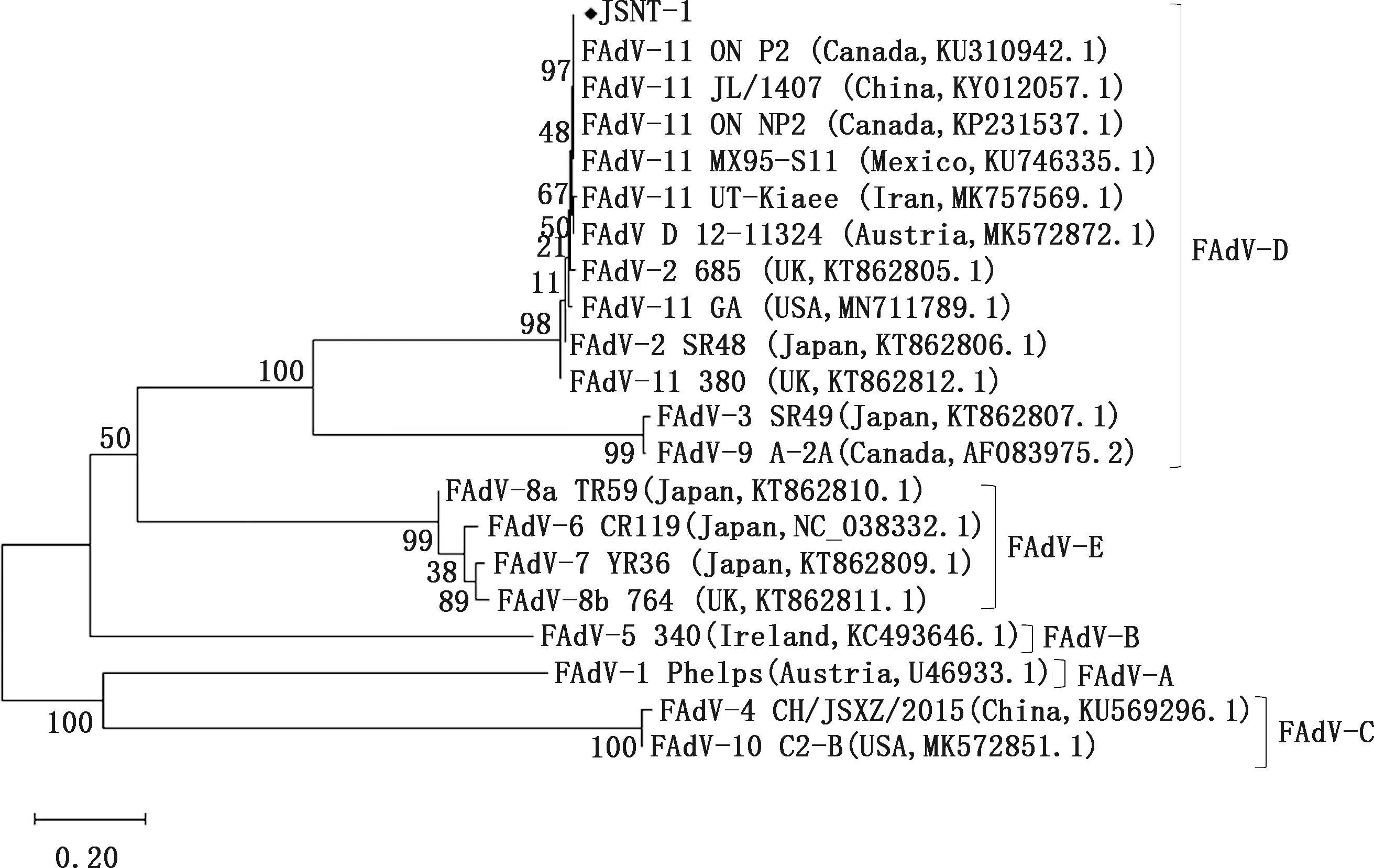
图6 基于Hexon基因核苷酸序列的遗传进化树Fig.6 Phylogenetic tree based on Hexon gene nucleotide sequence of JSNT-1 isolate

图7 基于Hexon蛋白氨基酸序列的相似性比对Fig.7 Similarity comparison based on the amino acid sequence of Hexon protein
2.6 致病性试验
2.6.1 回归试验结果 以5×105.33EID50的剂量攻毒10日龄SPF雏鸡后,仅有个别雏鸡出现精神沉郁的症状,攻毒后5 d,死亡1只,至观察期结束其余9只状态良好,没有明显临床症状。对照组至观察期结束,临床表现正常未见死亡。剖检病死鸡,发现肝脏褪色变黄,出血肿胀,边缘钝圆;肾脏肿大苍白、有点状出血。攻毒10 d后剖检存活鸡,各脏器均无明显肉眼可见病变。
2.6.2 感染鸡排毒情况监测 取采集的感染鸡喉头、泄殖腔拭子处理后进行实时荧光定量PCR检测。结果显示,SPF雏鸡感染病毒后3、5、7和10 d喉头、泄殖腔均可检测到排毒,其中泄殖腔排毒率均为100%,观察期内排毒量持续升高,而喉头在攻毒后5 d达到排毒率及排毒量的高峰(图8)。取发病死亡鸡及观察期限后存活鸡的脏器组织研磨后进行实时荧光定量PCR检测,发现病毒在心脏、肝脏、脾脏、肺脏、肾脏、肌胃、腺胃组织中均有分布,其中肝脏的病毒载量最多,且可从发病病死鸡脏器重新分离到该病毒。
2.6.3 病理组织检查 取新鲜死亡鸡及观察期结束后存活鸡的肝脏、肾脏、心脏组织制作病理切片,并进行观察。结果显示,攻毒死亡鸡肝细胞变性坏死,见大量炎性细胞增生灶,同时可见嗜碱性核内包涵体的典型症状(图9A),肾脏组织淤血出血,肾小球上皮细胞变性坏死(图9B),心肌纤维变性坏死,可见大量炎性细胞增生浸润(图9C);攻毒存活鸡肝细胞变性坏死,大量炎性细胞增生浸润(图9G),肾小管上皮细胞变性坏死,有大量炎性细胞增生浸润(图9H),心肌纤维变性坏死,出现心外膜炎(图9I)。
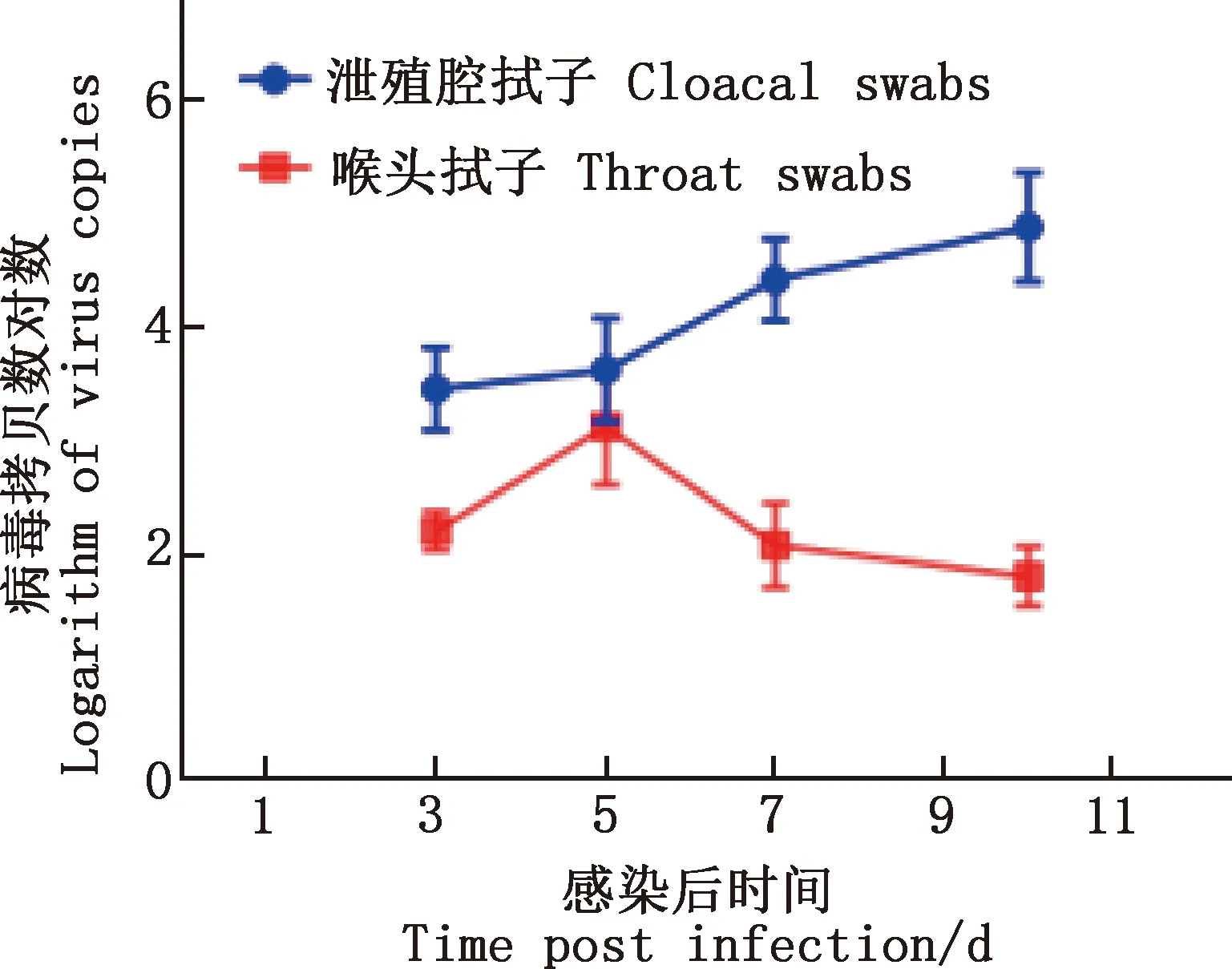
图8 感染后不同时间喉头、泄殖腔排毒情况Fig.8 Virus copies of throat and cloaca at different time post infection

A~C,攻毒死亡鸡肝脏、肾脏、心脏;D~F,对照组鸡肝脏、肾脏、心脏;G~I,攻毒存活鸡肝脏、肾脏、心脏A-C,Liver,kidney and heart tissue of the chicken that died after challenge;D-F,Liver,kidney and heart tissue of normal chicken;G-I,Liver,kidney,heart of the chicken that survived after challenge图9 组织病理学观察(HE,200×)Fig.9 Histopathological observation (HE,200×)
3 讨 论
近年来,中国很多地区的鸡群暴发心包积液综合征和包涵体肝炎疫情,发病鸡数量明显增加,且致病性逐渐增强,分析不同血清型的流行状况可见FAdV-4、FAdV-8a、FAdV-8b和FAdV-11一直占据主导地位[14-15],不同血清型对禽类的致病作用存在差异,其中感染率最高的血清型为4型和8b型[16-17]。此前,FAdV-11血清型在中国流行的研究较少报道,此次江苏省南通市某鸡场疫病的发生,说明在中国部分地区还存在FAdV-11血清型的流行。
在临床中同一种血清型不同FAdV分离株之间致病性、临床表现往往存在明显差异[18-19]。本研究中分离到的FAdV-11 JSNT-1 株,以5×105.33EID50的剂量感染10日龄SPF雏鸡后能导致10%的死亡率,病死鸡剖检可见肝脏、肾脏均出现明显病变,组织病理学结果证实为包涵体肝炎,攻毒存活鸡虽然脏器不存在肉眼可见病变,但组织病理学结果显示肝脏、肾脏、心脏均存在不同程度的炎症或细胞坏死现象。2015年,Zhao等[20]从中国分离到1株FAdV-11毒株HBQ12,以103.5EID50的剂量感染3周龄鸡后能导致8.6%的死亡率,病死鸡剖检可见肝脏变黄、肿胀、有坏死灶;肾脏肿胀、苍白;肝脏病理组织切片可见嗜碱性核内包涵体,表现出明显的IBH症状。2017年,Absalón等[21]从墨西哥地区健康鸡中分离到1株非致病性的FAdV-11毒株MX95,106TCID50剂量感染1日龄雏鸡不会导致死亡,无明显的临床症状,剖检可见肝脏轻微泛黄,组织病理学结果显示存在包涵体肝炎,将FAdV-11毒株HBQ12和MX95的全基因组进行比对,发现两者之间的核苷酸相似性较高(99.3%),且突变大多在基因非编码区[22]。本研究通过全基因序列比对发现,JSNT-1株与HBQ12两者单纯感染鸡造成的死亡率相似,引起发病的症状相近,提示FAdV-11的国内分离株高度相关,未发生明显变异。
在自然条件下,IBH主要发生于3~6周龄的鸡群,但临床症状一般不明显,有研究发现在人工感染情况下,小日龄比大日龄鸡更易感,且感染后小日龄鸡比大日龄鸡病变情况更严重[23]。因此,本研究选择用10日龄雏鸡进行攻毒试验,旨在观察JSNT-1株的主要病变情况。但为了更加接近自然条件下的感染情况,后续可进一步研究毒株在3~6周龄鸡群中的致病情况,进一步丰富对该分离株的认识。
本研究结果提示Ⅰ群FAdV血清11型与血清4型、血清8b型一样对家禽养殖业具有较大威胁,因此,对FAdV-11的防控也不容忽视,由于FAdV的血清型较多,且没有特效药物治疗,主要还是通过疫苗接种预防[24-25],因此,进行有效地病原分离鉴定,能进一步掌握FAdV的具体分型和生物学特性,以便尽早使用相对应的疫苗进行预防接种。
4 结 论
本研究成功分离到1株Ⅰ群FAdV,全基因组及Hexon基因测序分析表明该分离株为D种,血清型为11型,属于国内近几年流行株。本研究结果进一步丰富了Ⅰ群FAdV流行病学资料,为FAdV疫病的防控提供了一定的试验依据。

