茶树油对三种常见致病菌的体外抑菌活性研究
王桂荣,赵晨栋,王 萌,范碧玥,马小燕,安志霞,赵凤舞*
(1.甘肃农业大学,甘肃 兰州 730070;2.兰州职业技术学院,甘肃 兰州 730070)
茶树油主要通过蒸馏,从各种桃金娘科白千层属植物的叶子中提炼而来,原产于澳洲,主要有挥发油、三萜等成分,芳香气味,还含有一些鞣质、脂肪酸和脂类化合物等[1],具有广谱抗微生物的效果以及保健作用[2-5],是能够用于替代抗生素、缓解微生物耐药现状的一种天然的、优良的抗菌剂,且无毒害[6-7],已在多个领域得到广泛应用[3]。金黄色葡萄球菌(Staphyloccus aureus)是一种重要的病原菌[6]。沙门氏菌(Salmonella)是食物中毒事件的主要致病菌之一[7]。大肠埃希氏菌(Escherichia coli)通称为大肠杆菌,寄居在动物肠道中,可以导致动物发生疾病,且具有多重耐药性[8]。目前,微生物的耐药性由于抗生素的滥用而逐年增强,因此寻找能够代替抗生素、且对微生物敏感度高、不易使微生物产生耐药性的抑菌物非常重要。本试验选用金黄色葡萄球菌、沙门氏菌和大肠杆菌作为供试菌,茶树油作为抑菌剂,进行茶树油体外抑菌试验,测定茶树油抑菌活性。同时通过分光光度法测定1.5×108cfu/ml(相当于0.5麦氏比浊标准)的菌悬液[9]在600 nm波长处的光密度值(optical density,OD),用OD值表示细菌菌悬液浓度,以验证茶树油对所选用的3种供试菌的抑制敏感度以及对其最小抑菌浓度(Minimal Inhibitory Concentration,MIC)。
1 材料与方法
1.1 材料
1.1.1 菌种 金黄色葡萄球菌(ATCC25923),沙门氏菌(CMC50115),大肠埃希氏菌(ATCC25922),菌种保存于甘肃农业大学动物医学院微生物实验室。
1.1.2 试剂 蛋白胨、琼脂粉、酵母提取物,均为生化试剂。吐温-80溶液、氯化钠、氢氧化钠,均为分析纯。试验过程所用水为蒸馏水。
1.1.3 仪器与设备 紫外可见分光光度计(UV-5500),垂直层流洁净工作台(HCB-1300V),生化培养箱(HPX-Ⅱ-80),高压蒸汽灭菌锅(LDZH-100KBS),分析天平(Cubis Ⅱ)。
1.2 方法
1.2.1 培养基的配制 分别配制琼脂液体培养基和固体培养基,配制完成后使用高压蒸汽灭菌锅高压蒸汽(15 psi)灭菌20 min(1.05 kg/cm3),液体琼脂培养基在高压灭菌后,冷却降温放4 ℃条件下保存,以备后续制备菌悬液使用;固体培养基在温度稍微冷却后,趁热倒平板,待冷却凝固后使用无菌打孔器将琼脂板做打孔处理[10],并用封口膜将平板封口后放4 ℃条件下保存,以备后续药敏试验使用。
1.2.2 茶树油原液稀释 将茶树油原液连续采用倍比稀释法(二倍比)处理,最终形成的茶树油溶液分别相当于茶树油原液浓度×20、原液浓度×2-1、原液浓度×2-2、原液浓度×2-3、原液浓度×2-4、原液浓度×2-5、原液浓度×2-6、原液浓度×2-7、原液浓度×2-8、原液浓度×2-9。
1.2.3 供试菌菌悬液的制备 在液体培养基中取适量菌种溶液放于恒温摇床培养12~20 h,将所得菌液采用平板划线法进行菌种的纯化分离培养[11],恒温培养24 h后取出,用高压蒸汽灭菌处理过的无菌接种环分别挑取长势良好的供试菌单个菌落,分别接种于1.2.1制备的无菌琼脂液体培养基,放于37 ℃恒温摇床孵育24 h。24 h后,将所得供试菌菌悬液取0.1 ml,采用倍比稀释法连续进行8次十倍比梯度稀释处理,将稀释后的菌悬液分别进行平板涂布,并放于恒温培养箱恒温孵育过夜,之后采用平板计数法计数每个稀释梯度平板的供试菌数,计算不同稀释度的供试菌菌悬液浓度。最终经稀释得到浓度为1.5×108cfu/ml的3种供试菌菌悬液,4 ℃保存,以备后续药敏试验使用。
1.2.4 药敏试验 试验前将琼脂板放至37 ℃恒温培养箱孵育24 h,以检测琼脂板是否有杂菌污染。选用无污染的灭菌琼脂板,采用平板涂布法将菌悬液均匀涂布在琼脂培养基上,然后将茶树油原液100 μl加入到提前打好的孔内[10],随后将其置于恒温培养箱培养18~24 h,之后测定抑菌圈大小,并判断茶树油对3种供试菌的抑菌敏感度。
1.2.5 茶树精油的最低抑菌浓度(MIC)测定采用微量肉汤稀释法测定MIC[12]:将不同稀释浓度的茶树油溶液分别加至灭菌过的96孔板中,第2~11孔加不同浓度的茶树油稀释溶液,每孔20 μl,再每孔加菌悬液180 μl。第1孔加20 μl无菌水和180 μl液体培养基作空白对照;第12孔加20 μl无菌水和180 μl菌悬液作阳性对照,密封后置于37 ℃恒温培养箱中孵育18~24 h后,测定OD600处的吸光度,重复3次并判断结果。
2 结果与分析
2.1 茶树油抑菌活性
抗生素抑菌效果判定标准[13]:最敏感级抑菌圈直径大于15 mm,中度敏感抑菌圈直径为10~15 mm,低度敏感抑菌圈直径为7~9 mm,不敏感无抑菌圈。测量结果表明(表1),在3种菌中,茶树油对金黄色葡萄球菌的抑菌活性为最敏感,对沙门氏菌、大肠杆菌均为中度敏感。

表1 茶树油对供试菌的抑菌直径
2.2 茶树油最小抑菌浓度
横坐标为茶树油原液稀释倍数,纵坐标为OD600吸光度值,其最大突变区间即为茶树油MIC浓度区间。结果表明,茶树油对大肠杆菌、金黄色葡萄球菌、沙门氏菌抑制的突变区间分别主要发生在茶树油原液稀释倍数为2-3×10-1~2-2×10-1(图1)、2-4×10-1~2-3×10-1(图2)、2-7×10-1~2-6×10-1(图3)区间内。
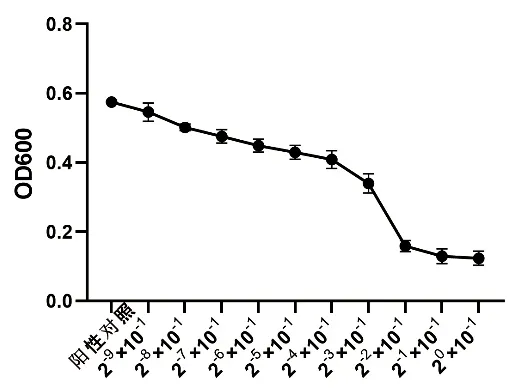
图1 金黄色葡萄球菌抑菌活性
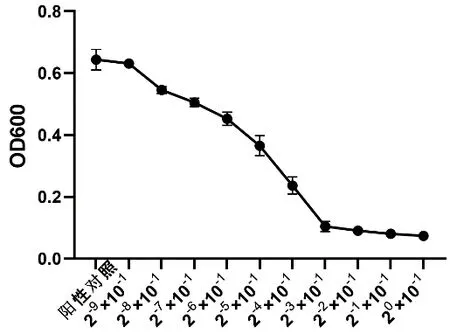
图2 沙门氏菌抑菌活性

图3 大肠杆菌抑菌活性
3 结论
在选用的3种细菌中,茶树油对金黄色葡萄球菌的抑菌活性为最敏感,对沙门氏菌和大肠杆菌的抑菌敏感度为中度敏感。作用于金黄色葡萄球菌和沙门氏菌时,需使用高浓度茶树油;但茶树油在较低浓度时对大肠杆菌仍然有较好的抑制效果,因此作用于大肠杆菌时使用低浓度茶树油即可。在抗微生物制剂方面可以考虑采用茶树油作为原料或者添加剂来进行制备。

