腹腔镜技术在Hartmann造口还纳术中的应用
赵红旗 马松 杨建伟
Hartmann手术指经腹直肠或乙状结肠肿瘤切除、近端造口、远端封闭手术。该术式多应用于肿瘤引起的急性肠梗阻、肠穿孔患者,一般情况差、吻合口瘘风险高患者,复杂憩室炎患者,外伤致结直肠损伤患者等情况[1]。随着人们生活水平的提高,人民群众对术后生存质量有了更高的要求,越来越多的Hartmann术后患者要求行造口还纳术。同时,近年来随着腹腔镜技术的发展,腹腔镜手术较剖腹手术在减轻手术疼痛、肠功能恢复、快速康复、减少住院时间等方面有明显优势。Gorey等[2]于1993年率先报道了腹腔镜辅助Hartmann造口还纳术(laparoscopic hartmann reversal,LHR),我科于2015年开展腹腔镜下辅助Hartmann造口还纳术,本研究拟通过病例对照研究方法将腹腔镜辅助Hartmann造口还纳术与剖腹Hartmann造口还纳术(open hartmann reversal OHR)进行对比分析。
1 资料与方法
1.1 一般资料 选取北京市顺义区医院2006年9月至2018年9月行Hartmann造口还纳术的患者69例,其中男40例,女29例;年龄39~87岁。其中腹腔镜辅助Hartmann造口还纳术(LHR)患者18例,剖腹Hartmann造口还纳术(OHR)51例。
1.2 病例选择标准 既往行Hartmann手术,并且距前次手术时间间隔>3个月;患者要求行造口还纳;术前未发现肿瘤远处转移、肠瘘、严重肠梗阻、等手术禁忌;术前肠镜检查造口近端及远端未见明显肠腔狭窄;未合并严重结肠炎或结肠憩室炎;无全麻及腹腔镜手术禁忌证。
1.3 手术方式 术前常规聚乙二醇散行肠道准备,直肠残端灌肠清洁肠道;术前8 h禁食水;术前留置胃管尿管;术前24 h口服甲硝唑(0.4 g,3次/d)肠道准备,术前30 min给予患者头孢西丁2 g静脉注射。
1.4 手术方法 全麻气管插管,截石位。术者站于患者右侧,助手位于对侧,扶镜手站于患者尾侧。沿肠造口边缘切开皮肤,将造口的肠管自腹壁分离,切除部分造口的肠管,包埋吻合器抵钉座,将肠管放回腹腔内。如果预测近侧肠管游离度不够,吻合后张力较大,可利用此切口适当游离肠管。将10 mm trocar通过原造口处切口置人腹腔内,缝合切口两侧皮下筋膜层,固定套管并阻止漏气,建立CO2气腹(压力12 mm Hg),置人腹腔镜探查腹腔,初步判断后,腹腔镜直视下于脐部及右侧下腹附近无粘连区分别放置5 mm或10 mm trocar作为操作孔。锐性或钝性分离腹腔内粘连,必要时超声刀再次适当游离降结肠,使两肠管断端对合无张力。直肠冲洗消毒后,在腹腔镜监视下自肛门插入吻合器机身,在适当的位置穿出中心杆与抵钉座嵌合,旋紧击发,退出吻合器后自肛门注气检查吻合口有无渗漏。经右下腹trocar孔放置盆腔引流管,解除气腹,缝合原造口及各戳孔。
1.5 术后管理 患者术后给予心电监护、吸氧等常规护理;术后给予抗炎、补液及肠外营养支持治疗;鼓励患者尽早下地活动,根据患者排气时间拔除胃管,肠功能恢复后进食流食,根据引流情况择期拔出引流管,患者开始进食流食后停止肠外营养支持治疗,逐步恢复正常饮食。术后止痛多通过麻醉医师给予患者止痛泵治疗,应用约3 d。 出院标准:进食流食后无不适,血常规、生化等指标正常,无发热、腹胀、腹痛等不适主诉,切口拆线愈合良好。

2 结果
2.1 Hartmann造口还纳手术患者基线临床特点 从51例剖腹Hartmann造口还纳术患者中匹配18例作为剖腹组以完成对照。上述36例行Hartmann造口还纳配对患者在年龄、性别比、BMI、麻醉风险分级等基线临床特点差异无统计学意义(P>0.05)。见表1。

表1 36例Hartmann造口还纳患者基线临床特点 n=18
2.2 腹腔镜组与剖腹组手术史、合并症、造口还纳时间比较 36例行造口还纳患者均在首次手术术后4~12月进行还纳,所行18例腹腔镜辅助Hartmann手术中因腹腔内造口周围粘连1例,腹腔镜下操作困难而中转剖腹手术。2组患者手术史、合并症、Hartmann。术后还纳时间等方面差别无统计学意义(P>0.05)。见表2。
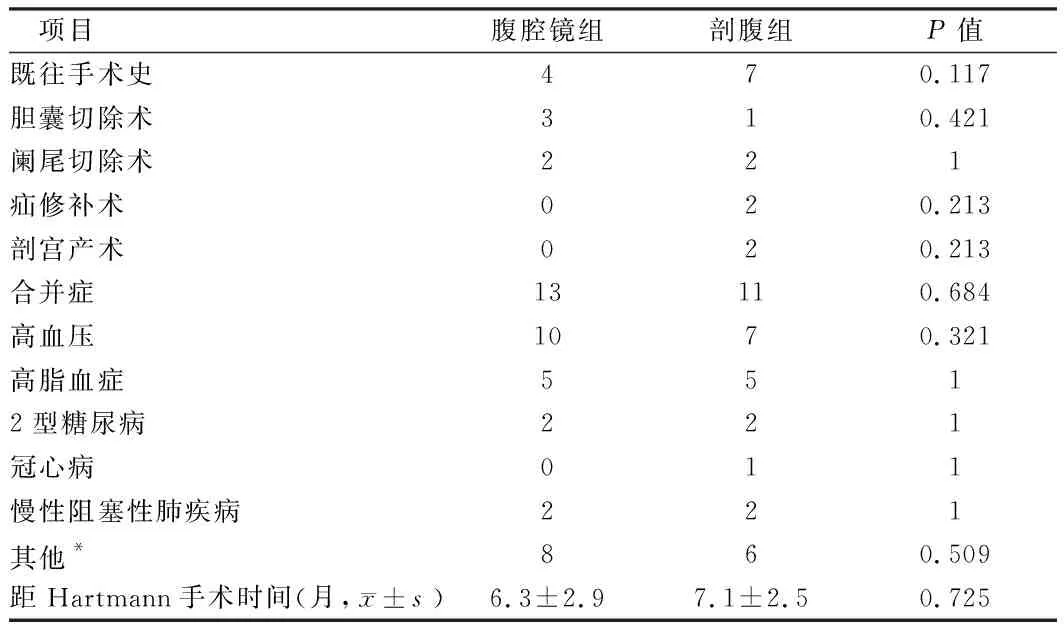
表2 腹腔镜组与剖腹组手术史、合并症、造口还纳时间比较 n=18,例
2.3 2组患者术中、术后情况比较 2组患者术中均未发生大出血、周围脏器副损伤等危及生命情况,18例腹腔镜辅助Hartmann手术中1例因腹腔内造口周围粘连,腹腔镜下操作困难而中转剖腹手术,2组手术均无吻合口瘘、死亡等情况发生。腹腔镜组术中出血量、术后肠功能恢复、住院时间均具有明显优势。2组患者比较术后并发症率均为33.3%,2组最常见术后并发症为伤口感染,剖腹组伤口感染率高于腹腔镜手术组,但差异无统计学意义(22.2% vs 11.1%,P>0.05),术后剖腹组发生肠梗阻1例,但与腹腔镜组比较差异无统计学意义(P>0.05)。所有手术患者获得4~6术后随访。见表3。
3 讨论
行Hartmann手术患者多存在高龄、肠梗阻、ASAⅢ级及以上、肿瘤播散转移等,故术者多考虑该类患者吻合口瘘、术后肠梗阻、死亡等风险较高,即使患者有强烈意愿行造口还纳,术者考虑到上述因素可能对行造口还纳术并不积极。既往研究表明Hartmann手术后行造口还纳术可明显增加术后并发症率,这些并发症包括手术相关感染、切口裂开、肠梗阻、吻合口瘘、甚至死亡等[3-5],既往研究认为腹腔镜辅助Hartmann造口还纳术死亡率可达14%~41%[6]。另外既往研究认为剖腹手术史导致腹腔内程度不一的粘连,故将开腹手术史视为腹腔镜手术的禁忌证。同时,患者在考虑到诸多风险后,行造口还纳意愿亦会明显降低。由于技术和病患等多种原因腹腔镜辅助Hartmann造口还纳术一直未得到普及,英国一项研究表明仅23%行Hartmann手术患者在四年内接受造口还纳术[1,7]。随着腹腔镜手术技术的成熟及腹腔镜技术和消化道吻合器的联合应用,腹腔镜结直肠切除及消化道重建技术的亦日益完善,腹腔镜手术并发症率明显下降,并且由于腹腔镜手术在减少疼痛、促进肠功能恢复、减少住院时间等方面的独特优势,腹腔镜技术得到广泛普及[8]。因此人们开始思考是否可以通过腹腔镜技术降低手术并发症率,从而增加Hartmann术后患者行造口还纳手术比例,而近期Van de Wall等[9]通过分析35篇既往研究总结出腹腔镜辅助Hartmann造口还纳术可降低术后并发症发生率和减少住院时间。本中心研究表明,腹腔镜组与剖腹组比较,虽然在并发症率、手术时间等方面无明显差别,但腹腔镜组明显降低术中出血量、住院时间、术后肠功能恢复时间。
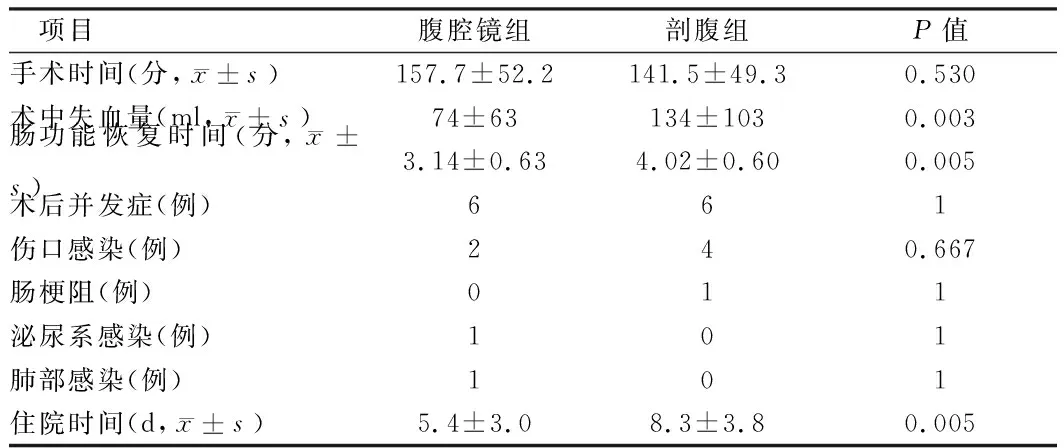
表3 2组患者术中、术后情况比较 n=18
笔者认为腹腔镜辅助Hartmann造口还纳术普及率较低的原因除了技术不成熟和患者诉求,另外很重要原因就是腹腔的粘连和直肠残端的充分显露和游离。既往研究表明,腹腔镜辅助Hartmann造口还纳术失败最主要的原因是腹腔广泛、致密的粘连;次要原因是直肠残端的显露不清[10,11]。在我中心研究中,1例病例因腹腔严重粘连而行中转剖腹手术。本次根据病例纳入标准入选的病例既往Hartmann手术均无低位直肠癌患者,多为乙状结肠癌合并梗阻患者,我中心的经验是在初次Hartmann手术时,在保证切缘阴性的前提下尽量保留足够长的直肠残端,这有助于二次手术寻找直肠残端,同时减少吻合口瘘和术后肠梗阻的发生。需要说明的是笔者经验是腹腔镜组对于直肠残端的显露明显优于剖腹组,如果扩大样本量,腹腔镜组在减少吻合口瘘方面的优势不言而喻的。
笔者认为,保证手术成功的关键在于吻合,既往研究表明行腹腔镜辅助Hartmann造口还纳术患者死亡的最主要原因就是吻合口瘘[12],因此降低术后死亡的关键亦在吻合。吻合成败的关键在于保证吻合血运和无张力,对于吻合部位血运不好肠管要果断切除,而吻合无张力依靠要充分游离直肠残端,必要时游离结肠脾曲及结肠系膜。本文36例手术患者中未出现吻合口瘘、死亡事件等情况。相比于剖腹手术,腹腔镜手术有更好的视野协助吻合器吻合,有利于游离结肠脾曲,避免了因剖腹手术中视野不好延长切口风险。
美国一项荟萃研究共纳入Hartmann造口还纳患者4 148例,此项研究从短期效果看,腹腔镜组优于剖腹手术组[13]。我中心研究提示2组术后并发症率均为33%,无死亡病例,其在术中出血量(74±63 vs 134±103,P=0.003)、术后肠功能恢复(3.1±0.64 vs 4±0.6 days,P=0.005)、住院时间(5.4±3.1 vs 8.3±4.8 days,P=0.005)均具有明显优势。同时既往研究表明,Hartmann造口还纳术后并发症率最高的是伤口感染,感染率6%~20%,但腹腔镜组伤口感染率均低于剖腹手术组[4,10,11,13]。我中心研究中腹腔镜组伤口感染率降低1倍,但差异无统计学意义(P>0.05),如果扩大样本量可能得到与国外大样本研究类似结果。
目前关于Hartmann术后造口还纳手术方式选择的相关研究多为小样本研究,既往的系统荟萃或综述统计的相关研究样本量均较小,且研究多为回顾性研究,无前瞻性随机对照研究[1,7,14]。近期的研究如韩国的Giuseppe等[11]的研究样本为29例,腹腔镜组17例,剖腹组12例,其研究表明腹腔镜辅助手术可降低手术出血量及术后排气时间。由于多数研究腹腔镜组病例数较少(n<20),而剖腹手术组病例数较多(n>40),在这种情况下易出现混杂偏倚,本研究通过个案控制配比法减少年龄、性别、BMI、麻醉风险分级等非手术因素的影响,让分析结果更真实、可靠。
腹腔镜辅助Hartmann造口还纳术可降低患者术中出血量及住院时间,促进肠功能恢复,是一种安全、可靠的的手术方式。

