循环肿瘤细胞与术后Ⅲ期结直肠癌患者化疗疗效及预后关系的研究
汪 茜 应学明 鄢少聪 赵建华
江西省景德镇市第一人民医院肿瘤科,江西景德镇 333000
结直肠癌(colorectal cancer,CRC)是最常见的恶性肿瘤之一。 预计到2030年全球新发及死亡CRC 患者会增加至约220 万以上及110 万例;在中国,预计每年有超过376 000 新发病例和191 000 死亡病例[1]。其中部分患者常因术后复发及远处转移而导致治疗失败, 其根本原因在于难以彻底清除肿瘤微转移灶。通过相关影像学检查来发现患者血液中微小、残余的肿瘤细胞是非常困难的,所以临床上亟需找到一种标记物或者方法,可以准确的监测肿瘤变化情况。 肿瘤细胞与原发性肿瘤相联系,向远处迁移、聚集,最终发生肿瘤转移。该过程被认为是由转移性前体细胞促进的,通常称为循环肿瘤细胞(circulating tumor cell,CTC)[2]。CTC 与标准的影像、病理等肿瘤检测方法相比,具有容易接受、采取便捷、易于实时进行动态监测等优势,在多种肿瘤的治疗、预后、用药指导及复发进展监测等方面有重要的参考价值[3]。 因此本研究对术后Ⅲ期CRC 患者外周血中CTC 进行检测并分型,进一步分析其与患者的临床病理特征、化疗疗效、无病生存期(disease-free survival,DFS)及总生存期(overall survival,OS)的相关性,以便为临床治疗提供更多的指导依据。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年1月江西省景德镇市第一人民医院肿瘤科收治的77 例术后Ⅲ期CRC患者作为研究对象,其中男51 例,女26 例;年龄24~75 岁,平均(54.0±3.5)岁;结肠癌40 例,直肠癌37例。本研究经医院伦理委员会审核批准,患者自愿参与并知情同意。 纳入标准:①患者经病理确诊为术后Ⅲ期CRC;②患者体力活动状态(performance status,PS)评分0~2 分[4];③患者性别不限,年龄18~75 岁,无化疗相关禁忌证,签署化疗知情同意书。排除标准:①既往患有其他恶性肿瘤者; ②有体格或精神相关疾病,无民事行为能力或限制民事行为能力者。
1.2 CTC 富集、检测分型、判读标准、阳性定义
选取患者接受术后辅助化疗前1 周内、辅助化疗2 疗程后晨起空腹时的外周静脉血5 ml 备检。 通过CanpatrolTMCTC 二代技术[4],在检测肿瘤细胞数目的同时,同步对CTC 进行分离和分型(上皮型、间质型、混合型)。 以见到CTC(CTC≥2)即为CTC 阳性结果。
1.3 观察指标及评价标准
分析化疗前总CTC 阳性率与患者临床病理特征的关系, 分析化疗前后各类型CTC 计数变化与化疗疗效的相关性及化疗后总CTC 计数变化与DFS、OS的关系。 其中临床病理特征包括:年龄、性别、分化程度、肿瘤部位、TN 分期、有无便血。 从患者入组开始,每3个月随访复查一次,包括病史、体格检查、实验室检查、胸腹盆腔CT,直肠癌患者可复查盆腔MRI,定期进行结直肠镜检查。采用复诊联合电话等方式进行随访,最终的随访日期为2020年6月30日。
1.4 统计学方法
采用SPSS 18.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,两组间比较采用χ2检验或者Fisher 确切概率法; 相关分析采用Spearman 秩相关法,生存分析采用Kaplan-Meier 法,并行log-rank 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 化疗前总CTC 阳性率与患者临床病理特征的关系
化疗前,不同年龄、性别、分化程度、部位、TN 分期、有无便血患者的总CTC 阳性率比较,差异无统计学意义(P>0.05)(表1)。

表1 化疗前总CTC 阳性率与患者临床病理特征的关系[n(%)]
2.2 化疗前后各类型CTC 计数变化与化疗疗效的关系
根据随访情况将患者分为疾病稳定(stable disease,SD)组(30 例)与疾病进展(progressive disease,PD)组(47 例)。
2.2.1 总CTC 计数变化与化疗疗效的关系 化疗后总CTC 计数比化疗前增加32 例,不变5 例,减少40 例。总CTC 计数变化与化疗疗效成负相关(r=-0.301,P<0.05)(表2)。
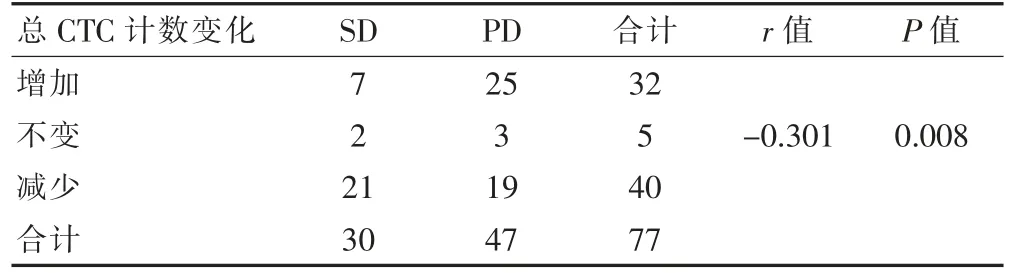
表2 化疗前后总CTC 计数变化与化疗疗效的相关性
2.2.2 上皮型CTC 计数变化与化疗疗效的关系 化疗后上皮型CTC 计数比化疗前增加7 例, 不变32 例,减少38 例。 上皮型CTC 计数变化与化疗疗效成负相关(r=-0.334,P<0.05)(表3)。
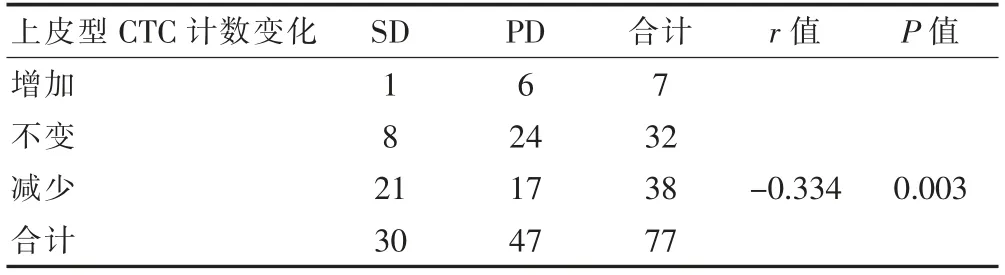
表3 化疗前后上皮型CTC 计数变化与化疗疗效的相关性
2.2.3 间质型CTC 计数变化与化疗疗效的关系 化疗后间质型CTC 计数比化疗前增加24 例,不变18 例,减少35 例。 间质型CTC 计数变化与化疗疗效成负相关(r=-0.281,P<0.05)(见表4)。
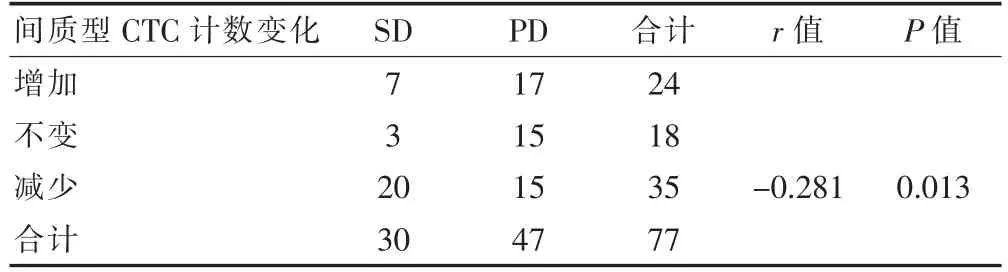
表4 化疗前后间质型CTC 计数变化与化疗疗效的相关性
2.2.4 混合型CTC 计数变化与化疗疗效的关系 化疗后混合型CTC 计数比化疗前增加32 例,不变31 例,减少14 例。 混合型CTC 计数变化与化疗疗效成负相关(r=-0.326,P<0.05)(表5)。
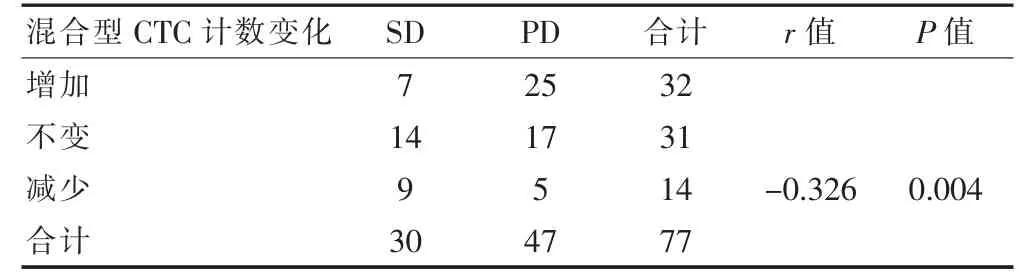
表5 化疗前后混合型CTC 计数变化与化疗疗效的相关性
2.3 化疗后总CTC 计数变化与DFS、OS 的关系
根据化疗后总CTC 计数变化趋势将中分为下降组和上升组。下降组的平均DFS 及平均OS(22.9、24.8个月)长于上升组(9.0、15.7 个月),差异有统计学意义(P<0.05)(图1~2,封三)。
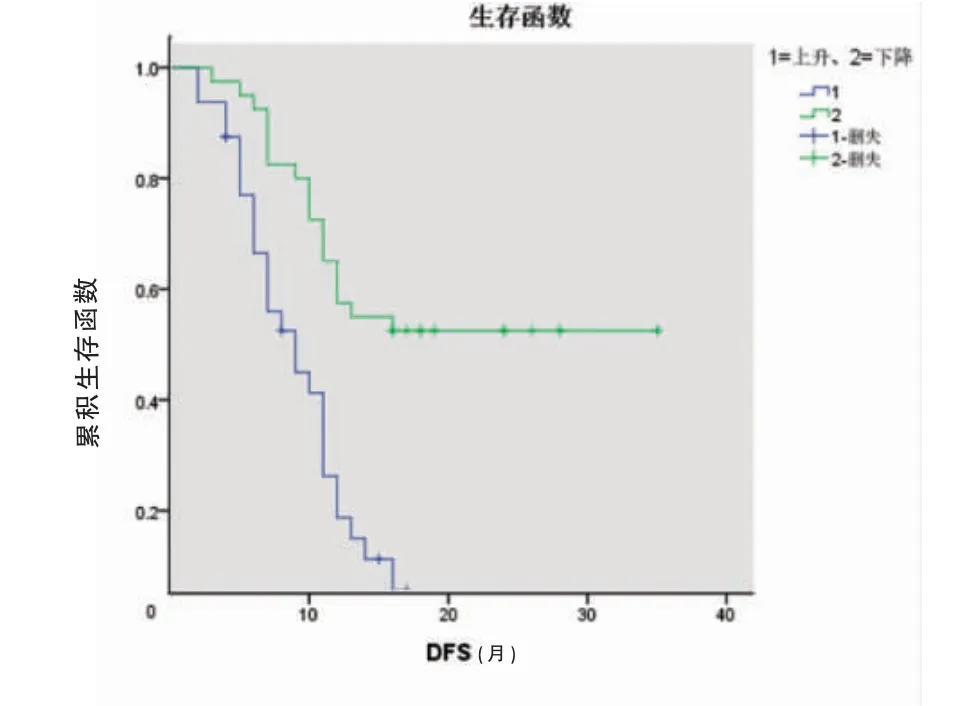
图1 两组患者的DFS 生存曲线
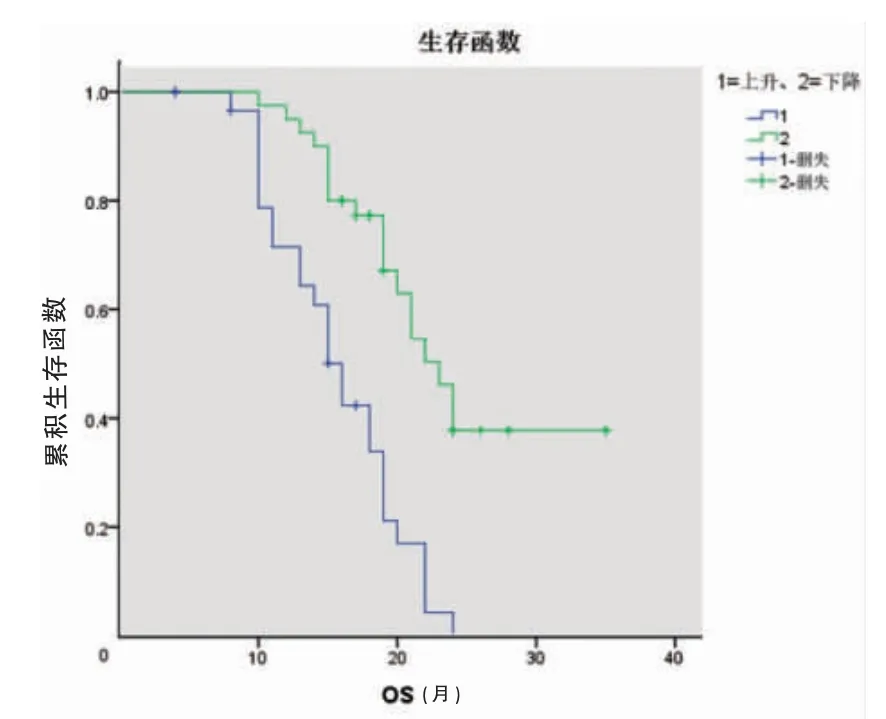
图2 两组患者的OS 生存曲线
3 讨论
CTC 是指存在于人体外周血中各类肿瘤细胞的统称。 它起源于原发性或转移性肿瘤[5-6],并进入淋巴管、外周血循环中,大多数CTC 会由于机械剪切力、免疫监视和(或)其他调节机制而在血液中遭到破坏甚至是死亡,但仍然有少数细胞能够脱离肿瘤并进入体循环,扩散至远处成功形成新的集落,进一步发展成临床上无法检测到的微转移灶,最后成为临床上可见的转移病灶[7-9]。而血行转移是恶性肿瘤最常见的转移方式之一。 在形成可见的转移灶前检测出血液中的CTC 用于监测肿瘤情况比CT 及其他影像学检查更敏感。 有研究者证实在CRC 患者外周循环血中CTC 的检测率较高,在70%以上[10]。 本研究共纳入术后Ⅲ期CRC 患者77 例,有52 例患者CTC 阳性,检出率为68%(52/77),与报道数据相近,提示术后Ⅲ期CRC患者的肿瘤病灶虽已经切除干净,但血液循环中仍存在肿瘤细胞,并且有出现转移及复发的可能,这也符合术后Ⅲ期CRC 患者仍需要足疗程的辅助治疗。
相关研究证实,CTC 的检测相比于影像检查,具有更早期、更灵敏的优点,并且快速且无创,同时可以作为肿瘤治疗有效性的一种监测方法, 是肿瘤进展、预后监测的相关标志物[11-13]。 在乳腺癌、胃癌和CRC患者中CTC 也已经被证明是一种有效的化疗及预后的监测指标[14-16]。其中一项关于22 例转移性乳腺癌患者的研究发现,治疗期间疾病进展只与总CTC 数量增加成正相关,而疾病稳定或者缓解与所有CTC 类型的数量变化都无明显相关性,总CTC 及间质型CTC计数更多者,患者的无进展生存期(progression-free survival,PFS)更短,但上皮型计数与PFS 无相关性[17]。另一项研究纳入了59 名Ⅱ-Ⅳ期胃癌患者,该研究证实化疗后CTC 计数降低者会从姑息性化疗中显著受益,且患者的中位PFS 和OS 更长[18]。 纳入1203 例中国CRC 患者的研究显示,总CTC、间质型CTC 的数量均与淋巴结和远处转移成正相关,但上皮型无显著相关性[19]。另一项入组32 例Ⅲ期结直肠癌患者根治术后的研究证实,化疗后CTC 数值升高者与CTC 数值不变甚至下降者比较,其PFS 更短,且差异显著[20-21],但该项研究未对CTC 分型进一步深入探讨。本研究结果显示,化疗前后总CTC、上皮型CTC、间质型CTC、混合型CTC 计数变化均与化疗疗效成负相关 (r=-0.301、r=-0.334、r=-0.281、r=-0.326,P<0.05); 下降组的平均DFS 及平均OS 长于上升组,差异有统计学意义(P<0.05)。 今后可以更进一步深入研究,寻找CTC或者其某种分型是否能成为某种肿瘤或某些肿瘤特异性的早期及治疗监测的标志物,并能尽快广泛运用于临床,为患者带来更多获益。
综上所述,目前对CTC 的研究众多,各研究及其结果都有所不同, 本研究结果证实CTC 有望成为术后Ⅲ期CRC 患者治疗效果的监测指标。

