温度对克氏原螯虾肠道菌群结构的影响
王飞飞 王夏雯 金倩 张智慧 王泽平 田胜营 王信海

摘要: 采用高通量测序技术,利用16S rRNA序列信息,研究了不同养殖温度条件下克氏原螯虾肠道菌群的多样性。测序结果显示:15 ℃、19 ℃、23 ℃、27 ℃、31 ℃养殖水温下,变形菌门、拟杆菌门和厚壁菌门为肠道主要菌门,丛毛单菌属和鞘脂单胞菌属为主要菌属。养殖水温不同,肠道优势菌群所占比例不同,丛毛单菌属在水温 15 ℃处理组占比最高,鞘脂单胞菌属19 ℃处理组占比最高。Alpha多样性分析结果显示, 23 ℃处理组克氏原螯虾肠道菌群Simpson指数和Shannon指数显著高于15 ℃、19 ℃、27 ℃处理组(P<0.05),23 ℃处理组柠檬酸杆菌和气单胞菌丰度较高,是其特有菌属,也是虾类主要致病菌。试验结果初步显示,温度是影响克氏原螯虾肠道菌群结构进而导致病害发生的重要因素之一。
关键词: 克氏原螯虾;肠道菌群;温度;高通量测序
中图分类号: S966.12 文献标识码: A 文章编号: 1000-4440(2022)01-0157-08
Abstract: Using high-throughput sequencing technology and 16S rRNA sequence information, the intestinal flora diversity of Procambarus clarkii under different temperatures was studied. The sequencing results showed that Proteobacteria, Bacteroidetes and Firmicutes were the dominant flora at the phylum level at 15 ℃,19 ℃,23 ℃, 27 ℃and 31 ℃, Curvibacter and Sphingomonas were the dominant genera at the genus level. The proportion of these dominant intestinal flora was different with different temperatures. Curvibacter had the largest proportion in 15 ℃ group,and Sphingomonas had the largest proportion in 19 ℃ group. Alpha diversity analysis results indicated that Simpson index and Shannon index in 23 ℃ group were significantly higher than those in 15 ℃, 19 ℃, 27 ℃ groups (P<0.05). Particular bacteria in the 23 ℃ group were Aeromonas and Citrobacter, which were also the main pathogenic bacteria of shrimp. The above research results preliminarily explain the effects of temperature on the microbial community and disease outbreak of Procambarus clarkii.
Key words: Procambarus clarkii;gut microbiota;temperature;high-throughput sequencing
克氏原螯蝦 (Procambarus clarkii) ,属于节肢动物门(Arthropoda)甲壳纲(Crustacea),俗称小龙虾,近年来已成为中国重要的养殖水产品。2018年中国克氏原螯虾养殖面积超过1.10×106 hm2,出口超过1.00×106 t[1]。养殖规模不断提高的同时,病害问题也日益突出,导致养殖效益大幅下降,环境污染时有发生,克氏原螯虾的质量安全也受到较大的影响,产业的可持续发展受到挑战。研究结果表明细菌感染是导致克氏原螯虾死亡的重要原因,肠道菌群与克氏原螯虾健康息息相关,保持肠道菌群的动态平衡有助于抵抗病原体侵入,有效预防病害发生[2]。
水产品肠道菌群动态平衡与温度有着密切的联系。全紫娇等[3]研究发现,随着水温的改变,刺参肠道菌群结构变化显著。Liu等[4]研究发现秋季克氏原螯虾肠道菌群多样性和丰度高于夏季。有研究者认为克氏原螯虾病害集中爆发的“五月瘟”是由于水温的变化引起克氏原螯虾肠道菌群失衡而导致的[5]。养殖水温与克氏原螯虾肠道菌群多样性之间有何联系,水温变化与克氏原螯虾疾病爆发有何关联,目前尚未见到相关报道,克氏原螯虾肠道菌群结构与温度关系缺乏系统性的研究。
本研究对不同温度下克氏原螯虾肠道细菌微生物16S rRNA基因序列进行测定,以期找出养殖水温与克氏原螯虾肠道细菌菌群结构及多样性之间的内在联系,明确易致病细菌菌群随温度变化规律,为克氏原螯虾疾病预防提供参考。
1 材料与方法
1.1 材料
试验开始于2020年3月20日,克氏原螯虾来自宿豫玲珑水产公司养殖基地,捕捞后置于充氧水箱中,30 min内运至实验室,暂养7 d,水温设置在15 ℃左右。然后从中选择活力强、大小均匀的克氏原螯虾用于试验。试验设5个温度梯度,依次为15 ℃、19 ℃、23 ℃、27 ℃、31 ℃,每组3次重复,试验水箱容量20 L,均装有控温电热棒,箱内放置10 cm 长的 PVC 管作为克氏原螯虾躲避物,每个水箱放幼虾15尾,规格为每尾1 g左右,共计225尾。水温初始均为15 ℃,然后以0.5 ℃/h逐渐升温至试验温度。试验期间,每天吸污、换水各1次,换水量约为原水量的20%,换水温度与试验温度一致。养殖时间为21 d,其间,每天上午、下午各喂料1次,投喂量为虾总质量的3%~4%。
1.2 样品制备
试验达到养殖天数后,停止喂料24 h,从每个水箱随机取5只克氏原螯虾,在无菌环境下,取出肠道内容物并充分混合后,置于无菌离心管,作为一个样品处理。共获得样品15个,每个样品在处理完成后,立即放入准备好的干冰盒中,送至鑫普华生物公司进行处理及测序,处理方法参照文献[6]中的方法进行,16S rRNA测序在Illumina MiSeq PE300平台完成。
1.3 数据处理
测序后,用Pandaseq软件、PRINSEQ软件、Usearch软件分别进行序列拼接、质控处理及去除嵌合体,选择Silva数据库进行比对。
1.4 统计分析方法
使用Excel 对数据进行处理,数值采用平均值±标准差。利用SPSS 18.0软件分析数据,利用R语言制作相关图形。
2 结果与分析
2.1 不同温度下克氏原螯虾肠道菌群测序结果
测序结果(表1)显示,不同温度处理组15个样品共计获得有效序列1 920 880条,平均128 058.6条,有效序列占比均超过80%,符合分析要求。为了保证分析结果合理,各样品统一按照最低样本数量(62 607)进行分析,一致性97%以上的序列作为同一个分类操作单位OTU(Operational taxonomic units)处理,15个样品共计聚类8 216个OTU。测序深度99.05%~99.46%,测序效果良好。Alpha多样性分析结果(表2)显示,31 ℃组中,Chao1指数显著高于其他4组(P<0.05),Observed-sopecies指数显著高于15 ℃、19 ℃、27 ℃处理组,表明温度在31 ℃时克氏原螯虾肠道菌群的丰富度比其他养殖温度肠道菌群高,Simpson指数和Shannon指数在23 ℃处理组显著高于15 ℃、19 ℃、27 ℃处理组,表明该温度下肠道菌群的多样性比其他养殖温度高。
2.2 不同养殖温度下克氏原螯虾肠道菌群组成分析
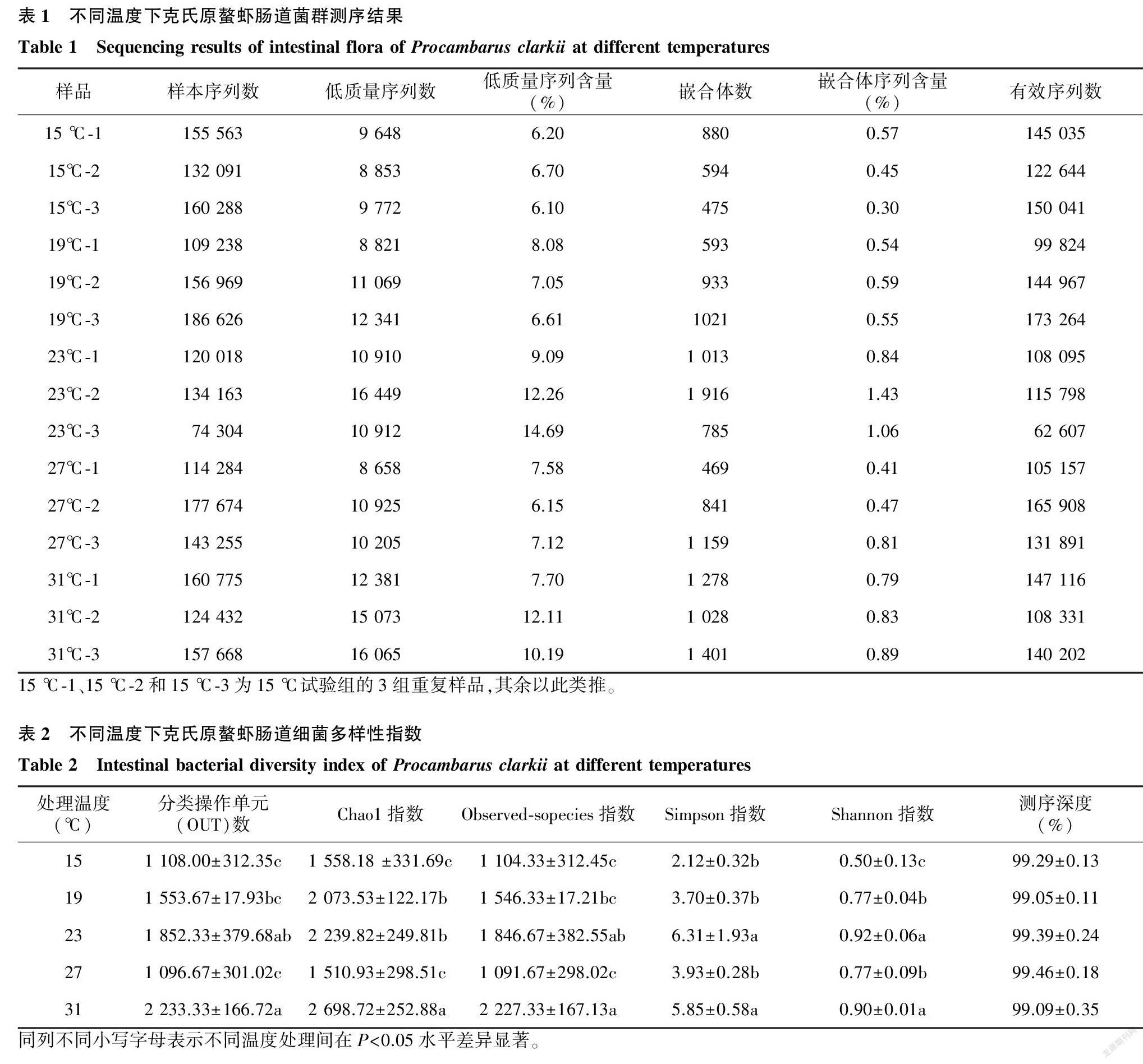
在门分类水平上,选取丰度靠前的20个物种进行分析(图1),发现变形菌门(Proteobacteria)、拟杆菌门( Bacteroidetes) 和厚壁菌门(Firmicutes)是各温度组克氏原螯虾肠道的主要菌群。其中变形菌门占比均超过50%,在15 ℃、19 ℃处理组所占比例超过90%,在23 ℃处理组占比最低(52.6%)。拟杆菌门在27 ℃处理组占比例最大(5.6%),15 ℃处理组占比最低(0.9%)。厚壁菌门在23 ℃处理组占比例较大(8.7%),15 ℃处理组占比最小(1.1%)。
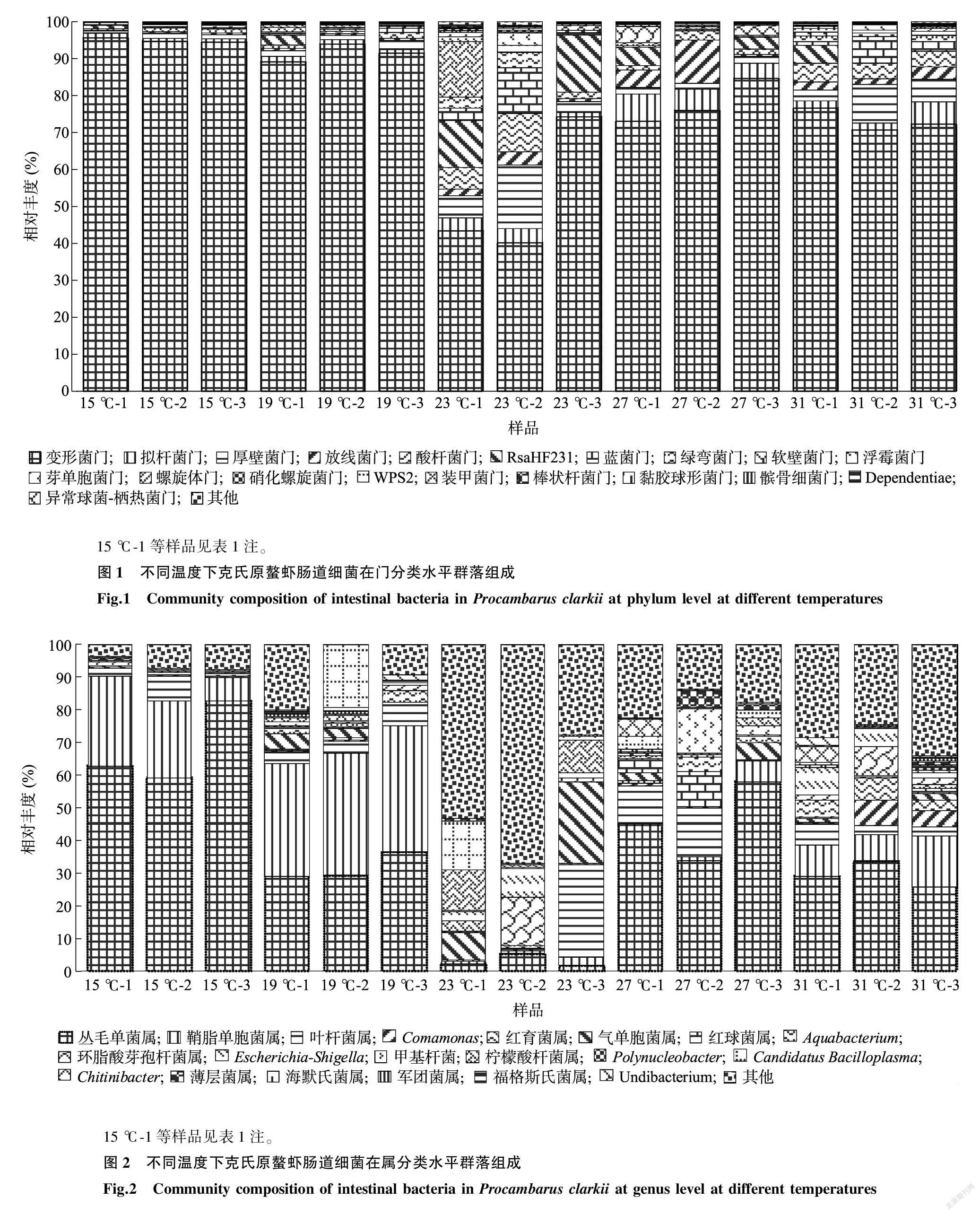
在属分类水平上(图2),丛毛单菌属(Curvibacter)是15 ℃、27 ℃和31 ℃处理组的优势菌属,不同温度下各处理组所占比重差别较大,15 ℃处理组所占比例最大(68.2%),23 ℃处理组所占比例最少(3.1%)。鞘脂单胞菌属(Sphingomonas)受温度影响也较大,在15 ℃、19 ℃、31 ℃处理组占比较大,其中19 ℃处理组占比最大(36.8%);在23 ℃、27 ℃处理组占比较小,其中23 ℃处理组占比最少(1.3%)。气单胞菌屬(Aeromonas)、柠檬酸杆菌属(Citrobacter)在23 ℃处理组占比分别为11.2%、7.7%,在其他处理组别中占比较少。
物种热图更加直观显示不同样品优势菌群之间的差异。由图3可知,变形菌门是各组的优势菌群,23 ℃、27 ℃、31 ℃处理组主要菌群丰度较高。由图4可知,在属水平上,23 ℃处理组菌群结构与其他组有较大差异,优势菌群不同于其他处理组。丛毛单菌属、鞘脂单胞菌属是15 ℃、19 ℃、27 ℃、31 ℃处理组优势菌群。
2.3 不同温度下克氏原螯虾肠道菌群相似性分析
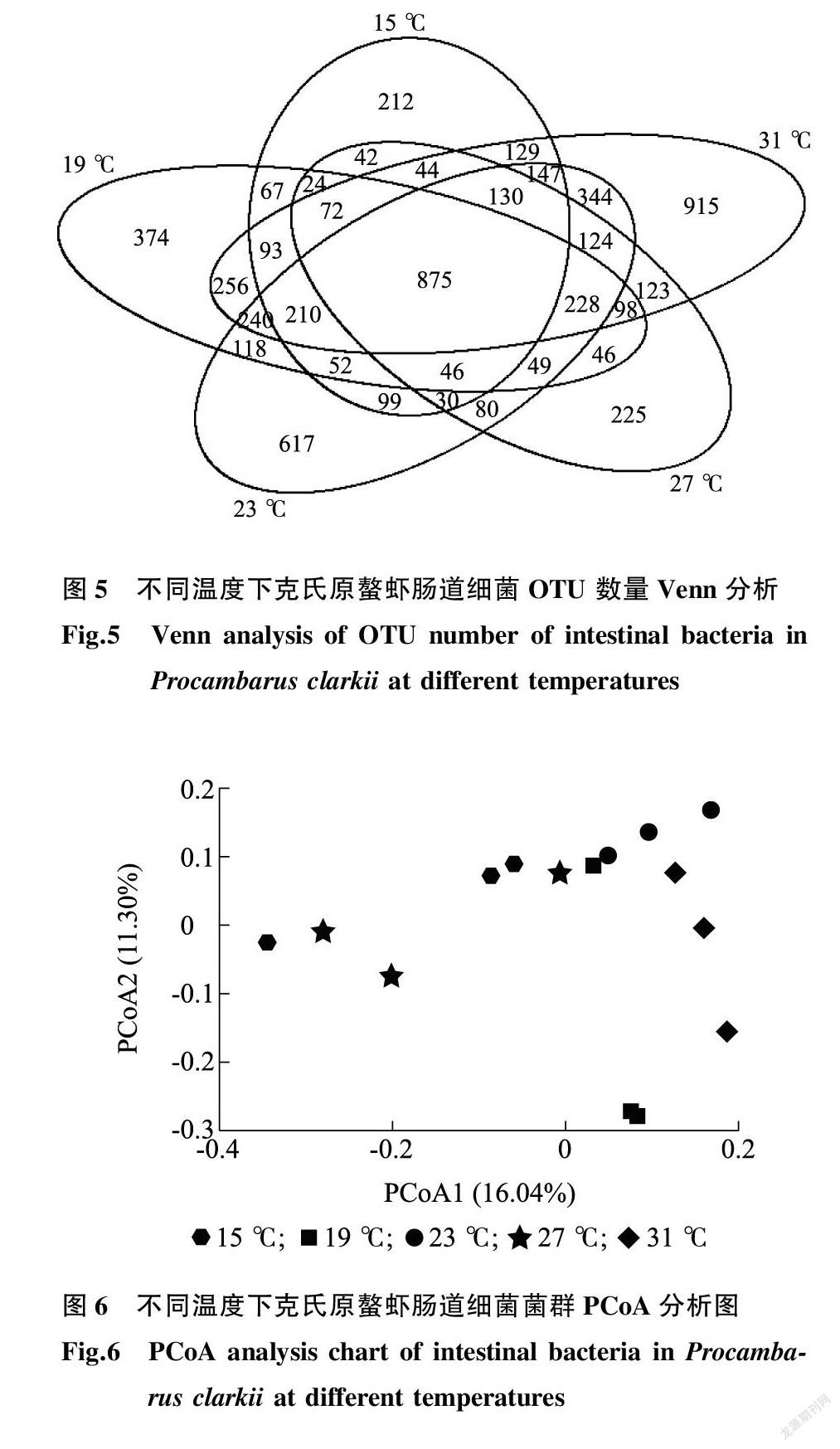
根据OTU聚类分析结果,构建韦恩图(图5)。图5直观展示了各组OTU数目组成的特有性与相似性,5个样品共有875个OTU,占总数8.5%。说明克氏原螯虾肠道菌群受温度影响较大,15~31 ℃独有的OUT数量分别为212、374、617、225、915。31 ℃处理组独有的OUT最多,说明31 ℃处理组克氏原螯虾肠道菌群最复杂。
主坐标分析结果(图6)显示,同一处理均落在相同区域,说明样品具有较好的重复性;15 ℃、27 ℃处理组呈现区域性聚集,19 ℃、23 ℃、31 ℃处理组呈现区域性聚集,说明肠道菌群受温度影响较大。
3 讨论
3.1 温度对克氏原螯虾肠道菌群多样性的影响
采用高通量测序技术对不同温度条件下克氏原螯虾肠道样品进行测序,5个样品共获得克氏原螯虾肠道细菌菌群33门、60纲、140目、265科、955属,测序深度达到99%以上,其结果可以有效反映出克氏原螯虾肠道细菌菌群组成。水产品肠道微生物菌群多样性受温度影响较大,如吉富罗非鱼(Oreochromis niloticus)肠道菌群在水温22 ℃和28 ℃时丰度显著高于其他温度[7]。Sha等[8]研究发现水温为14 ℃时不同规格的养殖海参(Apostichopus japonicus)肠道组织中均检测不到弧菌属(Vibrio),而其他温度下存在弧菌属,说明养殖海参肠道内弧菌菌群与养殖温度息息相关。温度也是影响水产品养殖水体生物菌群多样性重要因素,如拟穴青蟹(Scylla paramamosain)养殖水温过高或过低均会导致水体菌群丰度和多样性显著减小[9]。本研究结果显示,虾肠道菌群多样性在23 ℃时最高,31 ℃时肠道菌群的丰富度最高。
3.2 基于门水平的不同温度克氏原螯虾菌群组成分析
由聚类分析结果可知,变形菌门、拟杆菌门和厚壁菌门是克氏原螯虾肠道主要菌群。这与陈一鸣等[10]、Liu等[4]研究结果一致,但本研究中变形菌门占比较大,优势明显,其余门类占比较小,推测可能与养殖环境有关。变形菌门是水产动物如大黄鱼(Larimichthys crocea)、中华绒螯蟹(Eriocheir sinensis)、凡纳滨对虾(Litopenaeus vannamei )等[11-13]肠道中的优势菌群。本研究结果显示克氏原螯虾肠道中变形菌门丰度随着温度升高表现为先下降后上升的趋势,在23 ℃时菌群丰度最低。研究者认为甲壳动物肠道变形菌门比例升高会增加爆发疾病的风险,中华绒螯蟹、凡纳滨对虾等[14-15]感染白斑综合征(WSSV)后变形菌门相对丰度会明显上升,但陈一鸣等[10]研究发现克氏原螯虾患病前后变形菌门相对丰度未见显著变化。本试验养殖期间未发现克氏原螯虾患病,因此不能推断变形菌门丰度变化与克氏原螯虾患病之间的联系。研究结果表明拟杆菌门丰度与碳水化合物代谢呈正相关关系,厚壁菌门丰度与营养转运相关呈正相关关系[16],拟杆菌促进能量代谢,厚壁菌促进营养吸收。本研究中拟杆菌门和厚壁菌门丰度随着温度的升高先上升后下降。拟杆菌门和厚壁菌门丰度在23 ℃和27 ℃时较高,说明在23 ℃和27 ℃克氏原螯虾吸收和代谢水平较其他温度高。
3.3 基于属水平的不同温度克氏原螯虾肠道菌群组成分析
根据聚类分析结果,不同温度处理组样品中均发现丛毛单菌属和鞘脂单胞菌属,但其丰度受温度影响较大。研究发现丛毛单胞菌属细菌丰度常与水体有机物浓度呈正相关,丛毛单菌属大部分细菌可分解酚类物质、硝基苯类化合物、铵态氮等物质[17-18],鞘脂单胞菌属细菌常被用来降解有机污染物[19]。彭辉辉等[20]研究发现常规稻田水体丛毛单菌属细菌高于养鲤鱼稻田水体,主要是因为常规稻田水体中有机物浓度较高。罗金飞[9]研究发现拟穴青蟹水体中的鞘脂单胞菌属细菌丰度在22 ℃时最高,且与铵态氮含量呈显著正相关。本试验中克氏原螯虾幼虾肠道丛毛单菌属细菌丰度随温度的升高表现为先下降后上升的趋势,在23 ℃时占比最小,且远低于其他温度。有研究者认为虾类自身微生物生态与养殖环境关系密切[21-23],推测本试验中23 ℃时有机物浓度较低,导致水体丛毛单菌属、鞘脂单胞菌属细菌丰度较低,进而影响克氏原螯虾肠道中丛毛单菌属、鞘脂单胞菌属细菌含量。
本研究发现23 ℃组气单胞菌属和柠檬酸杆菌属占比较大,在其他处理组中占比较小。气单胞菌和柠檬酸杆菌是淡水养殖主要致病菌,气单胞菌感染鱼类后容易引发败血症、肠炎及皮肤溃烂坏死等症状[24-28]。气单胞菌也是引起虾类发病的主要病原菌[29]。陈一鸣等[10]研究发现患病克氏原螯虾肠道气单胞菌属细菌丰度显著高于健康虾。郁维娜等[30]研究发现感染白斑综合征病毒的凡纳滨对虾肠道中气单胞菌属等菌群数量显著升高。有研究者认为克氏原螯虾五月份集中发病的主要原因是由于气单胞菌等病菌感染所致[31]。本研究中23 ℃处理温度接近五月份克氏原螯虾池塘养殖水温,23 ℃处理组克氏原螯虾肠道气单胞菌豐度高于其他温度处理组,说明温度可能是影响气单胞菌丰度的重要因素。目前已有柠檬酸杆菌感染中华鳖(Trionyx sinensis)、棘胸蛙(Quasipaa spinosa)和青鱼(Mylopharyngodon piceus)等引发疾病的报道[32-34]。柠檬酸杆菌属细菌是从爆发疾病的克氏原螯虾、红螯螯虾(Cherax quadricarinatus)、凡纳滨对虾等虾蟹品种中分离出来的主要致病菌之一[35-37]。Liu等[4]研究不同季节克氏原螯虾肠道菌群发现秋季精养池塘中克氏原螯虾肠道柠檬酸杆菌属细菌丰度比夏季显著升高。本研究中23 ℃处理组克氏原螯虾肠道柠檬酸杆菌丰度远高于31 ℃处理组,说明温度可能是影响柠檬酸杆菌属细菌丰度的重要因素。综上所述,本试验结果表明温度可能是造成克氏原螯虾肠道气单胞菌属和柠檬酸杆菌属等致病菌增加的主要原因。
本研究初步阐明了水温对克氏原螯虾肠道菌群特别是一些致病菌群的影响,下一步将继续研究不同温度对克氏原螯虾机体生理生化指标的影响,进一步探讨温度与克氏原螯虾疾病爆发之间的理论机制。
参考文献:
[1] YAN S,ZHENG B G,GUO F L,et al.Gut microbiota of red swamp crayfish Procambarus clarkii in integrated crayfish-rice cultivation model[J].Applied Microbiology and Biotechnology Express,2020,10(5):2-11.
[2] 丁正峰,薛 晖,夏爱军,等.白斑综合征病毒在养殖克氏原螯虾中感染流行研究[J].南京农业大学学报,2008,31(4):129-133.
[3] 全紫娇,高萍萍,张 杨,等.不同温度下刺参肠道菌群结构与功能[J].生态学杂志,2019,38(9):2756-2764.
[4] LIU Q,LONG Y N,LI B,et al.Rice-shrimp culture:a better intestinal microbiota,immune enzymatic activities,and muscle relish of crayfish (Procambarus clarkii) in Sichuan Provinced[J].Microbiology and Biotechnology,2020,104:9413-9420.
[5] SHEN G Q ,ZhANG X,GONG J,et al.Transcriptomic analysis of Procambarus clarkii affected by ‘Black May’disease[J].Scientifc Reports,2020,10(2):12-25.
[6] 郝长富,李 刚,孙 熙,等.不同饲料饲育的家蚕幼虫肠道细菌的多样性分析[J].昆虫学报,2019,62(1): 63-74.
[7] 曾楠楠.不同水温对吉富罗非鱼的饲料蛋白质需要量、生理代谢及肠道微生物的影响[D].上海:上海海洋大学,2020.
[8] SHA Y,LIU M,WANG B,et al.Gut bacterial diversity of farmed sea cucumbers Apostichopus japonicas with different growth rates[J].Microbiology,2016,85:109-115.
[9] 罗金飞,廖永岩,李书迪,等.温度对拟穴青蟹循环水养殖系统微生物群落结构的影响[J].中国水产科学,2020,27(4):393-405.
[10]陈一鸣,顾泽茂,李莉娟,等.白斑综合征病毒感染对克氏原螯虾肠道菌群的影响[J].华中农业大学学报,2020,39(2):40-46.
[11]魏 娜.大黄鱼 (Larimichthys crocea )肠道菌群结构及其与宿主经济性状间的关系[D].厦门:集美大学,2016.
[12]WANG C H,ZHOU F,LV D W,et al.Change in the intestinal bacterial community structure associated with environmental microorganisms during the growth of Eriocheir sinensis[J].Microbiology Open, 2018,8(5):727-739.
[13]PTACNIK R,SOLIINIA A G,ANDERSEN T,et al.Diversity predicts stability and resource use efficiency in natural phytoplankton communities[J].Proc Natl Acad Sci USA,2008,105(13):5134-5138.
[14]DING Z F,CAO M J,ZHU X S,et al.Changes in the gut microbiome of the Chinese mitten crab (Eriocheir sinensis )in response to white spot syndrome virus (WSSV)infection [J].Journal of Fish Diseases,2017,40(11):1561-1571.
[15]WANG J,HUANG Y,XU K,et al.White spot syndrome virus (WSSV)infection impacts intestinal microbiota composition and function in Litopenaeus vannamei [J].Fish & Shellfish Immunology,2019,84:130-137.
[16]TURNBAUGH P J,HAMADY M,YATSUNRNKO T,et al.A core gut microbiome in obese and lean twins[J].Nature,2008,457(7228):480-484.
[17]SCHLEHECK D,VON N F,FLEISCHMANN T,et al.Missing link in linear alkylbenzenesulfonate surfactant degradation:4-sulfoacetophenone as a transient intermediate in the degradation of 3-(4-sulfophenyl)butyrate by comamonas Shewanella strains isolated from the north-west pacific ocean[J].Systematic and Applied Microbiology,2010,26(2):293-301.
[18]趙 燕,薛林贵,李 琳,等.丛毛单胞菌在环境污染物降解方面的研究进展[J].微生物学通报,2012,39(10): 1471-1478.
[19]秦 伟.不同放养密度和水草覆盖度下底埋培养基的克氏原螯虾池塘底泥微生物群落特征[D].上海: 上海海洋大学,2015.
[20]彭辉辉,张 凯,陈成勋,等.鲤(Cyprinus carpio)对稻田水体浮游植物及环境因子的影响研究[J].天津农学院学报,2020,27(1):37-43.
[21]李 可,郑天凌,田 蕴,等.南美白对虾肠道微生物群落的分子分析[J].微生物学报,2007,47(4):649-653.
[22]罗 鹏,胡超群,谢珍玉,等.凡纳滨对虾咸淡水养殖系统内细菌群落组成的PCR-DGGE分析[J].热带海洋学报,2006,25(2):49-53.
[23]王春忠,林国荣,严 涛,等.长毛对虾海水养殖环境以及虾肠道微生物群落结构研究[J].水产学报,2014,38(5):706-712.
[24]CASCON A,YUGUEROS J,TEMPRANO A,et al.A major secreted elastase is essential for pathogenicity of Aeromonas hydrophila [J].Infection and Immunity,2000,68(6):3233-3241.
[25]KIRN T J,JUDE B A,TAYLOR R K,et al.A colonization factorlinks Vibrio cholerae environmental survival and humaninfection [J].Nature,2005,438(7069):863-866.
[26]敖秋桅,朱佳杰. 3个罗非鱼种群对4种病原菌的抗病力差异比较[J].南方农业学报,2020,51(3):695-701.
[27]吴亚锋,王楠楠,王晶晶,等. 2017年和2018年江苏省水生动物气单胞菌分离鉴定及耐药分析[J].江苏农业科学,2020,48(24):156-162.
[28]张 曼,王振光,高 峰,等. 巴马拟缨鱼源嗜水气单胞菌分离鉴定及其致病力分析[J]. 南方农业学报,2020,51(9):2051-2060.
[29]马小荣,薛 晖,唐建清.克氏原螯虾致病性嗜水气单胞菌的分离鉴定及药敏试验[J].水产养殖,2012,33(8):45-47.
[30]郁维娜,戴文芳,陶 震,等.健康与患病凡纳滨对虾肠道菌群结构及功能差异研究[J].水产学报,2018,42(3):399-408.
[31]周冬仁,章文敏,李建应,等.克氏原螯虾细菌性病原的分离与鉴定[J].中国农学通报,2011,27(26):102-105.
[32]李本旺,李春枝,张邦杰,等.中华鳖口咽腔溃烂综合症病原的研究[J].水产科技情报,2000,27(5): 210-213.
[33]程晓云,郑芊芷,宋婷婷,等.棘胸蛙白内障病原鉴定及药敏试验[J].浙江农业科学,2016,57(7): 1141-1143.
[34]王家祯,耿昕颖,朱世馨,等.青鱼源布氏柠檬酸杆菌的分离鉴定及药敏试验[J].中国兽医科学,2016,46(5):602-606.
[35]沈锦玉,顾志敏,潘晓艺,等.红螯螯虾弗氏柠檬酸杆菌病病原的分离与鉴定[J].中国水产科学,2005,12(2):197-200.
[36]李 可,郑天凌,田 蕴,等.南美白对虾肠道微生物群落的分子分析[J].微生物学报,2007,47(4):649-653.
[37]肖 宁,孔令严,周 昊,等.克氏原螯虾病原弗氏柠檬酸杆菌的分离鉴定及其药敏与黏附特性[J].水产学报,2016,40 (6):946-955.
(责任编辑:张震林)
2308501186304

