钻叶紫菀对镉胁迫的生理响应及富集转运特征
陈 伟,蒋文艳,杨玉霞,廖 洁,梁雪莲,王海军,魏源文,王天顺
(广西农业科学院农产品质量安全与检测技术研究所/全国名特优新农产品全程质量控制技术南宁中心,南宁 530007)
【研究意义】镉(Cd)对植物是一种非必需重金属元素,Cd污染主要来源于工业采矿及农药、污泥和磷肥施用等人类活动,且Cd对生态环境污染的影响随着工农业的迅速发展而日益加重[1],以矿山开采过程洗矿和选矿废液排放及尾矿中所含的Cd对周围环境、地表水和地下水造成的污染更严重[2]。目前,Cd污染土壤的修复方法主要有物理、化学和生物修复等。植物修复属于生物修复技术,已开始进入初步商业化阶段,是国际学术界研究的热点之一[3]。近年来,我国报道具有自主知识产权的超积累植物,有Zn超积累植物东南景天、As超积累植物蜈蚣草、Cd超积累植物油菜和宝山堇菜、Cr超积累植物李氏禾及Mn超积累植物商陆和青葙,但品种有限,与我国是一个植物资源十分丰富的大国地位不相称。广西农业科学院农产品质量安全与检测技术研究所环境修复调控课题组前期已筛选出对Cd具有富集和耐性强且生物量较大(株高达160 cm,单株鲜重达1.01 kg)的菊科植物钻叶紫菀(AstersubulatusMichx.),但未深入探讨其受Cd胁迫的生理指标及对Cd的富集转运特征。因此,分析Cd胁迫条件下钻叶紫菀的生理指标变化情况及对Cd的富集转运特征,对挖掘重金属富集植物及推动Cd污染环境的植物修复技术应用具有重要意义。【前人研究进展】超富集植物是指能超量吸收重金属并将其转移到地上部的植物,其不仅可超量累积植物生长发育所必需的重金属离子,还可耐受并累积一些非必需重金属离子,如Cd、Cr和Pb等。由于各种重金属在地壳中的丰度及在土壤和植物中的背景值存在差异,因此超富集植物的富集浓度界限也有所不同,目前采用较多的是Baker和Brooks[4]提出的参考值,即将地上部Cd含量在100.00 mg/kg以上,Co、Cu、Ni和Pb含量在1000.00 mg/kg以上,以及Mn和Zn含量在10 000.00 mg/kg以上的植物称为超富集植物。理想的超富集植物还应具有抗逆性强、生物量大(尤其是地上部生物量)及能同时富集2种或多种重金属的特点。据不完全统计,目前全球共发现720多种重金属超富集植物,其体内重金属浓度均达到或超过Baker和Brooks[4]设定的标准,其中,Ni超富集植物约300种、Pb超富集植物17种、Zn超富集植物21种、Cd超富集植物20种、Cu超富集植物38种、Mn超富集植物11种和As超富集植物5种等,而且多分布于欧洲、中亚、非洲和北美洲[5]。近年来研究较多的Cd超富集植物有油菜[6]、商陆[7]、圆锥南芥[8]、叶用红菾菜[9]和宝山堇菜[10]。部分超富集植物在重金属污染植物修复方面已得到应用,如涂鹏飞等[11]在Cd轻度污染的土壤进行冬季种植红叶甜菜与夏季复种花生轮作,结果发现该轮作模式可将土壤Cd含量由0.316 mg/kg降至0.286 mg/kg;陈绩等[12]利用黄腐酸钾和东南景天联合修复Cd污染土壤,在0~4个月且黄腐酸钾用量为0.3%时修复效果最明显,东南景天地上部Cd积累量显著提高;童文彬等[13]采用有机物料和特异内生菌强化等措施,利用东南景天/油葵轮作修复田间条件下土壤中的Cd,经一轮修复就能从土壤中提取出Cd 394.8 g/hm2。【本研究切入点】目前,关于钻叶紫菀受Cd胁迫后生理指标变化情况及对Cd富集转运特征的研究鲜见报道。【拟解决的关键问题】开展梯度浓度Cd胁迫对钻叶紫菀叶部过氧化氢酶(CAT)、过氧化物酶(POD)和叶绿素含量的影响及钻叶紫菀根、茎、叶组织对Cd的吸收、转运和富集能力研究,旨在阐明钻叶紫菀对Cd的富集耐受能力,以期为Cd污染土壤的植物修复、植物Cd富集和耐受机制研究提供种质资源,为推动利用植物修复Cd污染环境提供参考依据。
1 材料与方法
1.1 试验材料
采样所在的铅锌矿区属亚热带季风气候,四季分明,雨热同季,光照充足;春季干旱多风,夏季高温多雨,秋季温和凉爽,冬季温和少雨,年均气温约23 ℃,年均降水量1780 mm,年无霜期一般长达350 d以上。采样区土壤pH 6.4~8.3、有机质4.9~33.4 g/kg、全磷0.027%~0.094%、全钾1.05%~1.34%、全氮0.030%~0.168%、全镉9.8~24.4 mg/kg、全铅539.8~1083.5 mg/kg、全锌548.3~1044.2 mg/kg。供试钻叶紫菀的种子采自铅锌矿区,种子经乙醇消毒后种植在无Cd土壤中进行幼苗培养。
1.2 试验方法
1.2.1 试验设计 采用营养液砂培试验,待钻叶紫菀幼苗长出6张完整叶片时,选取生长一致的幼苗,用超纯水冲洗根部,移栽于口径、高和底径分别为16.0、11.0和9.0 cm的塑料桶,每桶含砂2.5 kg,种植钻叶紫菀3株,施加营养液1.0 L[14],10 d后再施营养液1.0 L,期间补充超纯水维持钻叶紫菀生长。培养30 d后,施用不同浓度含Cd营养液,每处理3次重复。试验设7个浓度Cd(以CdCl2·2.5H2O形态加入)处理,分别为对照(CK,0 mg/L)及T1(2.5 mg/L)、T2(5.0 mg/L)、T3(10.0 mg/L)、T4(15.0 mg/L)、T5(20.0 mg/L)和T6(30.0 mg/L)处理,用0.1 mol/L NaOH或0.1 mol/L HCl调节营养液的pH为5.6左右。各Cd浓度处理首次施用Cd营养液0.5 L,每隔3 d再施用含Cd营养液0.5 L,连续施用5次,之后每隔3 d施用超纯水0.5 L,CK同期施用纯水0.5 L,24 d后测量各处理钻叶紫菀的株高并采收植株备用。
1.2.2 样品采集与处理 将采收的钻叶紫菀植株除去黏附的细沙,用自来水将根部冲洗干净,再将根部置于20.0 mmol/L的Na2-EDTA溶液中浸泡20 min以除去表面吸附的Cd2+,以去离子水将植株反复冲洗干净后再用吸水纸擦拭干净[15]。
将钻叶紫菀分为根、茎和叶3个部分,取部分叶片用液氮速冻后超低温保存,用于测定CAT活性、POD活性和叶绿素含量,其余根、茎和叶于105 ℃杀青30 min后,在70 ℃烘箱中烘干至恒重,计算根、茎和叶的干重(生物量)及叶的含水率,研磨样品过0.5 mm筛后称取磨碎的根、茎和叶各0.2000 g至微波消解罐中,加入3.0 mL H2O2和6.0 mL浓HNO3后密封进行微波消解,消解液转移至容量瓶定容后待测。
1.2.3 测定项目及方法 采用紫外吸收法测定CAT活性[16],采用愈创木酚法测定POD活性[16],采用比色法测定叶绿素含量[17],采用石墨炉原子吸收光谱仪测定钻叶紫菀根、茎和叶的Cd含量[18],采用直接测定法测定钻叶紫菀的株高[18],采用烘干恒重法测定钻叶紫菀的生物量[19]。
Cd转运系数(TF)=茎或叶Cd浓度/根Cd浓度
Cd富集系数(BCF)=根或茎或叶Cd浓度/培养介质Cd浓度
1.3 统计分析
试验数据采用Excel 2010进行整理,以SPSS 18.1进行差异显著性分析。
2 结果与分析
2.1 Cd胁迫对钻叶紫菀株高的影响
如表1所示,所有Cd处理钻叶紫菀的株高较CK均有所降低,其中,降幅较大的是T1和T2处理,其株高分别较CK显著降低10.0%和10.6%(P<0.05,下同),其余处理的株高与CK无显著差异(P>0.05,下同);与T1处理相比,T2处理钻叶紫菀的株高降低0.7%,但差异不显著,而T3~T6处理钻叶紫菀的株高分别较T1处理升高2.5%、5.2%、3.3%和7.6%,但差异不显著。可见,不同浓度Cd胁迫条件下钻叶紫菀生长均受到不同程度的抑制,但10.0~30.0 mg/L Cd胁迫钻叶紫菀的株高生长均优于2.5~5.0 mg/L Cd胁迫。
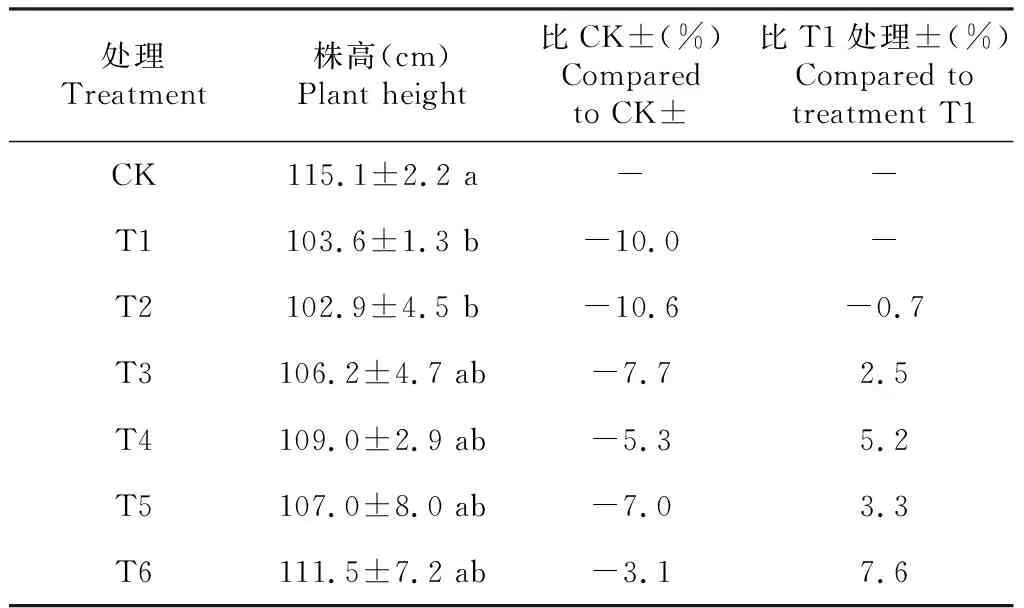
表1 不同浓度Cd胁迫对钻叶紫菀株高的影响
2.2 Cd胁迫对钻叶紫菀生物量(干重)的影响
如表2所示,T1和T3处理钻叶紫菀的干重分别较CK降低9.8%和9.9%,但差异不显著;T2、T4、T5和T6处理的干重分别较CK显著降低19.2%、17.2%、16.8和14.2%;与T1相比,随着Cd胁迫浓度的增加,钻叶紫菀的干重呈现下降趋势,但差异均未达显著水平,其中T2处理钻叶紫菀干重的降幅最大,降低10.4%。可见,不同浓度Cd胁迫均能降低钻叶紫菀的干重,但2.5和10.0 mg/L Cd胁迫对钻叶紫菀干重的影响相对较小。
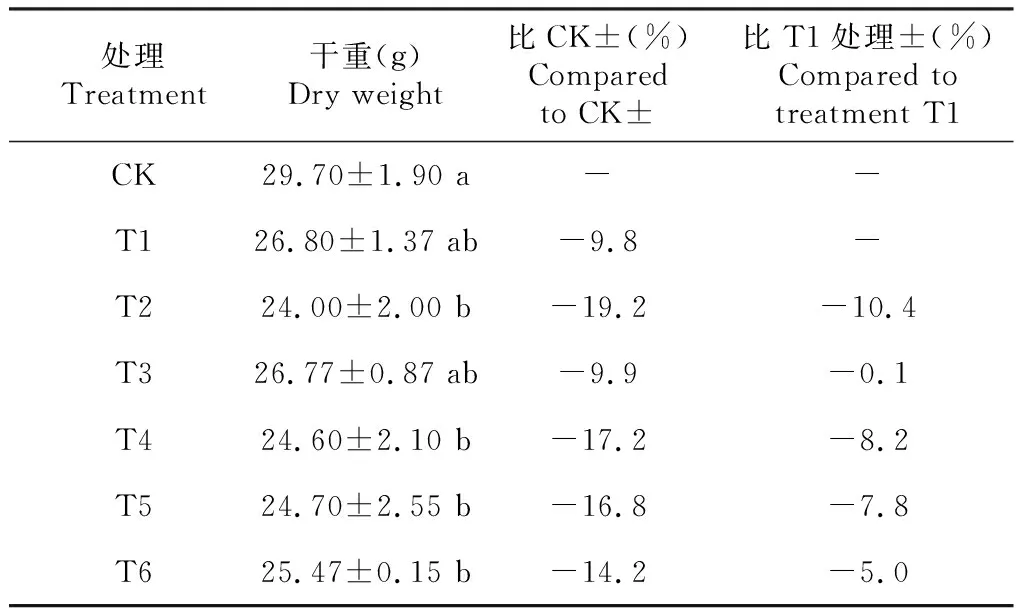
表2 不同浓度Cd胁迫对钻叶紫菀干重的影响
2.3 Cd胁迫对钻叶紫菀叶片CAT活性的影响
从图1可看出,与CK相比,T1处理钻叶紫菀叶片的CAT活性仅提高1.38%,差异不显著;其他处理钻叶紫菀叶片的CAT活性均显著提高,其中,T3处理的CAT活性最高,其增幅最大,达47.80%,且显著高于其他处理,而T4处理的CAT活性增幅最小,仅16.86%;随着Cd胁迫浓度的提高,钻叶紫菀叶片CAT活性呈先上升后下降再上升的变化趋势。可见,不同浓度Cd胁迫对钻叶紫菀叶片CAT活性均具有提升作用,但升幅不同,表明Cd胁迫的钻叶紫菀叶片CAT可能发生了应激反应,从而在一定程度上缓解Cd对叶片的胁迫作用。
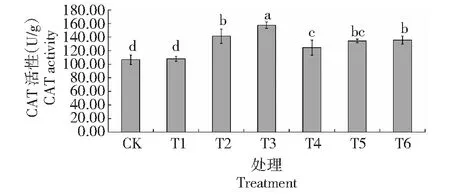
图柱上不同小写字母表示差异显著(P<0.05),下同Different lowercase letters on the bar represented significant difference(P<0.05),the same as below图1 不同浓度Cd胁迫对钻叶紫菀叶片CAT活性的影响Fig.1 Effects of different Cd concentration treatments on CAT activity in leaves of A. subulatus Michx.
2.4 Cd胁迫对钻叶紫菀叶片POD活性的影响
从图2可看出,与CK相比,所有Cd胁迫处理钻叶紫菀叶片的POD活性均显著提高,其中,T5和T6处理的增幅最大,分别增加72.75%和72.03%,T3处理的增幅最小,仅增加23.95%;随着Cd胁迫浓度的提高,钻叶紫菀叶片POD活性呈先上升后下降再上升的变化趋势。可见,不同浓度Cd胁迫均可显著提高钻叶紫菀叶片的POD活性,但提高幅度不同,表明Cd胁迫下钻叶紫菀叶片POD可能发生了应激反应,从而在一定程度上缓解Cd对叶片的胁迫作用。

图2 不同浓度Cd胁迫对钻叶紫菀叶片POD活性的影响Fig.2 Effects of different Cd concentration treatments on POD activity in leaves of A. subulatus Michx.
2.5 Cd胁迫对钻叶紫菀叶片叶绿素含量的影响
从图3可看出,与CK相比,T1、T2和T3处理钻叶紫菀叶片的叶绿素含量稍有增加,增幅分别为11.17%、4.86%和15.89%,但差异不显著;其余处理钻叶紫菀叶片的叶绿素含量均显著增加,其中T5处理的增幅最大,增加33.36%。可见,不同浓度Cd胁迫对钻叶紫菀叶片叶绿素含量均有提升作用,但提升幅度不同,表明Cd胁迫对钻叶紫菀叶片叶绿素含量增加具有促进作用,这或许是本研究中钻叶紫菀叶片始终保持绿色未出现肉眼可见毒害现象的原因所在。
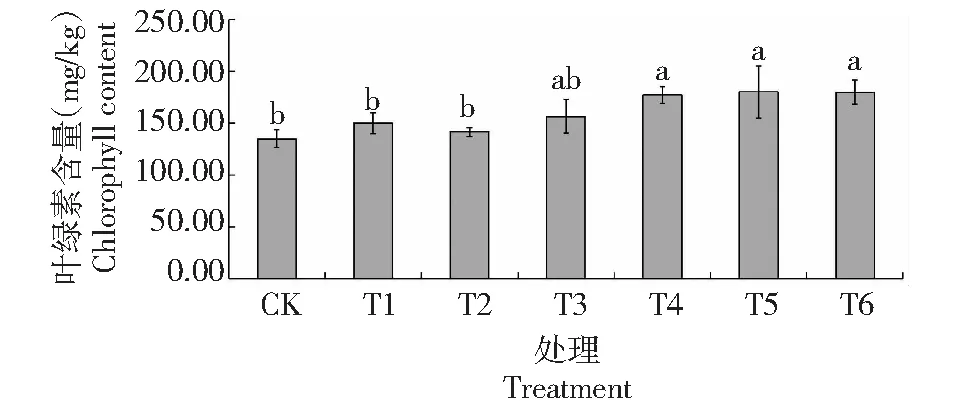
图3 不同浓度Cd胁迫对钻叶紫菀叶片叶绿素含量的影响Fig.3 Effects of different Cd concentration treatments on chlorophyll content in leaves of A. subulatus Michx.
2.6 Cd胁迫对钻叶紫菀Cd含量的影响
从表3可看出,随着Cd浓度的增加,与CK相比,钻叶紫菀根、茎和叶的Cd含量明显增加,其中,T6处理钻叶紫菀根、茎和叶的Cd含量均达最大值,分别为1075.13、34.33和179.47 mg/kg;与T1处理相比,除T2处理根和茎的Cd含量外,其余处理根、茎和叶的Cd含量均显著增加,其中T2处理根、茎和叶的Cd含量较T1处理分别增加78.20%、56.48%和247.41%,T6处理根、茎和叶的Cd含量较T1处理分别增加12.37、3.68和24.17倍。可见,随着Cd胁迫浓度的增大及培养时间的延长,钻叶紫菀生长过程中Cd由根部吸收并向地上部转运,在地上部累积能力逐渐增强。

表3 不同浓度Cd胁迫对钻叶紫菀Cd含量的影响
2.7 Cd胁迫对钻叶紫菀Cd转运和富集的影响
从图4可看出,在Cd胁迫下,Cd从钻叶紫菀根部转运至茎叶过程中,随着Cd胁迫浓度的增大,叶Cd的TF呈现先增大后减小再增大的变化趋势,茎Cd的TF呈逐渐减少趋势;叶Cd的TF为0.09~0.17,茎Cd的TF为0.03~0.09,其中,T4处理叶Cd的TF最小,比T1处理减小4.32%;T2处理叶Cd的TF升至最大值0.17,是T1处理的1.91倍;茎Cd的TF在T6处理时最小,为0.03,仅为T1处理的35.16%。
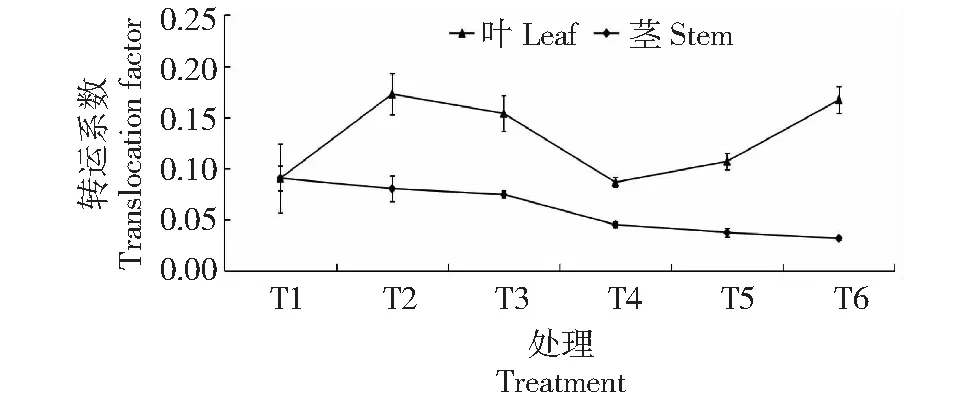
图4 不同浓度Cd胁迫对钻叶紫菀Cd TF的影响Fig.4 Effects of different Cd concentration treatments on Cd TF in A. subulatus Michx.
从图5可看出,在Cd胁迫下钻叶紫菀根、茎和叶对Cd均有一定的富集作用。随着Cd胁迫浓度的增大,钻叶紫菀根Cd的BCF呈先减小后增大再减小的变化趋势,其中,T3处理根的BCF最小,为25.31,比T1处理减小21.34%,T5处理根Cd的BCF最大,为39.25,比T1处理增大21.99%;茎Cd的BCF呈逐渐减小的变化趋势,在T6处理时最小,为1.14,仅为T1处理的39.02%;叶Cd的BCF呈先增大后减小再增大的变化趋势,但T2~T6处理的BCF均大于T1处理,以T6处理叶Cd的BCF最大,为5.98,是T1处理的2.10倍。

图5 不同浓度Cd胁迫对钻叶紫菀Cd BCF的影响Fig.5 Effects of different Cd concentration treatments on Cd BCF in A. subulatus Michx.
综上所述,钻叶紫菀对Cd有较强的吸收富集能力,且具有一定的转运能力,可尝试作为Cd富集或超富集能力植物用于Cd污染土壤或湿地修复。
3 讨 论
植物吸收Cd并在各组织间转运累积会影响其生理生化过程,抑制植物正常生长,从而影响植物株高和生物量[20]。朱润华等[21]研究表明,随着培养介质中Cd浓度的增大,苦苣幼苗的株高呈现下降趋势,与CK相比,在10.0 mg/L Cd处理下苦苣幼苗株高下降22.2%。关萍等[22]研究结果也显示,在Cd胁迫条件下2种蔊菜的株高均较CK下降。本研究结果与上述研究结果相似,不同浓度外源Cd胁迫钻叶紫菀的株高均呈降低趋势,但叶片始终保持绿色未出现肉眼可见的毒害现象,其中,5.0 mg/L处理钻叶紫菀的株高降幅相对较大,较CK显著降低10.6%,而10.0~30.0 mg/L处理钻叶紫菀的株高与CK无显著差异。
花莉等[23]研究发现,随着Cd胁迫浓度的增大,龙葵的生物量较CK下降。黄欣等[24]研究认为,高浓度和低浓度Cd胁迫对翅碱蓬的生物量均有一定的抑制作用。邹淑华等[25]研究证实,在Cd胁迫下东南景天的生物量积累受到抑制。本研究结果与上述研究结果相似,所有Cd浓度胁迫钻叶紫菀的干重均呈下降趋势,其中5.0 mg/L Cd胁迫钻叶紫菀的干重降幅相对较大,较CK降低19.2%。但也有研究表明,低浓度Cd胁迫能促进植物生物量增加,高浓度Cd胁迫会抑制植物生长[26]。
植物遭遇重金属胁迫时,其体内自由基含量及活性氧随之提升,此时植物会启动自身的抗氧化酶系统应对逆境胁迫[27]。唐秀梅等[28]研究发现,龙葵的POD和CAT活性随着Cd胁迫浓度的增大呈先升高后降低再升高的趋势。花莉等[23]研究表明,随着Cd胁迫浓度增大,龙葵叶片的POD和CAT活性均呈先升高后降低再升高的趋势。本研究也发现类似现象,随着Cd胁迫浓度增大,钻叶紫菀叶片的POD和CAT活性均呈先升高后降低再升高的趋势,这可能是POD和CAT活性均随着钻叶紫菀体内活性氧的增多其应激性升高,二者协同作用消除了过氧化物和自由基产生的毒害。但也有不同的研究观点,如王利芬等[29]研究认为,随着Cd胁迫浓度的增大,金盏菊叶片中POD和CAT活性呈先升高后降低的趋势;朱润华等[21]试验发现,随着Cd水培浓度的增大,苦苣幼苗叶片的POD活性呈先降低后升高的趋势,这可能与不同试验条件、Cd胁迫浓度和植物不同有关。本研究还发现,在不同浓度Cd胁迫下,钻叶紫菀叶片的POD和CAT活性均高于CK,表明Cd胁迫并未抑制钻叶紫菀抗氧化酶的生物合成,酶活性的升高在一定程度上可缓解自由基和活性氧对钻叶紫菀造成的损伤,使钻叶紫菀整个代谢系统依然正常运行,这可能是钻叶紫菀抗氧化系统较一般植物抗逆性强的缘故。
叶绿素在植物光合作用中发挥着极其重要的作用,与光合作用紧密相关[30]。康育鑫等[31]研究发现,莴苣(紫艳)在Cd胁迫下合成较多叶绿素,光合作用效率极大提高,可帮助其缓解Cd胁迫产生的毒害。本研究中,在不同浓度Cd胁迫下钻叶紫菀叶片的叶绿素含量均呈先升高后降低再升高又降低的变化趋势,且均高于CK,这可能与本研究中设置的Cd胁迫浓度范围未对叶绿体的功能造成伤害,从而仍可维持钻叶紫菀叶片光合作用正常进行有关。
张思宇等[32]研究发现,Cd在黄顶菊植株体内含量表现出根>叶>茎的规律。本研究发现,随着Cd胁迫浓度的增大,钻叶紫菀根、茎和叶的Cd含量也逐渐增加,除T1处理茎的Cd含量大于叶的Cd含量外,Cd在钻叶紫菀组织中积累能力均表现为根>叶>茎。在Cd污染土壤(Cd含量<150.00 mg/kg)种植修复植物马缨丹,其根、茎和叶的BCF均大于1.00,但TF均小于1.00[33];在1.0 mg/L Cd处理下培养绿苋菜,其地上和地下部的BCF分别为17.55和33.08,TF为0.53[34];在10.0 mg/L Cd处理下培养芦苇,其地上和地下部的BCF分别为94.5和190.7,TF为0.496[35]。本研究结果表明,Cd胁迫下钻叶紫菀叶的TF为0.09~0.17,茎的TF为0.03~0.09,根的BCF为25.31~39.25,茎的BCF为1.14~2.93,叶的BCF为2.85~5.98,根、茎和叶的BCF均大于1.00。可见,钻叶紫菀对Cd具有很强的富集能力,但转运能力一般。
本研究发现,30.0 mg/L Cd胁迫钻叶紫菀叶的Cd含量达179.47 mg/kg,超过Baker和Brooks[4]设定的Cd超富集植物标准(100.0 mg/kg),已具备Cd超富集植物特征,且钻叶紫菀仍可正常生长,叶片CAT活性、POD活性和叶绿素合成均未受到明显抑制。在Cd胁迫浓度增大到钻叶紫菀生理耐受极限前,钻叶紫菀根、茎和叶组织的Cd含量一定还会继续增加,其茎的Cd含量完全有可能也超过设定的Cd超富集植物标准,因此,后续试验可通过扩大Cd胁迫浓度范围,从根、茎和叶组织亚细胞Cd、Cd化学形态及分子机理方面进一步探究钻叶紫菀的Cd富集能力和机理,明确钻叶紫菀对Cd的耐受阈值,也可在后续试验中尝试利用钻叶紫菀的Cd富集或超富集能力修复Cd污染土壤或湿地。
4 结 论
在2.5~30.0 mg/L Cd胁迫条件下,钻叶紫菀的株高、生物量、POD活性、CAT活性和叶绿素含量均受到一定程度影响,但钻叶紫菀仍可正常生长。钻叶紫菀根、茎和叶组织对Cd有较强的吸收富集能力,且具有一定的转运能力,在Cd浓度达到一定程度时表现出Cd超富集植物特征,因此,可尝试将钻叶紫菀作为Cd富集或超富集能力植物用于Cd污染土壤或湿地修复。

