猪源化脓隐秘杆菌分离的鉴定与病原特性研究
姜 轩,徐承倩,张 欣,张 奥,赵瑞利,马吉飞,孙英峰
(天津农学院 动物科学与动物医学学院,天津 300384)
化脓隐秘杆菌(Arcanobacterium pyogenes)又称化脓放线菌(Actinomyces pyogenes),属于隐秘杆菌属(Arcanobacterium)。该菌最早于1893年从牛的脓汁中分离到,常引起猪、牛、羊等动物的化脓性感染,表现为肺炎、关节炎、心内膜炎、乳腺炎、皮下脓肿等疾病[1],也曾有化脓隐秘杆菌感染人的事件报道[2]。该菌的临床致病性与所携带的毒力因子密切有关,目前已报道的化脓隐秘杆菌毒力因子有多种,如溶血素(pyolysin,Plo)、神经氨酸酶(neuraminidase,NanH)、胶原结合蛋白(CbpA)等,其中同时携带Plo基因和NanH基因的菌株的致病性要强于携带其他几种毒力因子的菌株[3-5]。本研究对2019年3月从天津地区某猪场发病猪的肺脏脓肿中分离到的1株病原菌,进行了细菌常规鉴定、16S rRNA序列及毒力基因PCR检测与耐药性实验。通过对该病原菌的生物学特性、遗传进化、毒力因子和耐药情况,为猪化脓隐秘杆菌的流行病学调查及临床防治提供理论数据。
1 材料与方法
1.1 病料来源 天津市某规模化猪场断奶仔猪,病猪体温达到41℃,食欲废绝,个别猪严重呼吸困难。无菌条件下采集肺脏脓肿物进行细菌分离鉴定,编号为NF1913。
1.2 试剂与培养基 鲜血平板培养基购自凯林贸易有限公司;革兰氏染色试剂盒、药敏纸片、生化鉴定管等均购自杭州微生物有限公司;10×PCR buffer、dNTP、Taq酶等均购自宝生物工程(大连)有限公司;其他试剂均为分析纯。
1.3 试验动物 健康昆明系小鼠20只,体重18~22 g,购自北京维通利华实验动物技术有限公司。
1.4 引物设计与合成 根据GenBank中公开发表的细菌16S rRNA基因设计通用性引物。依据参考文献[6]合成化脓隐秘杆菌毒力基因Plo、NanH、CbpA、NanP引物。引物由生工生物工程(上海)有限公司合成,具体信息见表1。

表1 本研究使用引物序列Table 1 Primer used in this study
1.5 细菌的分离培养及纯化 在无菌条件下将肺部浓汁划线培养于鲜血琼脂平板上,37℃恒温培养48 h,挑取可疑单克隆菌落进一步纯化后,将该单克隆菌株命名为TJjh1913,革兰染色观察分离株的形态染色特征。
1.6 细菌生化试验 参考文献[7-8]将纯化后的菌液接种至不同细菌微量生化试验管内,37℃恒温培养48 h,观察记录结果,参照细菌生化鉴定手册进行判定。
1.7 药物敏感性试验 根据美国临床实验室标准化协会(Clinical & Laboratory Standards Institute,CLSI)推荐的纸片扩散法和判断标准[8]对分离到的菌株进行药敏试验。取100 μL的新鲜菌液均匀涂布在鲜血平板培养基上,选取药敏纸片贴在平板表面,倒置放37℃恒温培养箱中培养48 h,测量抑菌圈直径判定菌株对药物的敏感性。
1.8 细菌16S rRNA 基因与毒力基因PCR扩增与测序 按照DNA抽提试剂盒说明书进行细菌基因组DNA提取,进行16S rRNA及毒力相关基因的PCR扩增与测序。扩增体系:DNA模板5 μL,10× PCR buffer 2.5 μL,dNTPs(2.5 mmol/L)2 μL,上、下游引物各 1 μL,Taq 酶 0.5 μL,用ddH2O 补至25 μL。PCR 扩增程序:94℃预变性4 min;94℃变性 30 s,56℃/60℃退火 30 s,72℃延伸 60 s,共35个循环,72℃再延伸10 min。以 1%琼脂糖核酸凝胶电泳检测 PCR 产物。并按照DNA凝胶回收试剂盒的操作说明进行切胶回收,连接pMD19-T载体并转入JM109感受态细胞,将阳性菌液送生工生物工程(上海)有限公司进行基因序列测定。将测序结果与NCBI中GenBank登录的序列进行比对,运用DNAStar软件将所得序列和参考序列进行同源性比较并构建系统发育树。
1.9 小鼠致病性试验 将小鼠随机分成5组,每组5只,第1~4组为实验组,第5组为空白对照组[6]。依次将108、107、106、105CFU/mL化脓隐秘杆菌菌液培养物分别腹腔注射试验组小鼠,0.1 mL/只。对照组注射相同剂量液体培养基。各组接种后隔离饲养,每12 h观察小鼠临床表现。对各组出现症状及死亡的小鼠进行剖检,分离细菌并鉴定及病理组织切片观察。
2 结果
2.1 细菌分离培养结果 病料接种鲜血琼脂平板,置于37℃条件下培养48 h后长出肉眼可见的细小菌落,菌落呈光滑、湿润、表面凸起、边缘整齐、针尖状乳白色,并呈β溶血现象(图1)。将分离纯化后的菌株进行革兰氏染色。结果显示,分离得到的菌株为革兰氏阳性菌,外形为两段钝圆、形态或曲或直的短小多形态杆菌(图1)。
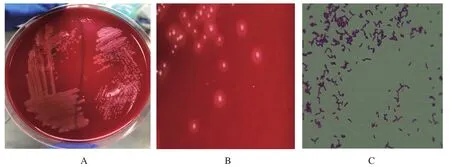
图1 NF1913在血平板上的菌落形态与革兰染色结果Fig.1 The result of colony morphology and Gram stain of NF1913
2.2 细菌生化试验结果 观察并记录不同微量生化培养管内颜色的变化,参照试剂盒内说明书的判定标准与《伯杰氏细菌鉴定手册》,将实验结果进行对比,其特性与化脓隐秘杆菌相似,结果初步判定为化脓隐秘杆菌(表2)。

表2 NF1913的生化试验结果Table 2 Biochemical test result of NF1913
2.3 药敏试验结果 结果显示,头孢类药物(头孢噻呋、头孢哌酮、头孢唑林、头孢曲松)和部分喹诺酮类(左氧氟沙星、环丙沙星)高度敏感;对氨基糖苷类药物(丁胺卡那、庆大霉素、新霉素)、甲硝唑、林可霉素、杆菌肽等耐药(表3)。
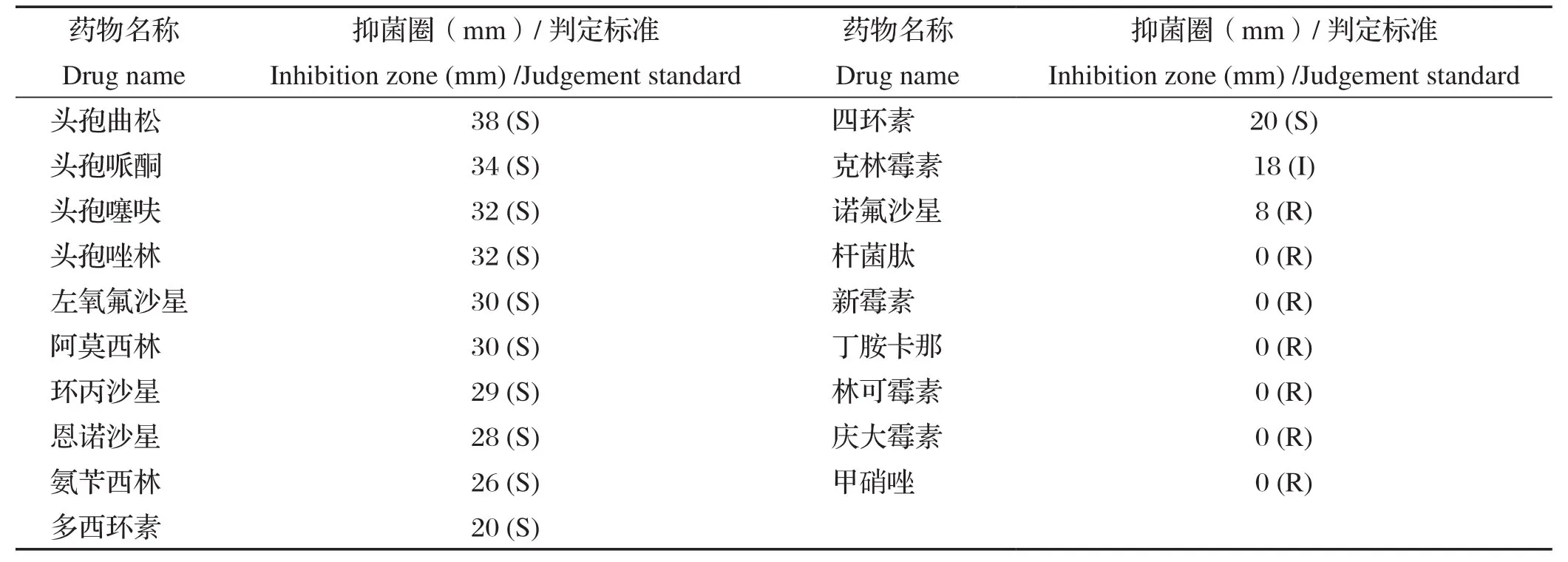
表3 NF1913药敏试验结果Table 3 Drug sensitivity test results of NF1913
2.4 细菌NF1913 16SrRNA基因扩增结果 通过16S rRNA引物进行PCR扩增,测序结果显示,本次分离得到的菌株为化脓隐秘杆菌,该菌株与中国新疆株(GenBank登录号:JX975440)的基因同源性高达98%,与国内外已发表的分离自水牛、山羊、猪等动物体内的化脓隐秘杆菌的基因同源性达95%以上。从图2建立的菌株进化树可以看出,分离菌株NF1913与JX975440(中国新疆)关系最近;与CP029004与CP033902的关系相对较远。说明本次分离的菌株与国内和国外其他分离株存在地域差异。

图2 基于16S rRNA基因核酸序列遗传进化树Fig.2 The phylogenetic tree based on the nucleotide sequence of l6S rRNA gene
2.5 毒力基因PCR扩增结果 将NF1913的4种毒力基因进行PCR扩增,结果显示,本分离株同时携带有Plo、NanH、CbpA三种毒力基因(图3),与之前报道的同时携带Plo基因和NanH基因的菌株的致病性要强于携带其他几种毒力因子的菌株,推测该分离株具有较强致病力。
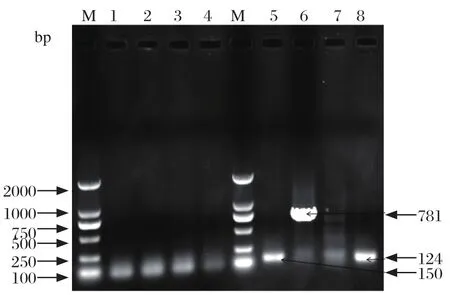
图3 毒力基因的PCR扩增结果Fig.3 The results of virulence genes detection
2.6 小鼠致病性试验结果 昆明系小鼠接种NF1913菌株后12 h开始出现死亡,其他小鼠精神沉郁,采食活动减少等临床症状;18 h后攻毒108CFU/mL试验组小鼠全部死亡,对照组小鼠未出现死亡现象且精神食欲均正常。按照Reed-Muench法计算出菌株NF1913的LD50为2.04×105CFU。小鼠病理组织切片显示,正常组织肺泡壁较薄且均匀,其他组织无充血、水肿等病理变化,攻毒小鼠各脏器均出现不同程度的水肿和炎性细胞浸润,肺脏组织可见肺泡腔内有少量红细胞、肺泡壁毛细血管增厚等病理变化(图4A~D)。采集死亡小鼠脏器进行细菌分离并进行16S rRNA基因扩增及测序,结果与从病猪体内分离到的化脓隐秘杆菌一致。

表4 不同浓度菌株N1913的小鼠毒力试验Table 4 Mice toxicity test of strain N1913 at different concentrations

图4 小鼠组织石蜡切片(400×)Fig.4 Paraffin section of mouse tissue (400×)
3 讨论
化脓隐秘杆菌作为隐秘杆菌属中致病力最强的病原体,是常存在于家畜(猪、牛、羊)体内的条件致病菌,可引起动物发生肺炎、乳房炎、子宫内膜炎、关节炎及肾脏脓肿等疾病,严重时可因败血症引起家畜死亡[9]。该菌能感染的动物种类广泛,多引起反刍动物(牛、羊)等动物的发病,但近年来该菌感染猪的病例时有发生,鲁兴华等[10-12]分别在上海市、广东省、四川省等地分离到猪源化脓隐秘杆菌。本试验从天津一规模化猪场病死猪体内分离出隐秘化脓杆菌,表明该细菌病的发病范围在不断扩大,特别是在规模化猪场不断扩大的情况下,更应该提高对该病的防范意识和采取有效的治疗措施。
本试验将分离到的菌株进行遗传进化树分析,结果表明该菌株与JX975440(中国新疆)、KP159746(中国河北)亲缘关系最近;与国外其他分离株的亲缘关系稍远,说明该菌的流传存在地域差异。化脓隐秘杆菌的致病性与其携带的毒力因子有关,本株化脓隐秘杆菌携带Plo(溶血素)、NanH(神经氨酸酶)、CbpA(胶原结合蛋白)三种毒力基因,其中Plo对牛多形核粒细胞具有毒性效应[13],神经氨酸酶分为NanH与NanP,具有多种毒力作用,能够增强细菌的粘附力和感染力。小鼠致病力试验结果显示,该菌对小鼠具有强致病力,说明分离得到的菌株具有致病性,其中可能与该菌携带NanH毒力基因有关。该菌从猪肺脏脓肿中分离,对猪的致病力尚不清楚,需后续动物回归试验证明。有研究表明从猪脓肿中分离到的化脓隐秘杆菌、金黄色葡萄球菌以及停乳链球菌是造成猪表皮脓肿的原因[14],本试验从仔猪肺脓肿中分离到的化脓隐秘杆菌没有其他细菌混合感染的现象,表明该菌作为病原菌的影响逐步扩大。
我国对化脓隐秘杆菌的致病机理及流行病学调查还尚不完全,特别是现代化规模猪场范围的扩大,化脓隐秘杆菌作为条件致病菌常与猪繁殖与呼吸综合征病毒、猪圆环病病毒、巴氏杆菌等混合感染引起发病,猪场饲养人员应注意找准病因,对症治疗,并注意敏感抗生素之间交替用药防止出现耐药性。本次试验通过药敏试验筛选出对头孢噻呋、阿莫西林、左氧氟沙星、头孢哌酮、头孢唑林、头孢曲松等抗生素高度敏感,对新霉素、林可霉素、丁胺卡那等常见抗生素出现耐药现象。本研究为天津地区规模化猪场化脓隐秘杆菌的预防和深入研究提供了试验依据和用药参考。

