基于iTRAQ定量蛋白质组学技术的不同感染状态结核病牛血清蛋白质组学分析
房立春,高新桃,2,林伟东,3,贾 红,郭晓宇,侯邵华,姜一曈,朱鸿飞,鑫 婷
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.中国农业科学院生物技术研究所,北京 100081;3.让布卢农学院 比利时烈日大学,让布卢 4000)
牛结核病(bovine tuberculosis,bTB)是一种危害严重的人兽共患慢性传染病,该病主要由牛型结核分枝杆菌(Mycobacterium bovis,M.bovis)感染引起,其主要特征是渐进性消瘦和患病组织形成结核结节等病变[1-3]。目前世界上对于牛结核病防控主要是基于“检测——扑杀”的策略,部分欧美发达国家已完成对该病的基本控制甚至根除[4],但在发展中国家,由于广泛的宿主范围,没有快速高通量的检测方法,扑杀淘汰巨大的财政压力导致牛结核病的防控不容乐观。我国牛结核病缺乏国家层面上流行病学调查的直接数据,主要来自于零星报道:张喜悦等[5]报道,2018年我国北方33个县牛结核病感染状况样品的个体阳性率为13.99%,群体阳性率为51.51%;韩猛等[6]报道山东省2010-2012年牛结核病阳性率分别为29.34%、27.96%和14.93%。近几年,牛结核病的防控虽有一定进展,但由于多种原因,我国牛结核病仍未得到有效控制。
结核病的感染与病程缓慢。目前人结核病与诊断相关的研究已经相对成熟,根据痰液检查是否排菌,可以将人结核病病程分为活动期和非活动期[7-12]。牛感染牛结核分枝杆菌后在活动期也可以通过鼻汁、痰液和乳汁等向环境排菌,研究表明超过15%的牛分枝杆菌感染牛能向外排分枝杆菌[13],相较于非活动期结核病牛,活动期结核病牛的危害更大。由OIE推荐的巢式PCR方法,通过扩增分枝杆菌mpb70基因的特异性片段检测牛奶、鼻液等分泌物中的病原,这是目前临床上判定结核病牛向外是否排菌的重要手段[14]。截止到目前还没有对牛结核病活动期和非活动期的区分标准,而且对于结核病牛不同感染状态的相关研究也鲜有报道。牛结核分枝杆菌感染后的患病机制及病理学改变会引起血清中相关蛋白及细胞因子相继发生一系列的动态变化,不同的感染阶段也具有不同的生理生化状态,这些动态变化的检测可为不同感染状态牛结核病的判定及诊断提供可能。利用血清中的标志物检测具有高效省时、简单易用、高通量等其他方法无法比拟的优点,因此对结核病患病牛血清蛋白谱的研究具有较高的应用价值。
同位素标记相对和绝对定量(isobaric tag for relative and absolute quantitation,iTRAQ)是一种具有高通量和高灵敏度的蛋白质组定量技术,目前已广泛应用于人结核病的早期诊断、治疗监测和评估预后[15-16],在动物疫病上的应用也有报道[17-18],但在牛结核病的相关研究中应用较少。而平行反应监测(parallel reaction monitoring,PRM)是一种靶向的蛋白质组学技术,具有选择性高、灵敏度佳和重现性好等优点,是理想的差异蛋白质验证手段[19]。本研究以核菌素皮内变态反应试验(tuberculin skin test,TST)、IFN-γ释放试验(interferon gamma release assay,IGRA)从临床筛选结核病阳性牛和阴性牛,再以PCR方法检测结核病阳性牛鼻液中牛结核分枝杆菌的抗原判定结核阳性牛是否处于排菌期。然后,利用iTRAQ技术和生物信息学手段,从不同感染状态结核病牛的血清蛋白质入手,筛选、剖析差异表达蛋白,然后以PRM方法对筛选的差异蛋白进行验证,以期寻找到牛结核病不同感染阶段的关键蛋白并阐明不同病程的机体应答生理机制差异,最终为牛结核病的诊断和防控提供理论支持。
1 材料与方法
1.1 实验动物筛 选与分组 实验动物的筛选由中国农业科学院北京畜牧兽医研究所结核病与宠物疫病诊断实验室完成。从结核病流行牛场和连续5年结核病阴性牛场中分别筛选结核病阳性、阴性荷斯坦奶牛(核菌素皮内变态反应试验按照国家标准。IFN-γ释放试验参照BovigamTM试剂盒说明书),并按照牛鼻拭子巢式PCR对结核病阳性牛进行亚分类,同时排除牛副结核病(IDEXX公司抗体检测试剂盒)、牛布鲁菌病(Svanova公司布鲁氏菌病C-ELISA试剂盒)以及牛病毒性腹泻(IDEXX公司抗体ELISA检测试剂盒)抗体阳性牛的影响。筛选标准和分组见表1。

表1 结核病牛判定标准及分组Table 1 Standard and grouping of criteria for determination of bovine tuberculosis
1.2 血清样品的制备 60头实验牛经尾根采血收集全血于6 mL促凝管中,血样经4000 ×g离心10 min,收集上层血清于1.5 mL离心管中。为降低奶牛个体差异的影响,试验选择混合样本的方法进行iTRAQ标记的蛋白质组学试验。在PCR阳性结核病阳性(TBP组,n=20)、PCR阴性结核病阳性(TBN组,n=20)和健康牛(NC组,n=20)三组中,每组随机选取10份血清按等量蛋白浓度混合均匀,每组有两个混合样品(TBP组:TBP1、TBP2;TBN组:TBN1、TBN2;NC组:NC1、NC2)。
1.3 主要试剂及材料 iTRAQ Reagent-8Plex标记试剂盒购自Applied Biosystem公司;ProteoMiner™蛋白质浓缩试剂盒购自Bio-Rad公司;高效DINOEX Ultimate 3000 BioRS液相色谱系统、MULTISCAN SPECTRUM 1500酶标仪、Legend Micro17R冷冻离心机购自Thermo公司;TripleTOF 5600+ LC-MS/MS质谱系统、ChromXP C18分析柱购自AB SCIEX公司;Durashell C18 色谱柱购自Agela公司。
1.4 iTRAQ定量蛋白组学和 PRM 靶向蛋白验证
1.4.1 蛋白抽提及定量 参照文献[20]提取蛋白,向离心管内加入DTT至终浓度10 mmol/L,56℃水浴1 h后立即加入IAM至终浓度55 mmol/L,然后置于暗室放置1 h。所得上清液根据蛋白质浓缩试剂盒说明进行血清中低丰度蛋白的富集和高丰度蛋白的去除, 最后使用bradford法定量检测高丰度蛋白去除前后的血清蛋白样品。
1.4.2 样品的酶解、iTRAQ标记蛋白及HPLC分级 选取100 μg蛋白质,体积整体调节到100 μL,加入500 μL(50 mmol/L)NH4HCO3稀释,以1∶50的质量比例(胰酶∶蛋白)加入胰酶,37℃酶解过夜;取出上述酶解液,加入等体积的0.1%FA酸化;酸化后的酶解液加入到平衡后的Strata-X C18柱子中,连续过柱3次;然后加入0.1%FA+5%乙腈清洗Strata-X C18柱子,连续清洗2次;最后取一个新的离心管,用1 mL 0.1%FA+80%乙腈洗脱1次,洗脱液经冷冻抽干后用20 μL 0.5 mol/L TEAB复溶。采用 8-plex标记,方法参考iTRAQ试剂盒操作说明。以0.5 mol/L TEAB肽段用高pH反向HPLC分级,色谱柱为Durashell C18(5 μm,100 Å,4.6×250 mm)。
1.4.3 液相色谱-串联质谱分析及差异蛋白筛选 由缓冲液A(5%乙腈、0.1%甲酸、95%H2O)和缓冲液B(95%乙腈、0.1%甲酸、5%H2O)构成流动相,将已分级的样品上样到Triple TOF 5600 plus质谱仪(AB SCIEX nanoLC-MS/MS)进行质谱序列测定,生成质谱检测原始数据。我们使用与AB Sciex 5600 plus配套的搜索引擎ProteinpilotTMV4.5对质谱的数据进行检索和筛选,同时根据差异倍数和P值来筛选出差异蛋白。当差异倍数达1.5倍及以上(即上调倍数≥1.5和下调倍数≤0.67),且经过显著性统计检验其P≤0.05时,视为显著差异蛋白。
1.4.4 PRM靶向蛋白验证 采用平行反应监测技术对iTRAQ结果进行靶向蛋白验证。蛋白制备的方法与iTRAQ方法类似,每个样品用含0.1%甲酸和3%乙腈的上样缓冲液进行溶解,离心后取上清液点样。经DDA质谱检测后,将Proteome Discoverer数据库检索的数据导入Skyline软件建立谱图库(spectra libr ary)。在谱图库中筛选靶蛋白的肽段,将靶肽段质子数/电荷数比值(m/z)加入到inclusion list中,然后使用该PRM模式对混合样品进行PRM数据采集。
1.5 生物信息学分析 通过DAVID数据库对鉴定到的所有蛋白质进行功能注释GO(gene ontology),并对显著性差异蛋白质进行蛋白质功能富集分析。同时,利用KEGG(kyoto encyclopedia of genes and genomes)数据库进行差异蛋白通路富集分析,最后对差异蛋白质互作网络进行分析。
1.6 统计学方法 应用SPSS软件(IBM,V20.0)对组间差异蛋白比值应用t检验进行比较。P<0.05表示差异显著,具有统计学意义,P<0.01表示差异极显著,具有统计学意义。
2 结果
2.1 蛋白定量 高丰度蛋白去除前后蛋白定量结果如表2所示,从定量结果来看,本实验所获得的3个不同组别共6份血清样品(TBP1、TBP2、TBN1、TBN2、NC1、NC2)的总蛋白的提取以及高丰度蛋白的去除成功。
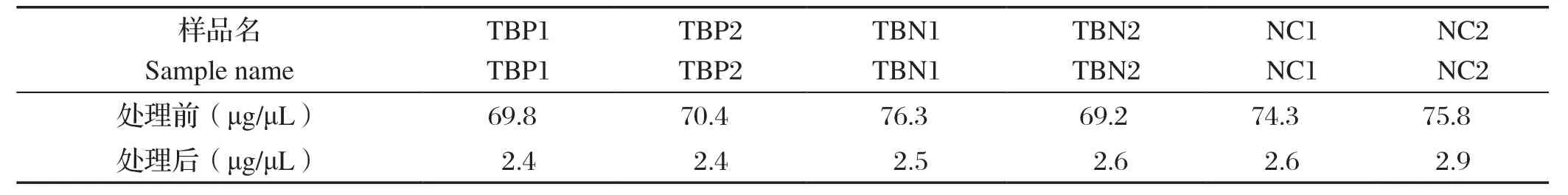
表2 高丰度蛋白去除前后血清样本蛋白定量结果Table 2 Concentrations of serum protein before and after deletion of high abundant proteins
2.2 iTRAQ鉴定血清差异蛋白 根据差异倍数≥1.5或者≤0.67倍,P≤0.05,同时剔除未知功能蛋白的条件,我们得到两两组间已知的差异蛋白,数量统计见表3。由表3可知,TBP/TBN组共鉴定到的显著性差异蛋白74个,其中上调蛋白46个,下调蛋白28个;TBP/NC组和TBN/NC组分别鉴定到195和216个显著性差异蛋白,将两组数据合并得到TB/NC组,共得到223个显著性差异蛋白,其中上调112个,下调111个。可见,不同感染状态结核病牛各组间呈现出数量较多的差异蛋白。
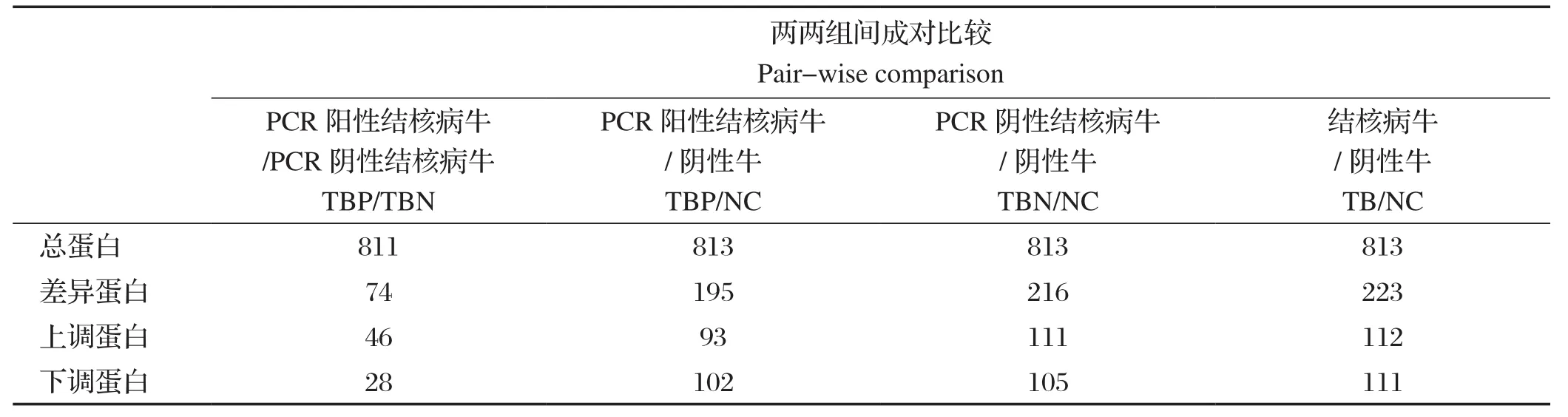
表3 两两组间蛋白显著性差异数量Table 3 Numbers of differentially expressed proteins in pair-wise comparisons
2.3 PRM验证 由表4可知,在6个目的蛋白的PRM验证中,由于方法敏感性的提高,部分iTRAQ结果未鉴定到的显著性差异蛋白在PRM中被鉴定出来。PRM验证结果在整体趋势上与iTRAQ结果基本一致,但是各组间差异倍数相较于iTRAQ结果有不同程度的降低。
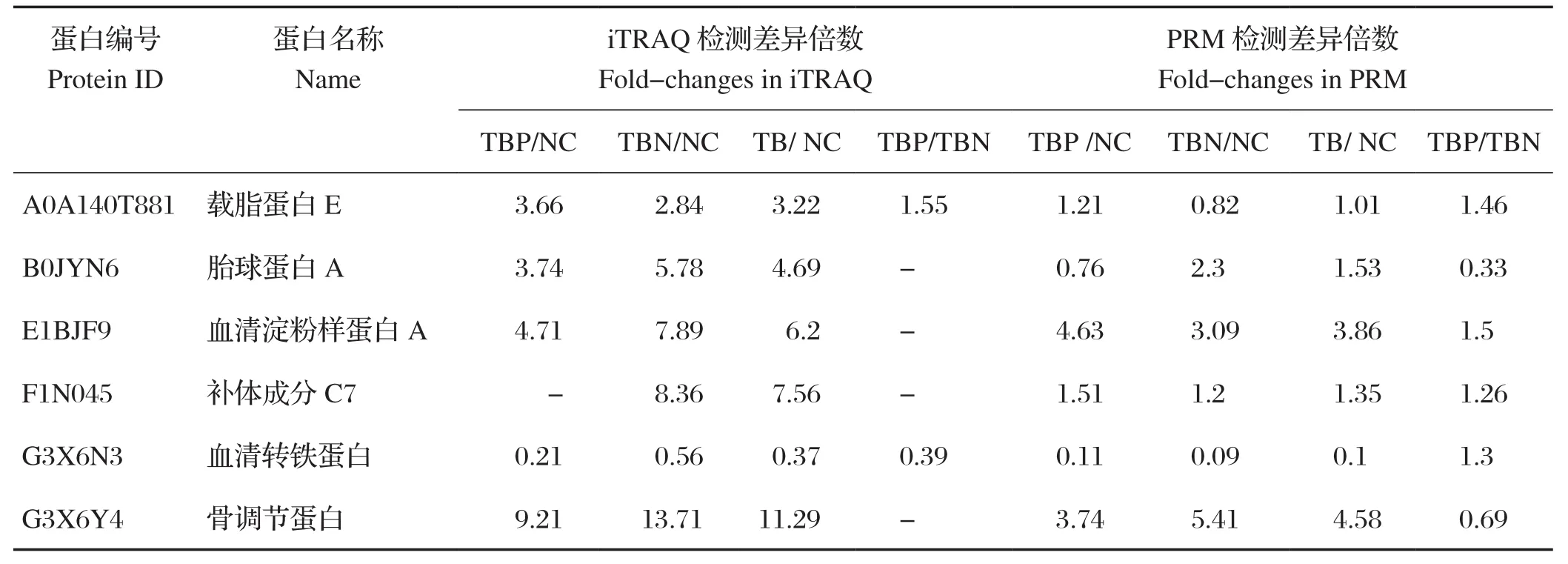
表4 PRM验证用血清差异蛋白Table 4 Serum differentially expressed proteins selected for PRM verification
2.4 血清差异蛋白生物信息学分析 为了更好地解释和剖析牛结核病不同感染状态之间血清差异蛋白谱,我们对处于排菌期的结核病阳性牛(TBP组)和非排菌期的结核病阳性牛(TBN组)的血清差异蛋白,以及结核病阳性牛(TB组)与健康牛组(NC组)间血清差异蛋白进行了注释,同时完成了生物信息学分析。
2.4.1 TBP/TBN组差异蛋白GO与KEGG富集分析 由TBP/TBN组血清差异蛋白GO富集分析可知,在生物学进程方面组间差异蛋白主要参与凝血和纤维蛋白凝块形成,血小板激活和蛋白质聚合;在分子功能方面主要具有结构分子活性,受体结合以及肝素结合等功能;在细胞组分方面主要是定位于胞外区、外泌体和血液微粒。TBN/TBN组间血清差异蛋白共富集在5条KEGG通路上(P≤0.05),其中补体和凝血级联(complement and coagulation cascades)富集显著性最强(P=6.85E-14)且富集差异蛋白数目最多((12/74),见图1A。
2.4.2 TB/NC组差异蛋白GO与KEGG富集分析 由TB/NC组血清差异蛋白GO富集分析可知,在生物学进程上组间差异蛋白主要参与血小板聚集,细胞间黏附和内肽酶活性的负调控;在分子功能方面主要具有钙离子结合,钙粘蛋白结合参与细胞间黏附和肝素结合等功能;差异蛋白在细胞组分上与TBP/TBN组相似,主要定位于细胞外泌体,胞外空间和血液微粒。TB/NC组间血清差异蛋白共富集在18条KEGG通路上(P≤0.05),其中补体和凝血级联(complement and coagulation cascades)、局灶性黏连(focal adhesion)和血小板激活途径(platelet activation)富集显著性较强,见图1B。
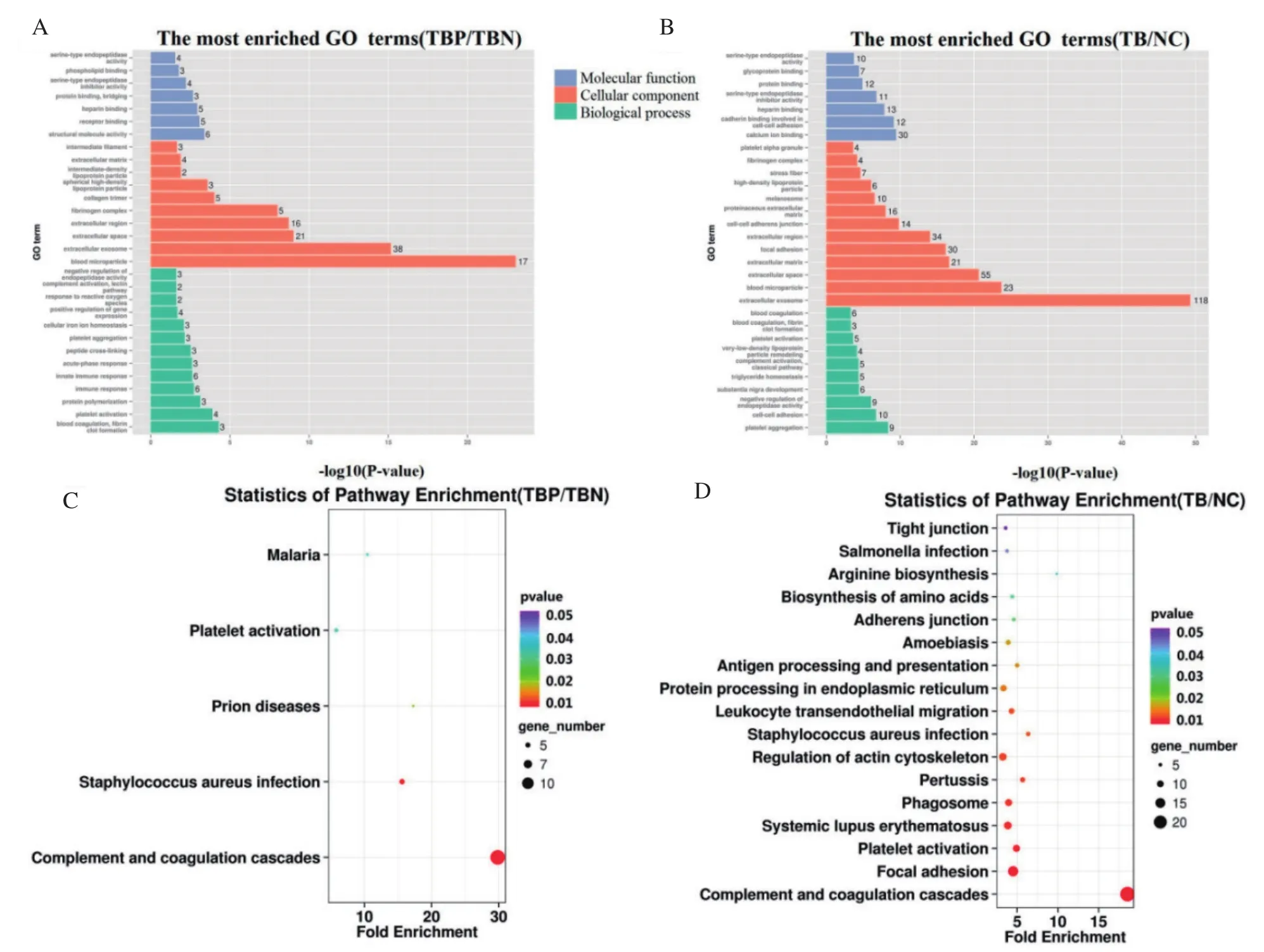
图1 差异蛋白GO功能分析和KEGG通路分析Fig.1 GO functional analysis and KEGG pathway analysis of differentially expressed proteins
2.4.3 差异蛋白互作分析 将组间血清差异蛋白进一步用STRING数据库进行互作网络分析,蛋白互作关系如图2所示。结果表明,鉴定到的血清差异蛋白绝大部分被互作网络覆盖,表明具有较好的生物学联系,少数游离于互作网络之外蛋白的可能由于功能相对独立或者与其他蛋白互作的可信度不高导致,TBP/TBN和TB/NC组的KEGG通路分析均表明,差异蛋白在补体和凝血级联这一通路中不仅显著性最强,而且富集的蛋白数目最多;TBP/TBN以及TB/NC组间差异蛋白的STRING蛋白互作关系同样证实了这一现象(图2A、2B),红色方框内表明补体和凝血级联通路中的差异蛋白互作关系,且该通路模块位于互作网络中较为核心的位置,红色圈内表示上调表达蛋白,蓝色圈内表示下调表达蛋白。

图2 蛋白质互作分析Fig.2 Analysis for protein interactions
3 讨论
牛感染结核分枝杆菌后主要通过免疫反应和炎症反应对入侵的病原体进行防御,结核分枝杆菌在感染宿主过程中必然改变宿主蛋白质的表达或者改变蛋白质的相互作用,这些蛋白的改变则能够反应患病的状态。本研究利用iTRAQ技术对牛结核病不同感染状态下血清差异蛋白进行了分析,对比发现结核病阳性牛与健康牛间共鉴定到223个显著性差异蛋白,在结核病阳性牛按照是否处于排菌期判定的两个亚分类(TBP/TBN)间鉴定到74个显著性差异蛋白。通过PRM对部分蛋白靶向验证,结果与iTRAQ结果趋势一致,证实了差异蛋白筛选的可靠性。因此本研究证实了结核病牛在患病后血清蛋白出现了巨大的变化,并且在排菌与非排菌两个病症下血清蛋白也出现了显著的变化,这些差异蛋白谱均反映了牛结核病不同感染状态内的蛋白质基础和病理机制。
在差异蛋白生物信息学分析过程中,我们发现了一个有趣的现象。不管TB/NC组还是TBP/TBN组,补体与凝血级联这一通路中不仅富集到的差异蛋白数目最多而且显著性也最强。
补体系统作为宿主一种重要的生物学作用的效应系统和效应放大系统,广泛参与机体免疫调节,介导免疫溶菌和溶血作用,同时也是连接固有免疫和获得性免疫的桥梁[21]。动物患病时其总补体含量或单一补体分子含量可发生改变,因此对体液中补体水平的测定,在疫病的诊断中具有一定意义。在本研究中,相对NC组,TB组的C4A、C6、C8B和CFH等补体分子均显著上调表达(图2),补体分子C4上调表达可以趋化中性粒细胞和巨噬细胞,增强对病原体的吞噬作用;补体分子C6、C8等作为免疫溶菌的效应分子,其上调表达表明机体对结核杆菌感染的靶细胞的溶解破坏作用增强。以上表明结核病病牛补体系统被广泛的激活,补体系统在机体抗菌过程中发挥了重要作用。相对TBN组,TBP组以C1QA和C1QC为代表的补体分子也显著性上调(图2),补体分子C1是经典激活途径中的起始识别成分,C1分子在排菌期的结核病病牛中较非排菌期表达量显著上调,表明机体正处于对抗原进行识别的阶段,据此推断排菌期可能是结核病病程的早期阶段。值得注意的是,已有研究表明C1Q在活动性结核病病人外周血中的表达量显著高于潜伏性病人和健康对照组[22],我们的结果与上述发现一致,这表明C1Q的表达量在结核病病人与结核病病牛中是一致的。综上,结核病病牛机体的补体系统在不同感染状态下以不同的途径被全面激活,说明在天然防御系统中,特别是在感染的早期,补体系统起着重要的作用。结核分枝杆菌作为胞内感染菌,虽然能诱导机体产生抗体,但抗体只能与释放出的细菌接触起辅助作用,因此结核杆菌的免疫杀伤主要依靠吞噬作用以及细胞因子的杀伤作用。本研究表明结核杆菌感染后补体系统被广泛激活,但补体系统和结核杆菌之间的相互作用以及补体系统如何发挥抗结核作用,仍需要进一步研究。
针对凝血系统,研究人员在活动性肺结核凝血改变的研究中发现,纤维蛋白原含量的增加可诱导高凝状态,而且结核病患者比健康人群更容易发生内源性的凝血[23]。本研究发现,牛感染结核杆菌后凝血系统的促凝血途径和抗凝血途径发生了紊乱。一方面,结核病感染牛的重要的凝血因子纤维蛋白原(Fibrinogen)显著低于健康牛,具有抑制凝血酶合成的抗凝血因子-维生素K依赖性蛋白S(vitamin K-dependent protein S,PROS)显著高于健康牛,呈现出抗凝血的作用;另一方面,结核病感染牛的促凝血因子Ⅴ、Ⅶ、Ⅸ、ⅩⅢ均显著高于健康牛,呈现出了疑似高凝血状态。
人结核病容易出现高凝血状态的现象与本研究牛结核病凝血系统的紊乱失调存在矛盾。传统观念认为凝血系统和免疫补体系统二者无关联,但最近发现,先天性免疫和凝血系统相互作用,在病理或应激条件下存在相互联系,共同协调防御病原体侵入和对机体造成的伤害[24]。因此我们怀疑牛结核病凝血系统紊乱与补体系统的激活有关。多种细胞因子(包括补体)可直接或间接激活机体凝血系统,干扰抗凝系统,导致机体凝血功能的失调。结核分枝杆菌和宿主单核巨噬细胞系统相互作用而影响血管内皮细胞合成大量的细胞因子,诱导纤溶系统激活,导致凝血因子上升[25]。本研究中的C4a和C6等补体因子水平显著升高,补体系统过度活化,凝血因子也加重被消耗,则可能是导致结核病牛凝血因子低于健康牛的原因。总之,凝血系统在牛结核病感染过程当中所发挥的作用极其复杂,本研究仅仅是说明了这一现象,其中涉及的机理仍需进一步的探索。
本研究结合蛋白质组学方法获取了不同感染状态结核病病牛血清差异蛋白谱,并构建了可视化的蛋白质相互作用网络,研究数据显示了结核病病牛在不同感染状态血清差异蛋白主要与补体和凝血系统有关。本研究提供了新的角度来认识牛结核病的不同的发展阶段,为牛结核分枝杆菌与宿主之间的相互关系及演变规律提供了基础数据,可为牛结核病的临床诊断提供一定的客观依据,服务于我国牛结核病的防控。

